Beruflich Dokumente
Kultur Dokumente
Comprobación de la Ley de Boyle-Mariotte en una jeringa (PV=κ
Hochgeladen von
VictorR.AriasOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Comprobación de la Ley de Boyle-Mariotte en una jeringa (PV=κ
Hochgeladen von
VictorR.AriasCopyright:
Verfügbare Formate
Comprobación de la Ley de Boyle – Mariotte para un gas dentro de
una jeringa
Sierra Zapata Karla Samara
La ley de Boyle-Mariotte sirve para calcular la presión y el volumen de un gas al combinarla con
otras fórmulas y leyes de gases como es el caso del presente trabajo en el cual se comprobó que
mientras más volumen ocupe el gas menor será la presión y viceversa, es decir que se trata de
valores inversamente proporcionales. Se empleó el método de ajuste lineal por mínimos
cuadrados para comprobar esta Ley a través de la correlación lineal que nos indica cuando los
datos son inversamente o directamente proporcionales.
La ley de Boyle fue descubierta por Robert Boyle al año de 1662 al mismo tiempo que Edme
Mariotte pero sus trabajos no son publicados hasta 1676; sin embargo, al ser publicados, la Ley
pasa a a ser conocida como Ley de Boyle – Mariotte por ambos científicos.
La Ley nos indica que cuando se tiene temperatura constante, la presión de un gas que no cambia
de cantidad, es inversamente proporcional al volumen que éste ocupa. Es decir que si la presión
aumenta, el volumen del gas disminuye y si la presión disminuye, el volumen de gas aumenta.
Figura 1. Ejemplo de la Ley de Boyle; a menor volumen mayor presión (izquierda), a mayor volumen menor presión
(derecha).
Lo que sucede en esta Ley es que al aumentar el volumen del gas, las partículas tardan más en
llegar de un lado a otro del recipiente que las contiene por lo que chocan menos entre ellas.
Conforme va disminuyendo el volumen, la distancia entre las partículas se hace menor
provocando que choquen más entre ellas mismas y esto significa que aumenta la presión.
PV = κ
Técnicas experimentales Página 1
A través de relaciones y de diferentes experimentos y la combinación de diferentes modelos y
procedimientos matemáticos como la Ley de Charles, la de Gay-Lussac, se llega luego de muchos
años a la siguiente fórmula.
PV = N RT
Donde P es presión, V volumen, N es el número de moles del gas, R es la constante Universal de
los gases ideales y T es la temperatura.
Con la realización de éste experimento se busca comprobar la Ley de Boyle – Mariotte para los
gases ideales a partir de un sistema físico que simule la Ley y se observará el comportamiento de
las variables a tratar y las relaciones entre ellas
Metodología
A través de un sistema físico montado en el laboratorio con una tabla de madera que cuenta con
una ranura circular, una pinza de presión, una jeringa sellada para que no pueda escapar gas y
pesas de diferentes masas se realizó el procedimiento experimental para la Ley de Boyle.
Se utilizaron 8 pesas de diferente masa y la incertidumbre se obtuvo de la balanza granataria;
primeramente se calibró la balanza de tal modo que la línea de la pluma coincidiera con la línea de
la base; se obtuvo el valor en gramos de todas las pesas, para obtener el valor de la pesa más
grande ya que superaba el valor de 1kg (la máxima escala de la balanza utilizada) se requirió usar
un contrapeso de 1kg.
Enseguida, se colocó la pinza de presión sujetando la tabla de madera de manera que el orificio
quedara hacia afuera de la mesa para que fácilmente se pudiera introducir la jeringa ya sea con la
punta hacia arriba para colgar las pesas del émbolo. Las pesas se colocaron amarradas de hilo
cáñamo al émbolo de la jeringa una por una. Posteriormente se anotaron los cambios del
desplazamiento que señala la jeringa graduada referente a cada cambio de masas que ejerce
fuerza sobre el émbolo de la jeringa dependiendo de que pesa se estuviera empleando.
La temperatura se tomó como temperatura constante a 20°C; se midió el diámetro interno de la
jeringa para fines de calcular los cambios en el volumen.
Se obtuvo el log de base 10 de cada valor de presión y de volumen para después graficar los
valores de Ln P vs. Ln V y así facilitar el cálculo de las aproximaciones a la recta por el método de
mínimos cuadrados.
El procedimiento experimental fue realizado 3 veces para mejorar la calidad de los datos y
comparar los resultados obtenidos.
Resultados
Los datos obtenidos con la balanza granataria al medir los pesos de cada una de las pesas
utilizadas se obtuvo cuidadosamente y se plasmó en la siguiente tabla para facilitar su manejo.
Técnicas experimentales Página 2
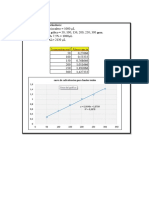
Pesa Valor del peso (g) Incertidumbre (g)
1 1068.8 ± 0.05
2 494.5 ± 0.05
3 99.1 ± 0.05
4 101.9 ± 0.05
5 53.2 ± 0.05
6 53.2 ± 0.05
7 25.2 ± 0.05
8 25.7 ± 0.05
Tabla 1. Valores del peso e incertidumbre de cada pesa.
Con la jeringa hacia arriba, se tomaron los datos de cada pesa y se acomodaron en la siguiente
tabla de acuerdo al número de veces que se realizó el experimento y al volumen inicial y final y al
total desplazado.
1 2 3
Pesa Vi Vf Vt Pesa Vi Vf Vt Pesa Vi Vf Vt
1 20 24 4 1 20 24 4 1 20 23 3
2 24 27 3 2 24 27 3 2 23 26 3
3 27 28 1 3 27 27 0 3 26 27 1
4 28 29 1 4 27 29 1 4 27 27 0
5 29 29 0 5 29 29 0 5 27 28 1
6 29 29 0 6 29 29 0 6 28 28 0
7 29 29 0 7 29 29 0 7 28 28 0
8 29 29 0 8 29 29 0 8 28 28 0
Tabla 2. Medición de los volúmenes desplazados en la jeringa. Vi= volumen inicial, Vf= vol. Final, Vt= vol. Total
desplazado dentro de la jeringa. Todos los volúmenes se encuentran expresados en mL 3.
El diámetro interno medido fue de 2.8 cm ± 0.05cm, por lo que el radio corresponde a 1.4 cm ±
0.05cm. El área de la jeringa se obtuvo mediante la fórmula de A = πr² obteniendo un valor de
4.39824cm² ± 0.0025cm².
Al calcular la presión por la fórmula dada PV = N RT, se necesita sacar el volumen del cilindro para
el cual tomamos los valores del volumen desplazado final como la altura del cilindro y se multiplicó
por el área para cumplir la fórmula de volumen V = Ah.
Altura (h) Área (πr²) Volumen (Ah)
0.24 4.39824 1.0555776
0.27 4.39824 1.1875248
0.28 4.39824 1.2315072
0.29 4.39824 1.2754896
0.29 4.39824 1.2754896
0.29 4.39824 1.2754896
0.29 4.39824 1.2754896
0.29 4.39824 1.2754896
Técnicas experimentales Página 3
Tabla 3. Valores de los volúmenes de la primera realización del experimento. Altura en mm (±0.05cm), Área en cm²
(±0.0025 cm²), Volumen en cm³ (± cm³)
Altura (h) Área (πr²) Volumen (Ah)
0.24 4.39824 1.0555776
0.27 4.39824 1.1875248
0.27 4.39824 1.1875248
0.29 4.39824 1.2754896
0.29 4.39824 1.2754896
0.29 4.39824 1.2754896
0.29 4.39824 1.2754896
0.29 4.39824 1.2754896
Tabla 4. Valores de los volúmenes de la segunda realización del experimento. Altura en mm (±0.05cm), Área en cm²
(±0.0025 cm²), Volumen en cm³ (± cm³)
Altura (h) Área (πr²) Volumen (Ah)
0.23 4.39824 1.0115952
0.26 4.39824 1.1435424
0.27 4.39824 1.1875248
0.27 4.39824 1.1875248
0.28 4.39824 1.2315072
0.28 4.39824 1.2315072
0.28 4.39824 1.2315072
0.28 4.39824 1.2315072
Tabla 5. Valores de los volúmenes de la tercera realización del experimento. Altura en mm (±0.05cm), Área en cm²
(±0.0025 cm²), Volumen en cm³ (± cm³)
Para calcular la presión mediante la fórmula antes mencionada se sustituyeron los valores en la
𝐿 𝑎𝑡𝑚
fórmula y sé tomó R como 0.08205746 𝐾 𝑚𝑜𝑙 y la N al ser constante se elimina con los mol de la R;
la Temperatura es de 20°C por lo que la presión obtenida nos queda finalmente en términos de
atm.
Presion Exp. 1 Presión Exp. 2 Presión Exp. 3
1002.2976 1002.2976 1045.8758
890.9312 890.9312 925.1978
859.1123 890.9312 890.9312
829.4877 829.4877 890.9312
829.4877 829.4877 859.1123
829.4877 829.4877 859.1123
829.4877 829.4877 859.1123
829.4877 829.4877 859.1123
Tabla 6. Presiones de las tres realizaciones del experimento. Presión en atm.
Técnicas experimentales Página 4
Al calcularse los logaritmos de volumen y presión se obtuvieron los valores especificados en la
tabla.
1 2 3
Log V Log P Log V Log P Log V Log P
0.0540 6.9100 0.0540 6.9100 0.0115 6.9526
0.1718 6.7922 0.1718 6.7922 0.1341 6.8300
0.2082 6.7558 0.1718 6.7922 0.1718 6.7922
0.2433 6.7208 0.2433 6.7208 0.1718 6.7922
0.2433 6.7208 0.2433 6.7208 0.2082 6.7558
0.2433 6.7208 0.2433 6.7208 0.2082 6.7558
0.2433 6.7208 0.2433 6.7208 0.2082 6.7558
0.2433 6.7208 0.2433 6.7208 0.2082 6.7558
Tabla 7. Valores de Ln V y Ln P de las tres realizaciones del procedimiento experimental.
0.3
0.25
0.2
ln V
0.15
Linear (Yi)
0.1
0.05
0
6.7 6.75 6.8 6.85 6.9 6.95
ln P
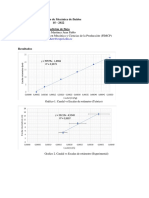
Gráfica 1. Ln P vs. Ln V. Primera realización del experimento.
El método de mínimos cuadrados se aplicó a la primera realización del experimento.
((Xi − ̅
X)(Yi − ̅
Y))
𝑏=
̅ 2
((Xi − X) )
𝑎 = 𝑌̅ − 𝑏𝑋̅
̅)(Yi − Y
∑(Xi − X ̅)
𝑟=
√∑(Xi − ̅
X)² ∑(Yi − ̅
Y)²
Se obtuvieron mediante los cálculos necesarios los valores de a, b y r para realizar la comparación
de los datos.
Técnicas experimentales Página 5
i Xi Yi (Xi-X )̅ (Yi-Y )̅ (Xi-X )̅ ² (Yi-Y )̅ ²
1 6.91 0.054 -0.02318958 0.023180063 0.0231991
2 6.7922 0.1718 -0.00118896 0.001186803 0.00119111
3 6.7558 0.2082 -3.6806E-06 3.8025E-06 3.5627E-06
4 6.7208 0.2433 -0.00136669 0.001365302 0.00136808
5 6.7208 0.2433 -0.00136669 0.001365302 0.00136808
6 6.7208 0.2433 -0.00136669 0.001365302 0.00136808
7 6.7208 0.2433 -0.00136669 0.001365302 0.00136808
8 6.7208 0.2433 -0.00136669 0.001365302 0.00136808
Promedio 6.75775 0.2063125
Tabla 8. Datos necesarios para el método de mínimos cuadrados.
Al sustituir los valores de los datos en las fórmulas de a, b y r se obtuvo que
a=6.9680
b=-1.0005
r=-0.9999
Discusión
El procedimiento realizado puede presentar algunos errores debido a la baja calidad de la
graduación de la jeringa, y algunos errores en la toma de las mediciones.
Sin embargo, los resultados son aproximados a los correctos ya que al realizar tres veces el mismo
procedimiento se tomó el que menos variaciones tenía con respecto de los otros para calcular los
datos necesarios para hacer la regresión lineal por mínimos cuadrados.
Los resultados esperados eran que el valor de r o m dieran un valor cerca de -1 ya que
teóricamente es inversamente proporcional el volumen con respecto a la presión.
Conclusiones
Los resultados obtenidos fueron muy cercanos a los esperados ya que r generó un valor de -0.9999
lo que nos indica que la Ley de Boyle se comprueba con éste método al mostrarnos que los valores
de Volumen y de Presión son inversamente proporcionales.
El método de ajuste lineal por mínimos cuadrados nos deja conocer también cuando los datos son
o no son proporcionales, es decir, si el valor se acerca a 1 significa que los datos son directamente
proporcionales y si se acercan a -1 significa que nuestros datos son inversamente proporcionales.
Referencias
Técnicas experimentales Página 6
Búsqueda en línea
http://www.juntadeandalucia.es/averroes/recursos_informaticos/andared02/leyes_gases
/ley_boyle.html, sin autores. [Consultado el 11 de Noviembre de 2013]
Búsqueda en línea
http://arquimedes.matem.unam.mx/DescartesBasico/udies/UDIE_0_Gas_Ideal.pdf, Sin
autores. [Consultado el 11 de Noviembre de 2013]
Búsqueda en línea http://es.wikipedia.org/wiki/Ley_de_Boyle-Mariotte, 2013.
[Consultado el 11 de Noviembre de 2013].
Búsqueda en línea http://ciencia-basica-experimental.net/minimos.htm, 2013.
[Consultado el 12 de Noviembre de 2013]
Experimentación. D.C. Baird. Prentice-Hall. México
Técnicas experimentales Página 7
Das könnte Ihnen auch gefallen
- Practica 4Dokument6 SeitenPractica 4Angel RodrigoNoch keine Bewertungen
- Relación Entre La Masa y La Cantidad de MovimientoDokument11 SeitenRelación Entre La Masa y La Cantidad de MovimientoElio SandroNoch keine Bewertungen
- Teorema de SteinerDokument4 SeitenTeorema de SteinerJavierNoch keine Bewertungen
- Ley de BoyleDokument10 SeitenLey de BoyleEnrique RazgadoNoch keine Bewertungen
- Medir longitud, masa y tiempo con instrumentos de laboratorioDokument12 SeitenMedir longitud, masa y tiempo con instrumentos de laboratorioHerbert CoyNoch keine Bewertungen
- Análisis del error en mediciones físicasDokument12 SeitenAnálisis del error en mediciones físicasCamilo Suarez100% (1)
- Informe 3Dokument8 SeitenInforme 3zhou yixuanNoch keine Bewertungen
- Reporte de Practica3Dokument6 SeitenReporte de Practica3Alonso GallegosNoch keine Bewertungen
- Laboratorio 3 FisicaDokument13 SeitenLaboratorio 3 FisicaYanela CamargoNoch keine Bewertungen
- Informe 4 de Fisica Ii - Densidad de Liquidos y SolidosDokument15 SeitenInforme 4 de Fisica Ii - Densidad de Liquidos y Solidosflavia alejandraNoch keine Bewertungen
- Trabajo Experimental Principio de PascalDokument11 SeitenTrabajo Experimental Principio de PascalKevinEcosAlaNoch keine Bewertungen
- PRÁCTICA No 6 Principio de ArquimedesDokument8 SeitenPRÁCTICA No 6 Principio de ArquimedesMario Edson Pimentel RomeroNoch keine Bewertungen
- Práctica - 1 - Bloque - 2 - Lab - TermofluDokument13 SeitenPráctica - 1 - Bloque - 2 - Lab - TermofluAlexis CamarenaNoch keine Bewertungen
- Informe Bomba en Serie y ParaleloDokument7 SeitenInforme Bomba en Serie y ParaleloBeto Rivera100% (1)
- Principio de TorrencelliDokument8 SeitenPrincipio de TorrencelliStefany MamaniNoch keine Bewertungen
- Viscosidad de Los FluidosDokument11 SeitenViscosidad de Los Fluidos'Luciano SenaNoch keine Bewertungen
- Memoria MuelleDokument10 SeitenMemoria MuelleDiego Borrell RubioNoch keine Bewertungen
- Practica 5 PrisDokument8 SeitenPractica 5 PrisPriscila DelgadoNoch keine Bewertungen
- Balanza de Peso MuertoDokument2 SeitenBalanza de Peso Muertopiwa rodriguezNoch keine Bewertungen
- Informe de Laboratorio #6 de FisicaDokument12 SeitenInforme de Laboratorio #6 de FisicaSerNoch keine Bewertungen
- Calibración presión balanza pesosDokument2 SeitenCalibración presión balanza pesospiwa rodriguezNoch keine Bewertungen
- Informe Final 2 de Circuitos Electronicos 1 1Dokument4 SeitenInforme Final 2 de Circuitos Electronicos 1 1Bryan André BMNoch keine Bewertungen
- Modelo Informe Lab 2020-2Dokument12 SeitenModelo Informe Lab 2020-2Palacios M. CristianNoch keine Bewertungen
- Laboratorio 1 de FisicoquímicaDokument4 SeitenLaboratorio 1 de FisicoquímicasindyNoch keine Bewertungen
- Laboratorio 1 de FisicoquímicaDokument4 SeitenLaboratorio 1 de FisicoquímicasindyNoch keine Bewertungen
- Practica 4, Constante Elastica de Un Muelle, Jose Carlos Pagán Ruiz, Lucas Moreno BertosDokument12 SeitenPractica 4, Constante Elastica de Un Muelle, Jose Carlos Pagán Ruiz, Lucas Moreno BertosJosé Carlos PagánNoch keine Bewertungen
- Cualificación de BalanzasDokument6 SeitenCualificación de Balanzasoscar chavezNoch keine Bewertungen
- Es EsteDokument11 SeitenEs EsteAmilk Rodelo AguirreNoch keine Bewertungen
- Informe ConvecciónDokument7 SeitenInforme ConvecciónKevin Torres ValenciaNoch keine Bewertungen
- 5to Informe de LaboratorioDokument12 Seiten5to Informe de LaboratorioKaomiNoch keine Bewertungen
- TERMODINÁMICADokument4 SeitenTERMODINÁMICAFernando EstradaNoch keine Bewertungen
- Actividad Experimental IDokument4 SeitenActividad Experimental IJuan Carlos Torres MendozaNoch keine Bewertungen
- ViscosidadLíquidoMétodoStokesDokument14 SeitenViscosidadLíquidoMétodoStokesWiwiDataNoch keine Bewertungen
- Informe de Laboratorio N 5Dokument8 SeitenInforme de Laboratorio N 5Paula Andrea Usta de la Peña.Noch keine Bewertungen
- El Resumen FisicaDokument13 SeitenEl Resumen Fisicakatherine letelierNoch keine Bewertungen
- Informe 1 Ley de Boyle YaaaaaaaaaaaDokument55 SeitenInforme 1 Ley de Boyle YaaaaaaaaaaaErick Anderson Zapata RodriguezNoch keine Bewertungen
- Lab Report Ley de HookeDokument4 SeitenLab Report Ley de HookeVALENTINA JIMENEZ VILARÓNoch keine Bewertungen
- Reporte de Practica 3Dokument7 SeitenReporte de Practica 3Manuel ArenasNoch keine Bewertungen
- FQP3Dokument11 SeitenFQP3Escalona Romero Jonathan JosuéNoch keine Bewertungen
- Ley de CharlesDokument11 SeitenLey de CharlesEnrique RazgadoNoch keine Bewertungen
- Informe Virtual #04 Elasticidad de Un Resorte - 2022 - 10 UPAO - ArqDokument6 SeitenInforme Virtual #04 Elasticidad de Un Resorte - 2022 - 10 UPAO - ArqJEYSON NEYRA VALLENoch keine Bewertungen
- Oscilaciones F2 (Error Un Poquito Alto)Dokument9 SeitenOscilaciones F2 (Error Un Poquito Alto)STEFANO GIORDANO MARTORELLI RIOSNoch keine Bewertungen
- Practica 2Dokument10 SeitenPractica 2Be “The DLCGamers” HeshNoch keine Bewertungen
- Fisica Experimental Examen Final VirtualDokument13 SeitenFisica Experimental Examen Final VirtualMateo Botero GiraldoNoch keine Bewertungen
- infEFECTO JOULEDokument13 SeiteninfEFECTO JOULEVictor Hair Santacruz MuñozNoch keine Bewertungen
- Espectrofotometría visible: Demostración de las leyes fotométricas y error relativo de concentraciónDokument10 SeitenEspectrofotometría visible: Demostración de las leyes fotométricas y error relativo de concentraciónBe “The DLCGamers” HeshNoch keine Bewertungen
- Fisicoquímica - Ley de BoyleDokument9 SeitenFisicoquímica - Ley de Boyle21031361Noch keine Bewertungen
- Método Del AnilloDokument6 SeitenMétodo Del Anillonatalia.vallejoo.04Noch keine Bewertungen
- Presión aire mercurio manómetro UDokument6 SeitenPresión aire mercurio manómetro UEstibenqy ParedsNoch keine Bewertungen
- Informe 6. M.A.S. Péndulo SimpleDokument6 SeitenInforme 6. M.A.S. Péndulo SimpleIvana UtrerasNoch keine Bewertungen
- Informe 1 Medicion de FlujoDokument4 SeitenInforme 1 Medicion de FlujoJuan HerreraNoch keine Bewertungen
- Informe Labo 3 Fisica 2Dokument5 SeitenInforme Labo 3 Fisica 2Viky D FarfánNoch keine Bewertungen
- Ley de BoyleDokument5 SeitenLey de BoyleDieguito BravoNoch keine Bewertungen
- Principio de ArquímedesDokument16 SeitenPrincipio de ArquímedesHibaNoch keine Bewertungen
- Laboratorio N°2 Comportamiento PVT de Los Gases IdealesDokument19 SeitenLaboratorio N°2 Comportamiento PVT de Los Gases IdealesStefy Nina RuedaNoch keine Bewertungen
- Informe #4 Lab. de FísicaDokument10 SeitenInforme #4 Lab. de FísicajairoNoch keine Bewertungen
- Universidad Mayor de San Andrés Facultad de Ciencias Puras Y Naturales Carrera de Informática GESTION II/2022Dokument7 SeitenUniversidad Mayor de San Andrés Facultad de Ciencias Puras Y Naturales Carrera de Informática GESTION II/2022Israel UcharicoNoch keine Bewertungen
- Ley de HookeDokument10 SeitenLey de HookeMiguel Suni SalasNoch keine Bewertungen
- Práctica 3 Movimiento ArmónicoDokument21 SeitenPráctica 3 Movimiento ArmónicoComandante ChachiloverNoch keine Bewertungen
- Cuaderno de Informes 2Dokument13 SeitenCuaderno de Informes 2Guillermo SalazarNoch keine Bewertungen
- Formatos Xiv CemvDokument6 SeitenFormatos Xiv CemvLiz MarhisolNoch keine Bewertungen
- Aspectos MatrizDokument1 SeiteAspectos MatrizVictorR.AriasNoch keine Bewertungen
- Linea Base PDFDokument2 SeitenLinea Base PDFVictorR.AriasNoch keine Bewertungen
- Equilibrio QuímicoDokument34 SeitenEquilibrio QuímicoRobert100% (5)
- Aspectos MatrizDokument1 SeiteAspectos MatrizVictorR.AriasNoch keine Bewertungen
- Equilibrios Ionicos y Sus Aplicaciones Analiticas PDFDokument417 SeitenEquilibrios Ionicos y Sus Aplicaciones Analiticas PDFECienfuegos75% (8)
- Linea BaseDokument2 SeitenLinea BaseVictorR.AriasNoch keine Bewertungen
- ABC de Las Matrículas 2019 - UNSA PDFDokument37 SeitenABC de Las Matrículas 2019 - UNSA PDFJuan Carlos TPinto0% (2)
- Modelo Solicitud Inscripcion Reg GytDokument1 SeiteModelo Solicitud Inscripcion Reg GytJose Luis Lopa VergaraNoch keine Bewertungen
- Linea Base PDFDokument2 SeitenLinea Base PDFVictorR.AriasNoch keine Bewertungen
- La Elaboración Del Pan - Docx TraduccionDokument8 SeitenLa Elaboración Del Pan - Docx TraduccionVictorR.AriasNoch keine Bewertungen
- Como Fabricar Jabón Casero Reciclando Aceite UsadoDokument10 SeitenComo Fabricar Jabón Casero Reciclando Aceite Usadohexamina100% (1)
- Sesion Pedagógica 6Dokument2 SeitenSesion Pedagógica 6VictorR.AriasNoch keine Bewertungen
- Protocolo de Toma de Muestras de Agua Residual Ver 2Dokument10 SeitenProtocolo de Toma de Muestras de Agua Residual Ver 2VictorR.AriasNoch keine Bewertungen
- ABC de Las Matrículas 2019 - UNSA PDFDokument37 SeitenABC de Las Matrículas 2019 - UNSA PDFJuan Carlos TPinto0% (2)
- Curva Folin CiocalteoDokument1 SeiteCurva Folin CiocalteoVictorR.AriasNoch keine Bewertungen
- S GUIA-MUESTREO-SUELO - MINAM 1 PDFDokument39 SeitenS GUIA-MUESTREO-SUELO - MINAM 1 PDFricardoNoch keine Bewertungen
- Informe Final de Quimica Fisica IIDokument5 SeitenInforme Final de Quimica Fisica IIVictorR.AriasNoch keine Bewertungen
- Especificaciones Del Método de Keldhal para ProteínasDokument12 SeitenEspecificaciones Del Método de Keldhal para ProteínasLIBARDO CASTAÑEDA FLOREZNoch keine Bewertungen
- PDF 2Dokument3 SeitenPDF 2Ninoska Myriam0% (1)
- FQ 2 Informe 1-2-3Dokument12 SeitenFQ 2 Informe 1-2-3victorNoch keine Bewertungen
- Sesion 01 - Conceptos BasicosDokument12 SeitenSesion 01 - Conceptos BasicosVictorR.AriasNoch keine Bewertungen
- HarinaDokument2 SeitenHarinaVictorR.AriasNoch keine Bewertungen
- S GUIA-MUESTREO-SUELO - MINAM 1 PDFDokument39 SeitenS GUIA-MUESTREO-SUELO - MINAM 1 PDFricardoNoch keine Bewertungen
- Cálculo Del Contenido en Azúcares TotalesDokument7 SeitenCálculo Del Contenido en Azúcares TotalesLobsang Orion Valbuena CarrilloNoch keine Bewertungen
- Merck Ofertapedido 4010994946 20.10.2017Dokument1 SeiteMerck Ofertapedido 4010994946 20.10.2017VictorR.AriasNoch keine Bewertungen
- Corrosión MetálicaDokument15 SeitenCorrosión MetálicaCarolina A. HerreraNoch keine Bewertungen
- Espectroscopia RMNDokument17 SeitenEspectroscopia RMNNaira SogueroNoch keine Bewertungen
- Corrosión MetálicaDokument15 SeitenCorrosión MetálicaCarolina A. HerreraNoch keine Bewertungen
- Fisica II-Reporte 1-Densidad de Liquidos y SolidosDokument13 SeitenFisica II-Reporte 1-Densidad de Liquidos y SolidosGeo Chavarria82% (11)
- Los Planetas Del Sistema SolarDokument12 SeitenLos Planetas Del Sistema SolaryeisonrosariocorderoNoch keine Bewertungen
- Reglas de Netiqueta ResumenDokument2 SeitenReglas de Netiqueta ResumenJuanita Amaya BNoch keine Bewertungen
- Proceso Enfermero y Generalidades Del Proyecto PlacesDokument58 SeitenProceso Enfermero y Generalidades Del Proyecto Placesmaddogg16100% (1)
- Dips Tutorial Parte 04Dokument8 SeitenDips Tutorial Parte 04reymerNoch keine Bewertungen
- Canales de Una Seccion y Rugosidad CompuestaDokument7 SeitenCanales de Una Seccion y Rugosidad CompuestaJesus Alberto Pech SanchezNoch keine Bewertungen
- Criterios de Diseño Metro Bici UsuariosDokument24 SeitenCriterios de Diseño Metro Bici UsuariosDaniel Ricardo Leyton RojasNoch keine Bewertungen
- Antropología OKDokument8 SeitenAntropología OKGester Tafur RojasNoch keine Bewertungen
- Caballero Cairo KerryDokument10 SeitenCaballero Cairo KerrymijailNoch keine Bewertungen
- Proceso captación selección personal empresaDokument4 SeitenProceso captación selección personal empresaYaryNoch keine Bewertungen
- Tarea Estadistica 1Dokument2 SeitenTarea Estadistica 1ClauvelaNoch keine Bewertungen
- Blog U3 Estudio Del Trabajo IDokument6 SeitenBlog U3 Estudio Del Trabajo IRicardo OchoaNoch keine Bewertungen
- Sesion 3 Xo - Comprobantes de PagoDokument1 SeiteSesion 3 Xo - Comprobantes de PagoSteven RT100% (1)
- Crítica de La Razón Migrante. Bustamante, Carolina. Godoy, Vega, Francisco. (2014)Dokument43 SeitenCrítica de La Razón Migrante. Bustamante, Carolina. Godoy, Vega, Francisco. (2014)Gabriela MontoyaNoch keine Bewertungen
- Coarite. Tipos de VinculacionesDokument3 SeitenCoarite. Tipos de VinculacionesWilber Coarite Condori0% (1)
- Pildoras Sobre Estiba. Norma en 12642 L y XL - Eva Hernández RamosDokument9 SeitenPildoras Sobre Estiba. Norma en 12642 L y XL - Eva Hernández RamosEva Hernández RamosNoch keine Bewertungen
- Boletin Dallas Arias Grado TerceroDokument40 SeitenBoletin Dallas Arias Grado Tercerocarlos andrés cruzNoch keine Bewertungen
- QuirozDokument15 SeitenQuirozPuntillo Limas JuanNoch keine Bewertungen
- Sociología del Derecho en el Siglo XXDokument18 SeitenSociología del Derecho en el Siglo XXDaniel García UrbinaNoch keine Bewertungen
- Muérdeme! —suplicó a NuíDokument2 SeitenMuérdeme! —suplicó a NuíDaniel CasasNoch keine Bewertungen
- Gerencia Taller 1 Yerson Fabian VargasDokument4 SeitenGerencia Taller 1 Yerson Fabian Vargasfabian NarvaezNoch keine Bewertungen
- Medidas de PosiciónDokument20 SeitenMedidas de PosiciónFranklin KuyocNoch keine Bewertungen
- La Historia OcultaDokument6 SeitenLa Historia OcultaFacu Belli100% (2)
- CriptosisDokument43 SeitenCriptosishidrochacoNoch keine Bewertungen
- Calendario IncaDokument4 SeitenCalendario IncaSaba FlocNoch keine Bewertungen
- T Ayudo DidacticaDokument16 SeitenT Ayudo DidacticaEduardo Esteban Lara CepedaNoch keine Bewertungen
- Importancia de la implementación de los Sistemas de Gestión de Seguridad y Salud en el TrabajoDokument5 SeitenImportancia de la implementación de los Sistemas de Gestión de Seguridad y Salud en el TrabajoMaría José Psicoorientación U de A20% (5)
- Contrato Anticipado 2022 Con FirmaDokument3 SeitenContrato Anticipado 2022 Con FirmaLeidy Geraldine PavaNoch keine Bewertungen
- Mantras de Activación de Los Discos SolaresDokument1 SeiteMantras de Activación de Los Discos SolaresEvolucion del SerNoch keine Bewertungen