Beruflich Dokumente
Kultur Dokumente
Aminas
Hochgeladen von
Héctor Scanda0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
77 Ansichten6 Seitenaminacion
Copyright
© © All Rights Reserved
Verfügbare Formate
DOCX, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenaminacion
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
77 Ansichten6 SeitenAminas
Hochgeladen von
Héctor Scandaaminacion
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 6
Demostración de la basicidad de las aminas.
Rosas Castillo H.S. y B.Q. De La Rosa M.
Universidad Autónoma de San Luis Potosí
Martes, 20 de marzo 2018
Resumen
Para las pruebas de aminas se utilizó la anilina. Se realizaron pruebas con
acidos fuertes y bases fuertes asi como reactivos tales como sulfato cúprico y
NaNO2/HCL para poder así comprobar la formación de sales como precipitados
y cambios de coloración en las reacciones.
Introducción
Las aminas son compuestos Una amina puede comportarse
químicos orgánicos que se como una base de Lewis, o como
consideran como derivados un nucleófilo, debido al par de
del amoníaco y resultan de la electrones no enlazantes sobre el
sustitución de uno o varios de átomo de nitrógeno. Puede actuar
los hidrógenos de la molécula de también como base de Bronsted –
amoníaco por Lowry aceptando el protón de un
otros sustituyentes o radicales. ácido. Como las aminas tienen
Según se sustituyan uno, dos o tres carácter básico debido a la
hidrógenos, las aminas son presencia de un par de electrones
primarias, secundarias o terciarias, no compartidos sobre el nitrógeno;
respectivamente. Por ende por esa razón reaccionan frente a
determinaremos la basicidad de las los ácidos, dando lugar a la
aminas por métodos cualitativos. formación de las sales de amonio
correspondientes.
Por otra parte, aunque son ácidos Las aminas terciarias, sin puentes
muy débiles debido al enlace N–H de hidrógeno, tienen puntos de
(como ácidos son aún más débiles ebullición más bajos que las aminas
que el agua), no son capaces de primarias y secundarias de pesos
reaccionar frente a una base moleculares semejantes.(Wade
moderada como el hidróxido de 2004)
sodio en solución.
Materiales y Reactivos
Las aminas son simples cuando
En esta práctica se utilizaron tubos
los grupos alquilo son iguales y
de ensaye, pipetas graduadas,
mixtas si estos son diferentes.
gradillas, baño de hielo y equipo de
Las aminas son compuestos muy calentamiento.
polares. Las aminas primarias y
En cuanto a los reactivos utilizados
secundarias pueden formar puentes
fueron; anilina, ácido clorhídrico
de hidrógeno. Las aminas terciarias
(HCL), hidróxido de sodio (NaOH),
puras no pueden formar puentes de
sulfato cúprico (CuSO4) y α-naftol.
hidrógeno, sin embargo pueden
aceptar enlaces de hidrógeno con Metodología
moléculas que tengan enlaces O-H
Etapa 1.- Demostración de la
o N-H. Como el nitrógeno es menos
basicidad: se colocó en dos tubos
electronegativo que el oxígeno, el
de ensaye 1 ml de anilina al primer
enlace N-H es menos polar que el
tubo se le agrego 1 ml de HCL y al
enlace O-H. Por lo tanto, las aminas
segundo tubo se agregó de igual
forman puentes de hidrógeno más
manera 1 ml pero de NaOH.
débiles que los alcoholes de pesos
moleculares semejantes.(Merk Etapa 2.- Reacción de sales
2000) cúpricas: en dos tubos de ensaye
agregue 1 ml de solución de sulfato
Las aminas primarias y secundarias
cúprico al 10% previamente
tienen puntos de ebullición menores
preparada a un tubo de ensaye
que los de los alcoholes, pero
agregue 1 ml de anilina.
mayores que los de los éteres de
peso molecular semejante.
En este tubo observamos una
coloración más tenue respectó a la
Etapa 3.- Reacción con ácido
anterior pero de igual manera la
nitroso: prepare una solución 1:1 de
presencia del precipitado aunque en
NaNO2 y HCL, acto seguido coloque
menor cantidad fue notoria.
en en dos tubos de ensaye 1 ml de
anilina y 1 ml de la solución De igual manera al reaccionar con
NaNO2/HCL uno de ellos a baño de el sulfato cúprico se formo un
hielo. complejo color morado de tonalidad
obscura con presencia de
Etapa 4.- Formación de sal: tome el
precipitado arenoso.
tubo que estuvo en baño de hielo y
coloque 0.5 ml de α-naftol al tubo de La reacción de las aminas con el
ensaye después llévelo a ácido nitroso (formado a partir de
calentamiento para observar la nitrito de sodio y ácido clorhídrico)
posible presencia de burbujeo. permite una diferenciación entre
clases de aminas, pues las aminas
Discusión de resultados
aminas primarias forman un alcohol
Cuando una amina reacciona con (o un fenol), con desprendimiento
un ácido (HCL), el nitrógeno queda de nitrógeno gaseoso. Ni las
protonado y se forma la sal de la secundarias ni las terciarias
amina correspondiente. En este producen desprendimiento de un
caso el cloruro de anilonio. En este gas.
caso se logró observar la presencia
Para el caso de las aminas
de un precipitado arenoso y una
aromáticas como la anilina, si la
solución de tonalidad
reacción con NaNO2/HCL se
obscura/morada.
produce en medio fuertemente
Una amina es una base que acepta ácido y en frío, se forma una sal de
un protón del ácido fuerte y se diazonio estable a bajas
forma una sal. En presencia de una temperaturas. La presencia de la sal
base más fuerte que la anilina de diazonio puede revelarse con el
(como el hidróxido de sodio) la agregado de αnaftol. Ocurre una
anilina pierde ese protón que tiene reacción de acoplamiento azoico.
de más y se libera de la sal,
recuperándose la amina original.
El calentamiento de la solución de apreciar mediante el burbujeo del
diazonio favorece su complejo. (imagen 1)
descomposición, liberando
nitrógeno gaseoso, lo cul se pudo
Imagen 1: tubos de ensaye correspondientes alas reacciones descritas.
Lo que se pudo observar en la Conclusión
practica confirma la teoría:
Se logró demostrar que las aminas
El estado inicial de la reacción tienen un alto grado de basicidad y
implica el ataque nucleofilico de la que son excelentes formadoras de
amina al acido nitroso. ( Morrison sales debido a que en la mayoría de
1976) los tubos se presentó un precipitado
con características salinas de color
La propiedad mas importante que
rosa-rojo comprobando así que las
distingue alas aminas de otros tipos
reacciones fueron levadas a cabo
de compuestos orgánicos es la
de manera correcta.
basicidad con el nitrógeno y su
facilidad para formar sales. (gokel
2006)
Referencias
R.T Morrison; R.N Boyd, (1976)
Amina y Amidas en Química Orgánica,
Fondo Educativo Interamericano S.A,
U.S.A, pp 749- 755
.L.G Wade,(2004), “Aminas ” en
Química Orgánica, 5ta Edición, Pearson
Educativo, S.A.,Madrid pp 836-850.
Merck, (2000). “Reactivos y
Productos Químicos”,
Química Industrial, 1ra Edición,Thomson
Editores, S.A., pp 578-589.
G.W. Gokel (2006) química orgánica
experimental 2da edición Cataluña
España.
Anexo
1. ¿Qué tipo de sal se forma en el punto 4 del desarrollo experimental?
R= Sal de diazonio
2. ¿Qué gas se libera al calentar el tubo en el punto 6?
R= nitrógeno
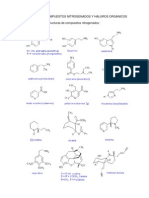
3. ¿Cuáles son las Aminas Aromáticas?
R= Son sustancias químicas derivadas de los hidrocarburos aromáticos. Se
utilizan principalmente en la síntesis de otras sustancias. Las más importantes
son anilina y otoluidina. La bencidina se usa en la manufactura de colorantes y
pigmentos.
4. Enliste tres ejemplos de Aminas Aromáticas con su nombre común, nombre
IUPAC y estructura química.
Nombre común: Anilina nombre común: o-toludina
Nombre de la IUPAC: Phenylamine nombre IUPAC: 2-Methylaniline
Nombre común: bencidina
Nombre de la IUPAC: N,N-dimethyl-
3-[1-(phenylmethyl)indazol-3-
yl]oxypropan-1-amine
Das könnte Ihnen auch gefallen
- Demostración de La Basicidad de Las AminasDokument5 SeitenDemostración de La Basicidad de Las AminasAlejandro Lara ResendízNoch keine Bewertungen
- Practica 5 Demostracion de La Basicidad de Las AminasDokument7 SeitenPractica 5 Demostracion de La Basicidad de Las AminasJose Maria AvilaNoch keine Bewertungen
- Informe de Laboratorio Universidad Del Cauca - AminasDokument9 SeitenInforme de Laboratorio Universidad Del Cauca - AminasValentina BbenavidesNoch keine Bewertungen
- Practica 8 AminasDokument6 SeitenPractica 8 AminasElard CondoriNoch keine Bewertungen
- Informe 12 (2) ....Dokument8 SeitenInforme 12 (2) ....deisi ruthNoch keine Bewertungen
- Organics IIIDokument25 SeitenOrganics IIIOrdenesGutierrez FrancoNoch keine Bewertungen
- Practica #14 AminasDokument5 SeitenPractica #14 AminasCarlos JuarezNoch keine Bewertungen
- Practica 6Dokument3 SeitenPractica 6eligio ramirez jimenezNoch keine Bewertungen
- Propiedades de Los Compuestos Nitrogenados-1Dokument15 SeitenPropiedades de Los Compuestos Nitrogenados-1alexis VilcherresNoch keine Bewertungen
- NITRACION Indirecta de AminasDokument7 SeitenNITRACION Indirecta de AminasDiego ArmandoNoch keine Bewertungen
- Aminas 2023Dokument10 SeitenAminas 2023Octa HerreraNoch keine Bewertungen
- AVANCEDokument18 SeitenAVANCEElard CondoriNoch keine Bewertungen
- Los ÓxidosDokument7 SeitenLos ÓxidosLucía CornejoNoch keine Bewertungen
- Informe 10 Prueba de Caracterización de AminasDokument6 SeitenInforme 10 Prueba de Caracterización de AminasCamila Caicedo Navia100% (1)
- Alcoholes y Fenoles PDFDokument3 SeitenAlcoholes y Fenoles PDFmarivelNoch keine Bewertungen
- Pruebas de Caracterización de AminasDokument13 SeitenPruebas de Caracterización de AminasCarolina MuñozNoch keine Bewertungen
- Lab.7 Propiedades de La Aminas y Amidas & Síntesis de La AcetanilidaDokument17 SeitenLab.7 Propiedades de La Aminas y Amidas & Síntesis de La AcetanilidaNico Ariel Jaramillo0% (1)
- Identificación de AminasDokument7 SeitenIdentificación de AminasCaty VirhuezNoch keine Bewertungen
- PG Reporte#2Dokument10 SeitenPG Reporte#2Isaias PerdomoNoch keine Bewertungen
- Alcalinidad AminasDokument7 SeitenAlcalinidad AminasLuis Wes MolésNoch keine Bewertungen
- Tarea de QuimicaDokument11 SeitenTarea de QuimicaAngelica SorianoNoch keine Bewertungen
- Aminas: DocenteDokument16 SeitenAminas: DocenteAshlly katy ancco zeñaNoch keine Bewertungen
- Laboratorio Organica 2Dokument20 SeitenLaboratorio Organica 2Joseph Sulca MartinezNoch keine Bewertungen
- Copulacion de Sales de DiazonioDokument6 SeitenCopulacion de Sales de Diazonio.:("*"BLacK BuLLeT"*"):.92% (13)
- InforDokument11 SeitenInforEliana picoNoch keine Bewertungen
- Reporte Practica 4Dokument2 SeitenReporte Practica 4MARLY DAYANARA CASADO CABRALNoch keine Bewertungen
- Prueba A PDFDokument51 SeitenPrueba A PDFElisa Edith Zamora BenitezNoch keine Bewertungen
- Aminas - PDF PochoDokument8 SeitenAminas - PDF PochogaboNoch keine Bewertungen
- Informe 9Dokument9 SeitenInforme 9Anonymous Pbd6gdPszNoch keine Bewertungen
- Compuestos NitrogenadosDokument11 SeitenCompuestos NitrogenadosTerry VargasNoch keine Bewertungen
- Propiedades de Las AminasDokument10 SeitenPropiedades de Las AminasGuisela Quispe VelezNoch keine Bewertungen
- Informe de Quimica de Metales y AguaDokument5 SeitenInforme de Quimica de Metales y Aguasantiago.turrentineNoch keine Bewertungen
- AnilinaDokument10 SeitenAnilinasindyvegaNoch keine Bewertungen
- Informe de Orgánica II AminasDokument12 SeitenInforme de Orgánica II AminasLuis CorderoNoch keine Bewertungen
- Informe Lab 2 Quimica OrganicaDokument4 SeitenInforme Lab 2 Quimica Organicadanabrante222Noch keine Bewertungen
- Practica 13 Lab OrganicaDokument6 SeitenPractica 13 Lab OrganicaValerie SantamariaNoch keine Bewertungen
- Practica 12Dokument13 SeitenPractica 12LUIGGI PAUL LLICAHUA YANANoch keine Bewertungen
- Practica 10 Pruebas de Caracterizacion de AminasDokument6 SeitenPractica 10 Pruebas de Caracterizacion de AminasMICHEL DANIELA ARROYAVE PIAMBA100% (1)
- Aminas CompletoDokument27 SeitenAminas CompletoSandra Hilario QNoch keine Bewertungen
- Acidos CarboxilicosDokument4 SeitenAcidos CarboxilicosKathe CastilloNoch keine Bewertungen
- Tema 10 Compuestos Nitrogenados AminasDokument14 SeitenTema 10 Compuestos Nitrogenados AminasJahadai NinaNoch keine Bewertungen
- Lab HidrocarburosDokument10 SeitenLab HidrocarburosLucero PinedoNoch keine Bewertungen
- Informe Bases de Schiff y Nitracu¿ion de Acido AcetilsalicilicoDokument4 SeitenInforme Bases de Schiff y Nitracu¿ion de Acido AcetilsalicilicoANGIE PAOLA RODELO PANZANoch keine Bewertungen
- Equipo 5 - Reporte de Práctica VirtualDokument30 SeitenEquipo 5 - Reporte de Práctica VirtualJIMENA MÁRQUEZ MORENONoch keine Bewertungen
- Capitulo 9 y 10 Quimica Organica 1 1Dokument15 SeitenCapitulo 9 y 10 Quimica Organica 1 1Mraya Jimena Saucedo BenitesNoch keine Bewertungen
- AMINASDokument13 SeitenAMINASArysel Álvarez SalinasNoch keine Bewertungen
- Alcohole Sy Fenoles Practica 5 Kimika OrganikDokument10 SeitenAlcohole Sy Fenoles Practica 5 Kimika OrganikCesar Ricardo ZuñigaNoch keine Bewertungen
- Organica IIIDokument5 SeitenOrganica IIIBerioskaRosasCartolínNoch keine Bewertungen
- Química Orgánica 3 Practica 3Dokument9 SeitenQuímica Orgánica 3 Practica 3erikuribeNoch keine Bewertungen
- 4.-Identificacion de AlcoholesDokument13 Seiten4.-Identificacion de AlcoholesAurora Esperanza Rojas Huaroto100% (2)
- Experiencia 13Dokument6 SeitenExperiencia 13Laura MarcelaNoch keine Bewertungen
- Formato Informe Aminas 22-23Dokument4 SeitenFormato Informe Aminas 22-23Daniela SimbañaNoch keine Bewertungen
- INFORME 10 Quimica ESTE SIDokument9 SeitenINFORME 10 Quimica ESTE SILisbeth CabezasNoch keine Bewertungen
- La Acidez de Los Diversos Grupos FuncionalesDokument7 SeitenLa Acidez de Los Diversos Grupos FuncionalesIsamar Alcantara GomezNoch keine Bewertungen
- El carbón: origen, atributos, extracción y usos actuales en ColombiaVon EverandEl carbón: origen, atributos, extracción y usos actuales en ColombiaBewertung: 4.5 von 5 Sternen4.5/5 (2)
- Mapa ConceptualDokument4 SeitenMapa Conceptualkaren100% (27)
- Mapa Mental Vitaminas CorregidoDokument1 SeiteMapa Mental Vitaminas CorregidoHéctor ScandaNoch keine Bewertungen
- Ejemplo PDFDokument3 SeitenEjemplo PDFVictor MuñozNoch keine Bewertungen
- IntroDokument2 SeitenIntroHéctor ScandaNoch keine Bewertungen
- Introducción QaDokument2 SeitenIntroducción QaHéctor ScandaNoch keine Bewertungen
- CoociDokument13 SeitenCoociHéctor ScandaNoch keine Bewertungen
- Carbo Ceto YaldoDokument6 SeitenCarbo Ceto YaldoHéctor ScandaNoch keine Bewertungen
- Investigación AnatomicaDokument2 SeitenInvestigación AnatomicaHéctor ScandaNoch keine Bewertungen
- 26 Junio SSDokument96 Seiten26 Junio SSJavier Rolando Chuquimia CoariteNoch keine Bewertungen
- Semblanza Dr. Gonzalo BolivarDokument2 SeitenSemblanza Dr. Gonzalo BolivarHéctor ScandaNoch keine Bewertungen
- Elasticidad de VolumenDokument1 SeiteElasticidad de VolumenHéctor ScandaNoch keine Bewertungen
- Pentosas FosfatoDokument9 SeitenPentosas FosfatoHéctor ScandaNoch keine Bewertungen
- GravimetríaDokument4 SeitenGravimetríaHéctor ScandaNoch keine Bewertungen
- YodometríaDokument4 SeitenYodometríaHéctor ScandaNoch keine Bewertungen
- Separacion de Colorantes Varios EluentesDokument6 SeitenSeparacion de Colorantes Varios EluentesLuis MesenNoch keine Bewertungen
- Sistema de Recirculación y Tratamiento de AguaDokument20 SeitenSistema de Recirculación y Tratamiento de Aguasssss rrrrNoch keine Bewertungen
- 8b-Unidad 8 Acidos y Bases-1Dokument13 Seiten8b-Unidad 8 Acidos y Bases-1LuisNoch keine Bewertungen
- Articulo Terminasíntesis de Cloruro de HexaaminocobaltoDokument4 SeitenArticulo Terminasíntesis de Cloruro de HexaaminocobaltoMaria NavasNoch keine Bewertungen
- Disoluciones, Equilibrio y Ácido-BaseDokument3 SeitenDisoluciones, Equilibrio y Ácido-Baseconstanza rivas inzunzaNoch keine Bewertungen
- Determinación de Proteínas en Alimentos Mediante El Método KjeldahlDokument4 SeitenDeterminación de Proteínas en Alimentos Mediante El Método KjeldahlGersonJerielPVNoch keine Bewertungen
- Tema 11 QODokument31 SeitenTema 11 QOmartinlimaNoch keine Bewertungen
- 07-Suplementacion Con NitrogenoDokument24 Seiten07-Suplementacion Con NitrogenoJose ValenzuelaNoch keine Bewertungen
- Ficha Etanol 96%Dokument6 SeitenFicha Etanol 96%pancholin1987Noch keine Bewertungen
- Emergencias Con AmoniacoDokument31 SeitenEmergencias Con AmoniacoJulian Andres Molina BoteroNoch keine Bewertungen
- Guia para Producir Algodon en El Valle de Mexicali, B.C. y San Luis Rio Colorado, Son.Dokument40 SeitenGuia para Producir Algodon en El Valle de Mexicali, B.C. y San Luis Rio Colorado, Son.Alberto Mtz Rodriguez100% (2)
- AMONIACO KAAPplus - PPT DIAPOSDokument19 SeitenAMONIACO KAAPplus - PPT DIAPOSRaúl Nina QuintanillaNoch keine Bewertungen
- Proceso de Obtencion de FormaldehidoDokument24 SeitenProceso de Obtencion de FormaldehidoPilar Ysabel100% (1)
- Carbonato de AmonioDokument5 SeitenCarbonato de AmonioIris Betancourt100% (1)
- Informe Introducción FinalDokument17 SeitenInforme Introducción FinalAlejandro Buelvas NogueraNoch keine Bewertungen
- Compuestos Oxigenados Del NitrogenoDokument12 SeitenCompuestos Oxigenados Del Nitrogenoyacqueline huamanNoch keine Bewertungen
- Columna de DesorciónDokument28 SeitenColumna de DesorciónFranco Antonio Martinez ComesañaNoch keine Bewertungen
- Minireview Obtencion de Hidrogeno Apartir de AmoniacoDokument13 SeitenMinireview Obtencion de Hidrogeno Apartir de AmoniacoJUAN DIEGO GUTIERREZNoch keine Bewertungen
- Almacenamiento de GasesDokument2 SeitenAlmacenamiento de GasesNorwin Jose Gradis RiveraNoch keine Bewertungen
- Proceso Haber - BoschDokument10 SeitenProceso Haber - Boschanon_89788497100% (1)
- Coe x3Dokument4 SeitenCoe x3Cristal GonzálezNoch keine Bewertungen
- 1 - Gases TóxicosDokument14 Seiten1 - Gases TóxicosCecilia LazzariniNoch keine Bewertungen
- CongaDokument27 SeitenCongaLuis FernandoNoch keine Bewertungen
- Hoja Seguridad Cod 1000203979 - Cod 1000205088 Tetranyl At-7590.Dokument4 SeitenHoja Seguridad Cod 1000203979 - Cod 1000205088 Tetranyl At-7590.Amir AvalosNoch keine Bewertungen
- Formula DecoloDokument3 SeitenFormula DecolojosNoch keine Bewertungen
- Acido NitricoDokument7 SeitenAcido NitricoARAMAYO JuanNoch keine Bewertungen
- Guia Ejercicios Qui 001-2010-2Dokument97 SeitenGuia Ejercicios Qui 001-2010-2chilotequelloninoNoch keine Bewertungen
- Manual de Produccion de Truchas IncagroDokument62 SeitenManual de Produccion de Truchas IncagroDavid Gregory Puma Angelo100% (5)
- ANEXOSDokument22 SeitenANEXOSdanielNoch keine Bewertungen
- Ejercicios Acido BaseDokument24 SeitenEjercicios Acido BaseOZONO06Noch keine Bewertungen
- Taller de GasesDokument3 SeitenTaller de GasesJosé GómezNoch keine Bewertungen