Beruflich Dokumente
Kultur Dokumente
01 Capitulo 1 11-16
Hochgeladen von
deiviOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
01 Capitulo 1 11-16
Hochgeladen von
deiviCopyright:
Verfügbare Formate
CAPÍTULO 1.
PATOGÉNESIS DE LA ATEROSCLEROSIS
CAPÍTULO 1 Avances Cardiol 2014;34(Supl 2):S11-S16
Patogénesis de la aterosclerosis
Pathogenesis of atherosclerosis
La aterosclerosis, la forma más frecuente colesterol plasmático, hipertensión arterial, diabetes
de arterioesclerosis, es una enfermedad arterial y tabaquismo, entre otros) actúan homogéneamente
degenerativa crónica responsable de la producción sobre toda la vasculatura.
de múltiples síndromes clínicos, tales como la
Estudios biomecánicos han sugerido que
cardiopatía isquémica, la enfermedad cerebrovascular
un factor común de origen hemodinámico que
y la enfermedad arterial oclusiva periférica.
explicaría estas ubicaciones preferenciales lo
La aterosclerosis, como enfermedad, quizás constituye la existencia de un bajo estrés parietal
sea tan antigua como la civilización misma, tal y de roce acompañado con un patrón complejo de
como lo han demostrado estudios imaginológicos flujo secundario. Estas características originan
hechos en momias egipcias de más de 3500 años modificaciones estructurales en las uniones
de antigüedad (1). entre las células endoteliales locales, alterando
la permeabilidad, el ingreso de partículas
La aterosclerosis es una enfermedad adquirida
aterogénicas (4) y la expresión genética de media-
que ocurre como consecuencia de un proceso
dores (mitógenos, factores de diferenciación,
complejo en el cual interactúan la genética —que
citoquinas, proteasas, componentes de matriz y
condiciona la susceptibilidad individual— y el
agentes vasoactivos) y la colonización por células
ambiente (factores de riesgo, factores hemodi-
progenitoras reparadoras. Del balance local entre
námicos, entre otros).
las influencias reparadoras y las que promueven
La aterosclerosis es una condición progresiva, daño anatómico o funcional, en presencia de una
focal y multicéntrica que afecta la íntima de las cierta cantidad de colesterol plasmático, necesario
arterias de calibre grande y mediano, tales como la para iniciar el proceso, es que se deriva la génesis
aorta y sus ramas ilíacas y femorales, las coronarias, de la aterosclerosis (5-7).
las carótidas y las arterias cerebrales; sin embargo
Cambios morfológicos y funcionales en el proceso
algunas arterias dentro de este rango permanecen
aterosclerótico
casi inmunes al proceso aterosclerótico, como es el
caso de las mamarias internas y las intramiocárdicas, La lesión fundamental de la aterosclerosis es
mientras que otras, como la mitad proximal de la placa, la cual está constituída por una alteración
las arterias coronarias descendente anterior y estructural y funcional de la íntima que se extiende,
circunfleja, coronaria derecha, la aorta torácica posteriormente, a lo largo de la evolución de esta
descendente infrarrenal y la pared externa de la enfermedad, a la media y la adventicia.
bifurcación carotídea y de las coronarias son muy
El modelo explicativo de la aterogénesis,
vulnerables (2,3). Esta heterogeneidad en su aparición
prevalente en la actualidad, es la teoría de “Respuesta
dentro del árbol arterial ocurre pese a que los
a la Retención” (8), la cual establece que el evento
factores de riesgo para la aterosclerosis (niveles de
Avances Cardiol S11
III CONSENSO NACIONAL PARA EL MANEJO DEL PACIENTE CON DISLIPIDEMIA
inicial en este proceso es la retención subendotelial células vasculares (VCAM-1), la molécula adhesiva
de lipoproteínas contentivas de apolipoproteína-B. de células endoteliales (ECAM-1), E-selectina,
La entrada de estas moléculas está influenciada por P-selectina. Este endotelio disfuncionante,
varios factores: el tamaño de la partícula, su carga y además genera sustancias protrombóticas como el
composición bioquímica, el grado de permeabilidad tromboxano A2, y sustancias antitrombolíticas como
endotelial, su concentración plasmática y la etapa el inhibidor del activador tisular del plasminógeno
de la vida en que se hace la exposición endotelial a (PAI-1). La modificación del fenotipo endotelial,
estas moléculas (9), siendo los dos últimos factores se debe al cese de la inhibición sobre el factor
los más importantes. nuclear Kappa-B (NF-κB) que media la regulación
del tráfico intracelular de señales. También, las
El LDL-colesterol plasmático es la partícula
lipoproteínas oxidadas disminuyen la disponiblidad
aterogénica por excelencia; sin embargo, otras
de la enzima óxido nítrico sintetasa endotelial, y
lipoproteínas contentivas de Apo-B como
activan la síntesis de enzimas tales como la NADPH
la lipoproteína (a) [Lp(a)] y los remanentes
oxidasa, que genera especies reactivas de oxígeno.
de lipoproteínas también contribuyen a la
aterogenicidad (10,11). Esta acumulación, inicialmente Los linfocitos T entran también a la lesión
extracelular, de moléculas aterogénicas ocurre aterosclerótica en formación, donde reconocen
dentro de un área normal de la pared vascular humana antígenos locales y producen respuestas inmuno-
llamada engrosamiento difuso de la íntima (12); la lógicas que contribuyen inicialmente a la inflamación
cual, si bien es cierto no es parte del proceso de local y crecimiento de la placa (17).
aterogénesis, siempre está presente en las áreas
Todas estas acciones implican que la disfunción
de las arterias que son susceptibles al desarrollo
endotelial, la inflamación y la oxidación son
de aterosclerosis, aun desde la edad fetal y la
procesos esenciales en la génesis de la aterosclerosis.
lactancia (13,14).
A medida que la lesión progresa, los macrófagos
Las áreas de engrosamiento difuso de la
mueren y producen áreas confluentes de necrosis
íntima son ricas en moléculas de la matriz
contentivas de restos celulares, cristales de
subendotelial, principalmente proteoglicanos
colesterol, proteasas y material protrombótico que
que, como el biglicano y el versicano, retienen a
constituyen el centro de la placa aterosclerótica en
las lipoproteínas (15) con la colaboración de otras
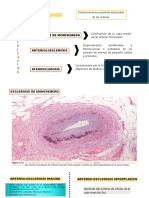
formación (Cor lipídico) (Figura 1.1).
moléculas de la matriz extracelular como son la
lipasa de lipoproteína, la esfingomielinasa secretoria Las células de músculo liso son atraídas a
y la fosfolipasa secretoria A2 (16). Las lipoproteínas la íntima donde se diferencian y promueven la
retenidas son modificadas (agregadas y oxidadas) formación de una cápsula fibrosa de colágeno que
y producen una serie de acciones biológicas, entre representa una reacción cicatrizal que envuelve a
las que se encuentra la producción de proteína la lesión inicial. Estas células son también capaces
quimioatrayente de monocitos-1, que desarrolla una de almacenar lipoproteínas para convertirse en
respuesta inflamatoria maladaptativa, parcialmente células espumosas, y de producir varias moléculas
caracterizada por la entrada de monocitos al espacio de importancia biológica como el factor tisular,
subendotelial, donde se diferencian a macrófagos y abundante en lesiones ateroscleróticas avanzadas,
fagocitan las lipoproteínas retenidas y modificadas y la proteína pro-apoptótica BAX (12).
convirtiéndose en células espumosas. En las placas avanzadas, profundamente
Adicionalmente, las lipoproteínas modificadas infiltradas de células inflamatorias (macrófagos y
contribuyen a la disminución de la actividad biológica linfocitos T) que liberan mediadores capaces de
del óxido nítrico y estimulan al propio endotelio producir un aumento de la degradación de la matriz
para su transformación fenotípica en células extracelular y de la síntesis de colágeno, se observa
disfuncionantes y proinflamatorias que secretan adelgazamiento y debilidad de la cápsula fibrosa,
moléculas tales como la molécula adhesiva de la cual puede erosionarse o, más frecuentemente,
S12 Vol. 34, Supl 2, 2014
CAPÍTULO 1. PATOGÉNESIS DE LA ATEROSCLEROSIS
romperse por efecto de los factores hemodinámicos, soluciones de continuidad endotelial, sin ruptura
favoreciendo la interacción de los componentes de la cápsula fibrosa sobre una placa caracterizada
del núcleo lipídico de la placa, especialmente por mayor proliferación de células de músculo
del factor tisular. La corriente sanguínea puede liso que células inflamatorias y por la presencia de
causar activación plaquetaria y de la cascada de abundantes proteoglicanos. Estas placas producen
coagulación, lo cual genera trombosis suprayacente trombos que se generan sobre esta íntima alterada y,
al sitio de lesión de la placa y conduce a la producción generalmente, no causan obstrucciones trombóticas
de un evento clínico. Prueba de esto es que las tan críticas como las producidas en las placas
placas, predominantemente compuestas por ésteres rotas (18).
de colesterol, con amplia infiltración de células
Recientemente se ha determinado también
inflamatorias tienen una mayor propensión a la
que los micro-RNA, son pequeños nucleótidos no
ruptura, en contraposición a las placas viejas, con
codificantes capaces de regular, aproximadamente,
mayor cantidad de cristales de colesterol y menor
el 30 % de todos los genes productores de proteínas,
infiltración celular inflamatoria.
pueden inducir represión de la traducción del RNA
Por otro lado, las lesiones de ruptura de la placa y actuar como reguladores de la inflamación, la
pueden corregirse con la colonización por células angiogénesis y la apoptosis y, por lo tanto, modificar
de músculo liso que depositan nuevo colágeno, se la vulnerabilidad de la placa (19).
re-endotelizan y restauran la solución de continuidad
El depósito del colesterol en la íntima, la
en la íntima vascular, pero con el inconveniente de
hipoxia presente en la placa aterosclerótica y,
que aceleran, así, la progresión de la obstrucción
quizás también, la liberación de micropartículas
de la luz vascular.
cargadas de factor tisular desde los macrófagos
En las placas erosionadas, no rotas, que explican apoptóticos, estimulan la secreción de factor
hasta el 40 % de trombosis coronarias fatales, hay de crecimiento vascular derivado del endotelio
Endotelio
Monocitos
Núcleo
lipídico
Linfocitos
Células de
espumosas
Neovascularización Células de Estroma
de la placa músculo liso subendotelial
Figura 1.1. Esquema de una placa aterosclerótica mostrando sus elementos esenciales.
Avances Cardiol S13
III CONSENSO NACIONAL PARA EL MANEJO DEL PACIENTE CON DISLIPIDEMIA
(VEGF) y facilitan el crecimiento de nuevos producen obstrucciones al flujo sanguíneo.
vasos sanguíneos en la placa aterosclerótica. Esta
Lesiones tipo III son un puente entre
neovascularización de la placa es un marcador de
las lesiones mínimas y la placa ateromatosa
vulnerabilidad: los nuevos microvasos coronarios
propiamente dicha. En estas lesiones, aparte de los
contienen células endoteliales de morfología
cambios ya mencionados, hay múltiples acúmulos
anormal, con alteración de sus uniones estrechas
extracelulares separados de lípidos y disrupción de
y de la capacidad de adhesión leucocitaria que
la arquitectura del estroma de la íntima.
facilitan mayor permeabilidad y la producción de
hemorragias intraplaca con efectos pro-oxidantes Lesiones tipo IV (ateroma), se caracterizan
deletéreos causados por la hemoglobina liberada. por la presencia de una extensa acumulación de
Esta hemorragia intralesional también promueve lípidos extracelulares en la íntima (núcleo lipídico)
el crecimiento de la placa y el reclutamiento y provenientes del influjo de lipoproteínas del plasma
activación de macrófagos que, a su vez, causan y de la desintegración de células espumosas. En el
mayor liberación de proteinasas y favorecen la interior del núcleo lipídico y en sus bordes pueden
ruptura de la cápsula fibrosa de la placa (20-22). verse células modificadas de músculo liso, algunas
de las cuales tienen acúmulos microscópicos de
Finalmente, las placas ateroscleróticas, tanto
calcio. Las áreas de la íntima suprayacente y,
en sus componentes ricos en lípidos o en colágeno,
especialmente, los bordes del núcleo lipídico,
pueden sufrir un proceso activo y controlado de
contienen macrófagos, linfocitos y mastocitos.
calcificación que incrementa con la edad de las
Hay también un número variable de capilares
lesiones y representa un marcador de la extensión
neoformados circundando el núcleo lipídico. Las
del proceso aterosclerótico, pero no se correlaciona
lesiones tipo IV tienen una ubicación excéntrica lo
ni con la severidad de la estenosis, ni con la
que, al corte transversal de las arterias, les confiere
vulnerabilidad de la placa (23).
el aspecto de media luna. El engrosamiento
El transporte reverso del colesterol, mediado producido por estas lesiones podría no conducir a
por las partículas de lipoproteínas de alta densidad disminuciones significativas de la luz arterial, toda
(HDL-C) constituye un importante mecanismo vez que se establece un proceso de remodelado
de protección antiaterogénica, por lo que las vascular excéntrico que tiende a mantener la luz
reducciones del HDL-C plasmático están claramente dentro de límites casi normales (25). Estas lesiones
asociadas a un incremento en el desarrollo de la generalmente no son visibles angiográficamente
aterosclerosis (23). sino con ultrasonido intravascular, con tomografía
de coherencia óptica, o con angiotomografía de alta
Clasificación de las lesiones ateroscleróticas
resolución. La identificación de estas lesiones podría
Del estudio seriado de arterias coronarias y tener implicaciones pronósticas y terapéuticas ya
aortas humanas obtenidas de autopsia, se ha logrado que las lesiones tipo IV pueden desarrollar fisuras,
distinguir ocho tipos característicos evolutivos de hematomas y trombosis que conduzcan a progresión
las lesiones ateroscleróticas (24). de la aterosclerosis.
Lesiones I y II están caracterizadas por la Lesiones tipo V son aquellas en donde una
acumulación intracelular de lípidos en macrófagos o varias capas de tejido fibroso, constituidas
(células espumosas) y en células de músculo liso especialmente por colágeno se agregan a la lesión
de la íntima. de tipo IV (fibroateroma). Esta cápsula de colágeno
Lesiones tipo I son microscópicas y no se deposita como respuesta a la desorganización
aumentan el grosor de la íntima. estructural inducida por el desarrollo del núcleo
lipídico. Las lesiones tipo IV y V pueden complicarse
Lesiones tipo II son generalmente apreciables con el desarrollo de uno o más episodios de ruptura
a simple vista como estrías o placas amarillentas y trombosis mural.
que sí aumentan el grosor de esta capa, pero no
S14 Vol. 34, Supl 2, 2014
CAPÍTULO 1. PATOGÉNESIS DE LA ATEROSCLEROSIS
Lesiones tipo VI originan la mayor parte Raven Publishers. Philadelphia, 1998.
de la morbimortalidad asociada a las lesiones 3. Edwards WD. Pathology of myocardial infarction and
ateroscleróticas y se caracterizan por tener los reperfusion. En: Gersch BJ, Rahimtoola SH, editores.
mismos cambios morfológicos de los dos tipos Current Topics in Cardiology. Acute Myocardial
Infarction. Elsevier Science Publishing Co. Inc. New
precedentes, pero en ellas se añaden la presencia York, 1991.
de fisuras, roturas o ulceraciones de la placa,
4. Bassiouny HS, Sakaguchi Y, Goudet CA, Vito R, Glogov
acompañadas de hematomas, hemorragias o
S. Pathobiology of symptomatic carotid atherosclerosis.
depósitos trombóticos. En: Fuster V, editor. The vulnerable atherosclerotic plaque:
Lesiones tipo VII son placas ateroscleróticas Understanding, identification and modification.. American
Heart Association Monograph Series. Futura Publishing
avanzadas con todas las alteraciones morfológicas Company, Inc. New York 1999.
antes descritas, pero acompañadas de un extenso
5. Goldschmidt-Clermont PJ, Creager MA, Lorsordo DW,
proceso de calcificación. Lam GKW, Wassef M, Dzau VJ. Atherosclerosis 2005.
Lesiones tipo VIII, conocidas como lesiones Recent Discoveries and Novel Hypotheses. Circulation.
2005;112:3348-53.
fibrosas, están formadas casi por completo de
colágeno, que a veces está hialinizado, y un 6. Roberts WC. Preventing and arresting coronary
atherosclerosis. Am Heart J. 1995;130:580-600.
componente lipídico en cantidad mínima o, incluso,
ausente. Estas lesiones pueden obstruir severamente 7. Walker ARP. Cholesterol: how low is low enough? Effect
la luz arterial o, incluso, ser oclusivas. of a given concentration depends on several factors. BMJ.
1999;318:538-539.
A pesar de conocerse que la aterosclerosis es 8. Williams KJ, Tabas I. The response-to-retention hypothesis
tan vieja como la civilización misma, no ha sido of early atherogenesis. Arterioscler Thromb Vasc Biol.
sino en el último siglo y, especialmente, en los 1995;15:551-61.
últimos 50-60 años que el avance de la investigación 9. McCrindle BW, Urbina EM, Dennison BA, Jacobson
ha permitido un crecimiento exponencial en el MS, Steinberger J, et al. Drug therapy of high-risk
conocimiento de sus mecanismos patogenéticos; lipid abnormalities in children and adolescents: a
sin embargo, como en toda acción humana, son scientific statement from the American Heart Association
Atherosclerosis, Hypertension, and Obesity in Youth
más las incertidumbres y los desconocimientos que Committee, Council of Cardiovascular Disease in the
las verdades sabidas. Hoy por hoy necesitamos Young, with the Council on Cardiovascular Nursing.
aclarar cuál es el primum movens del proceso, Circulation. 2007;115:1948-67.
la retención lipídica o la disfunción endotelial; 10. Genser B, Marz W. Low density lipoprotein cholesterol,
deseamos conocer toda la urdimbre de procesos statins and cardiovascular events: a meta-analysis. Clin
de señalización intracelular que gobiernan tales Res Cardiol. 2006;95:393-404.
acciones; y, más importante aun desde el punto 11. Twickler T, Dallinga-Thie GM, Chapman MJ, Cohn
de vista práctico, cómo caracterizar y predecir la JS. Remnant lipoproteins and atherosclerosis. Curr
vulnerabilidad de las lesiones y los mecanismos, Atheroscler Rep. 2005;7:140-147.
si existen, con los cuales controlar la reversión del 12. Nakashima Y, Wight TN, Sueishi K. Early atherosclerosis
proceso aterosclerótico. Quizás el futuro próximo in humans: Role of diffuse intimal thickening and
extracellular matrix proteoglycans. Cardiovasc Res.
guarde la resolución a estas interrogantes.
2008;79:14-23.
13. Nakashima Y, Chen YX, Kinukawa N, Sueishi K.
REFERENCIAS Distributions of diffuse intimal thickening in human
arteries: preferential expression in atherosclerosis-prone
arteries from an early age. Virchows Arch. 2002;441:279-
1. Allam AH, Thompson RC, Wann LS, Miyamoto MI, Nur 288.
El-Din Ael-H, El-Maksoud GA, et al. Atherosclerosis
14. Ikari Y, McManus BM, Kenyon J, Schwarz SM.
in ancient Egyptian mummies: the Horus study. JACC
Neonatal intima formation in the human coronary artery.
Cardiovasc Imaging. 2011;4:315-27.
Arterioscler Thromb Vasc Biol. 1999;19:2036-2040.
2. Davies MJ. Atlas of coronary artery disease. Lippincott-
15. Khalil MF, Wagner WD, Goldberg IJ. Molecular
Avances Cardiol S15
III CONSENSO NACIONAL PARA EL MANEJO DEL PACIENTE CON DISLIPIDEMIA
interactions leading to lipoprotein retention and the
21. Sanz J, Moreno PR, Fuster V. The year in atherothrombosis.
initiation of atherosclerosis. Arterioscler Thromb Vasc
J Am Coll Cardiol. 2010;55:1487-1498.
Biol. 2004;24:2211-2218.
22. Moreno PR, Purushothaman KR, Sirol M, Levy AP,
16. Tabas I, Williams KJ, Borén J. Subendothelial lipoprotein
Fuster V. Neovascularization in human atherosclerosis.
retention as the initiating process in atherosclerosis.
Circulation. 2006;113:2245-2252.
Circulation. 2007;116:1832-44.
23. Falk E, Fuster V. Atherogenesis and its determinants. En:
17. Hanson GK. Atherosclerosis- An Immune Disease. The
Fuster V, Wayne AR, O´Rourke RA, editores. Hurst´s
Anitschkov Lecture 2007. Atherosclerosis. 2009;202:2-
The Heart. Mc Graw Hill. 10th Edit. New York, 2001.
10.
24. Stary HC, Chandler AB, Dinsmore RE, Fuster V, Glagov
18. Braumwald E. Coronary plaque erosion. Recognition and
S, Insull W Jr, et al. A definition of advanced types of
management. J Am Coll Cardiol Img. 2013;6:288-289.
atherosclerotic lesions and a histological classification of
19. Haver VG, Slart RHJA, Zeebregts CJ, Peppelenbosch MP, atherosclerosis. A report from the Committee on Vascular
Tio RA. Rupture of vulnerable atherosclerotic plaques: Lesions of the Council on Arteriosclerosis. American
microRNAs conducting the orchestra? Trends Cardiovasc Heart Association. Circulation. 1995;92:1355-74.
Med. 2010;20:65-71.
25. Glagov S, Weisenberg E, Zarins CK, Stankunavicius
20. Sanz J, Moreno PR, Fuster V. The year in atherothrombosis. R, Kolettis GJ. Compensatory enlargement of human
J Am Coll Cardiol. 2009;53:1326-37. atherosclerotic coronary arteries. N Engl J Med.
1987;316:1371-1375.
S16 Vol. 34, Supl 2, 2014
Das könnte Ihnen auch gefallen
- File 3Dokument11 SeitenFile 3Ignacio T. CarinciNoch keine Bewertungen
- Arturo Baró VidalDokument5 SeitenArturo Baró VidaldeiviNoch keine Bewertungen
- Vitamina B1Dokument2 SeitenVitamina B1deiviNoch keine Bewertungen
- Voxpaed11 1pags26-35 PDFDokument10 SeitenVoxpaed11 1pags26-35 PDFdeiviNoch keine Bewertungen
- 7CARTA - Descriptiva - BIOQUIMICA - (2011-2) v3.0 PDFDokument17 Seiten7CARTA - Descriptiva - BIOQUIMICA - (2011-2) v3.0 PDFdeiviNoch keine Bewertungen
- 7CARTA - Descriptiva - BIOQUIMICA - (2011-2) v3.0 PDFDokument17 Seiten7CARTA - Descriptiva - BIOQUIMICA - (2011-2) v3.0 PDFdeiviNoch keine Bewertungen
- 25-43 Markarian Matematicas y PsicologiaDokument19 Seiten25-43 Markarian Matematicas y PsicologiadeiviNoch keine Bewertungen
- Psicología Cognitiva y NeurocienciasDokument19 SeitenPsicología Cognitiva y NeurocienciasdeiviNoch keine Bewertungen
- 08 Pensamiento Lógico-MatDokument11 Seiten08 Pensamiento Lógico-Matdeivi100% (1)
- X0013501 PDFDokument425 SeitenX0013501 PDFdeiviNoch keine Bewertungen
- AstroMutis 11BDokument29 SeitenAstroMutis 11BdeiviNoch keine Bewertungen
- Biologia Pre Cap17Dokument20 SeitenBiologia Pre Cap17andrew sNoch keine Bewertungen
- Sistema Renina Angiotensina AldosteronaDokument1 SeiteSistema Renina Angiotensina AldosteronamarielaNoch keine Bewertungen
- Sistema Circulatorio DiapositivaDokument18 SeitenSistema Circulatorio DiapositivaPablo Pañilto100% (1)
- Atlas de Anatomia Humana Netter 6ed Medilibros - Com 120Dokument2 SeitenAtlas de Anatomia Humana Netter 6ed Medilibros - Com 120Alexei AshfordNoch keine Bewertungen
- Sistema LinfaticoDokument5 SeitenSistema LinfaticoKeila de la Jaille BejaranoNoch keine Bewertungen
- Crisis HipertensivaDokument6 SeitenCrisis Hipertensivacarlos daniel arroyo gutierrezNoch keine Bewertungen
- Embriología Del CorazonDokument18 SeitenEmbriología Del Corazonjenifr montes de ocaNoch keine Bewertungen
- Peptido NatiureticoDokument58 SeitenPeptido NatiureticoKathya berenice Trujillo HernándezNoch keine Bewertungen
- Pulso - Wikipedia, La Enciclopedia LibreDokument6 SeitenPulso - Wikipedia, La Enciclopedia LibreYonsou MarcanoNoch keine Bewertungen
- El Bazo InformeDokument2 SeitenEl Bazo InformealejandroNoch keine Bewertungen
- Patologia ArterioesclerosisDokument18 SeitenPatologia ArterioesclerosisGiulianaMenacholaTorreNoch keine Bewertungen
- Oclusión Arterial AgudaDokument19 SeitenOclusión Arterial AgudaCelina Palomino100% (1)
- Hipertensión Arterial e Insuficiencia CardiacaDokument77 SeitenHipertensión Arterial e Insuficiencia CardiacaSandy Burgos CabanillasNoch keine Bewertungen
- Actividades de CirculacionDokument17 SeitenActividades de CirculacionJusta Carmen Concha RevillaNoch keine Bewertungen
- Presion Arterial Jade Ibáñez, Emmy CarrilloDokument6 SeitenPresion Arterial Jade Ibáñez, Emmy CarrillosandiaNoch keine Bewertungen
- 13-12 Cardiopatías CongénitasDokument15 Seiten13-12 Cardiopatías Congénitasapi-3740897100% (4)
- CARDIOLOGIA (Anatomia y Fisiologia Del Corazon)Dokument6 SeitenCARDIOLOGIA (Anatomia y Fisiologia Del Corazon)Welinson QuezadaNoch keine Bewertungen
- Infartos en Zona Limitrofe Cerebral PDFDokument5 SeitenInfartos en Zona Limitrofe Cerebral PDFRocio AsenjoNoch keine Bewertungen
- Irrigacion PelvianoDokument14 SeitenIrrigacion PelvianoCeleste LombardoNoch keine Bewertungen
- Aep 53 Revista Española de PerfusionDokument48 SeitenAep 53 Revista Española de PerfusionHeftor Mtez HdezNoch keine Bewertungen
- Sustitos ValvularesDokument17 SeitenSustitos Valvularesapi-393692719Noch keine Bewertungen
- Complicaciones MecánicasDokument12 SeitenComplicaciones MecánicasEMMANUEL MARQUEZ ALEGRIANoch keine Bewertungen
- AnemiaDokument3 SeitenAnemiaSulem MedinaNoch keine Bewertungen
- Enfermeria Neonatal 1Dokument28 SeitenEnfermeria Neonatal 1youaresolucky100% (1)
- Frecuencia Cardiaca y PulsoDokument4 SeitenFrecuencia Cardiaca y PulsoAmaury MonroyNoch keine Bewertungen
- Sistema Circulatorio SanguineoDokument20 SeitenSistema Circulatorio SanguineoPlastimaciones DiDaMaSaNoch keine Bewertungen
- Ciclo CardíacoDokument41 SeitenCiclo Cardíacojohn mendezNoch keine Bewertungen
- Cátedra de Histología-Órganos Linfoides IIDokument33 SeitenCátedra de Histología-Órganos Linfoides IIBárbara LeiteNoch keine Bewertungen
- Ruidos Cardiacos TareaDokument5 SeitenRuidos Cardiacos TareaYoss rodNoch keine Bewertungen
- SINDROMEDokument2 SeitenSINDROMEYuly DanielaNoch keine Bewertungen