Beruflich Dokumente
Kultur Dokumente
Fiche PH
Hochgeladen von
Tarek BousfihaOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Fiche PH
Hochgeladen von
Tarek BousfihaCopyright:
Verfügbare Formate
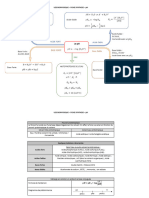
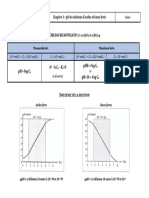
pH des solutions aqueuses
Base Acide
Fort Faible Mélange Fort Faible Mélange
Cb concentration initiale de la Cb concentration initiale de la * Mélange de bases fortes se Ca concentration initiale de Ca concentration initiale de * Mélange d’acides forts se
base. base. comporte comme une seule l’acide. l’acide. comporte comme un seul
* Si Ca ≥ 10-6 M : * Si Kb/Cb≤10-2 ou pKa+1 ≤pH: base forte. * Si Ca ≥ 10-6 M : * Si Ka/Ca≤10-2 ou pH≤pKa-1 : acide fort.
pH=pKe + log(Cb) Pour un mélange de n bases pH=-log(Ca) Pour un mélange de n
* Si Ca < 10-6 M : fortes, on a : * Si Ca < 10-6 M : acides forts, on a :
* Si Kb/Cb>10 ou pH<pKa-1 : * Si Ka/Ca>10 ou pH>pKa+1 :
* Mélange de bases faibles : la * Mélange d’acides faibles :
* Si 10-2<Kb/Cb<10 ou plus forte de ces bases impose * Si 10-2<Ka/Ca<10 ou le plus fort de ces acides
pKa-1<pH<pKa+1 : le pH. pKa-1<pH<pKa+1 : impose le pH.
- Si les acides AH1(C1,Ka1) et
AH2(C2,Ka2) sont faiblement
dissociés :
Mélange d’acide faible et sa base conjuguée (solution de Tampon)
ENSA Kénitra – A.U : 2015/2016
Das könnte Ihnen auch gefallen
- CH 4 (Acide Base)Dokument9 SeitenCH 4 (Acide Base)Seif Souid92% (24)
- CH 4 (Acide Base)Dokument9 SeitenCH 4 (Acide Base)Seif Souid92% (24)
- Les Formules de PHDokument2 SeitenLes Formules de PHmohamigo2100% (1)
- Chimie Des SolutionsDokument65 SeitenChimie Des SolutionsMOHAMMED ZAKARIA BAALINoch keine Bewertungen
- Plaquette Huiles 2020Dokument21 SeitenPlaquette Huiles 2020يوميات صيدلانية pharmacist diariesNoch keine Bewertungen
- Acide BaseDokument10 SeitenAcide BaseAmeni Slimen100% (1)
- TD 2 de BiochimieDokument4 SeitenTD 2 de BiochimieDjéti Labante0% (1)
- Carbocycles Aromatiques MonocycliquesDokument13 SeitenCarbocycles Aromatiques MonocycliquesJean-François AbenaNoch keine Bewertungen
- Resume Acide Base1 Final 1Dokument2 SeitenResume Acide Base1 Final 1MazingaNoch keine Bewertungen
- PH R SumDokument2 SeitenPH R Sum3freefire 3gameNoch keine Bewertungen
- 2017 Acide-Base PDFDokument3 Seiten2017 Acide-Base PDFBen Mamia MahmoudNoch keine Bewertungen
- Module Complément de Formation en Chimie Réactions Acido BasiquesDokument29 SeitenModule Complément de Formation en Chimie Réactions Acido BasiquesyounesNoch keine Bewertungen
- CH4Acide BaseDokument11 SeitenCH4Acide BaseAmen RouissiNoch keine Bewertungen
- Cours N°16 Classification Des Couples Acide Base Dans L'eauDokument2 SeitenCours N°16 Classification Des Couples Acide Base Dans L'eauArti100% (1)
- Acide Base FicheDokument2 SeitenAcide Base FicheAnis LekhalNoch keine Bewertungen
- Résumé 2 Chimie Des SolutionsDokument2 SeitenRésumé 2 Chimie Des SolutionsLoubna El JehouariNoch keine Bewertungen
- Polycopie de CG S2 2011Dokument62 SeitenPolycopie de CG S2 2011Dobl JokNoch keine Bewertungen
- AciditeDokument9 SeitenAciditejranluNoch keine Bewertungen
- Chapitre 3Dokument7 SeitenChapitre 3srhconnor_31Noch keine Bewertungen
- Resumé-Chimie Des SolutionsDokument6 SeitenResumé-Chimie Des Solutionsfzsaci26Noch keine Bewertungen
- A Equilibres Acide Base Power PDFDokument57 SeitenA Equilibres Acide Base Power PDFmenin noorNoch keine Bewertungen
- Cours DosageDokument2 SeitenCours DosageyassihattaNoch keine Bewertungen
- Equilibres Acido-BasiqueDokument38 SeitenEquilibres Acido-BasiqueMouniratou NazéNoch keine Bewertungen
- CS Ensa 2020-21Dokument103 SeitenCS Ensa 2020-213freefire 3gameNoch keine Bewertungen
- Séance 9Dokument13 SeitenSéance 9SantamitoNoch keine Bewertungen
- Chapitre 4 - PH Af Et BF - CoursDokument2 SeitenChapitre 4 - PH Af Et BF - CoursGODANI PhilippeNoch keine Bewertungen
- Rlandta9iserie4chimieacide-BaseDokument2 SeitenRlandta9iserie4chimieacide-Basemalek hassayounNoch keine Bewertungen
- Théme 1 - Chapitre 8 - Carte MentaleDokument1 SeiteThéme 1 - Chapitre 8 - Carte MentaleAbdel ElouaerNoch keine Bewertungen
- S11 - Force Des Acides Et Des BasesDokument5 SeitenS11 - Force Des Acides Et Des BasessocranedeoufNoch keine Bewertungen
- Chap 5 Equilibres Acidobasiques Et PhmetrieDokument5 SeitenChap 5 Equilibres Acidobasiques Et PhmetrieAlidou KOHOUMNoch keine Bewertungen
- Cours Chim 7Dokument2 SeitenCours Chim 7Yasmina BenNoch keine Bewertungen
- Fiche Synthese Ue3 Biophysique Ph-70255Dokument2 SeitenFiche Synthese Ue3 Biophysique Ph-70255janahammoud499Noch keine Bewertungen
- Cours - Chimie - Dosage - Acide - Base - Bac Toutes Sections (2019-2020) MR Sfaxi SalahDokument3 SeitenCours - Chimie - Dosage - Acide - Base - Bac Toutes Sections (2019-2020) MR Sfaxi Salahgzqg9cp7mtNoch keine Bewertungen
- Acides Faibles Bases FaiblesDokument7 SeitenAcides Faibles Bases FaiblesBouaouiche KarimNoch keine Bewertungen
- Chapitre 3 - PH AF Et BF - CoursDokument1 SeiteChapitre 3 - PH AF Et BF - CoursGODANI PhilippeNoch keine Bewertungen
- Acides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeDokument5 SeitenAcides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeNjuga Sene100% (1)
- Serie 7 8 Acides Faibles Bases Faibles Solutions TamponsDokument10 SeitenSerie 7 8 Acides Faibles Bases Faibles Solutions TamponsBrahim DahaiNoch keine Bewertungen
- 4les Transformations Liees A Des Reactions Acide Base Resume de CoursDokument2 Seiten4les Transformations Liees A Des Reactions Acide Base Resume de Coursilyas yoNoch keine Bewertungen
- Chimie - Solutions AqDokument6 SeitenChimie - Solutions Aqilyass doukNoch keine Bewertungen
- Chimie Des Solutions AqueusesDokument29 SeitenChimie Des Solutions AqueusesJean-Loïc BauchetNoch keine Bewertungen
- CH4TCH02L04Dokument1 SeiteCH4TCH02L04chadaNoch keine Bewertungen
- Chimie SolutionsDokument6 SeitenChimie SolutionsAlae ChoulliNoch keine Bewertungen
- Cours Proteine 1er MasterDokument31 SeitenCours Proteine 1er MasterKenz L'AïdNoch keine Bewertungen
- 9 B 6 F 330 Dfec 47 e 8 CCDDokument3 Seiten9 B 6 F 330 Dfec 47 e 8 CCDb.hahastellaNoch keine Bewertungen
- Chapitre 6 Acides-BasesDokument50 SeitenChapitre 6 Acides-BasesMo DicNoch keine Bewertungen
- PDF H3 Corrections ED Acides Bases Sept 2021Dokument69 SeitenPDF H3 Corrections ED Acides Bases Sept 2021Nesrine BenyahiaNoch keine Bewertungen
- PC T ch1 BilanDokument1 SeitePC T ch1 BilanZeyn NdNoch keine Bewertungen
- Chimie - Chapitre 7: Equilibre Acido-Basique en Solution Aqueuse Ce Qu'il Faut RetenirDokument2 SeitenChimie - Chapitre 7: Equilibre Acido-Basique en Solution Aqueuse Ce Qu'il Faut RetenirOussama ElfaqyrNoch keine Bewertungen
- Reactivité Chimique - Chapitre 2Dokument69 SeitenReactivité Chimique - Chapitre 2abraham LincolnNoch keine Bewertungen
- Chap I-3 CSDokument11 SeitenChap I-3 CSSimo MaroNoch keine Bewertungen
- Exercices C7 TSDokument2 SeitenExercices C7 TSkondemamadousaidouNoch keine Bewertungen
- Acides Bases C1Dokument4 SeitenAcides Bases C1Sophie RosiNoch keine Bewertungen
- Acides BasesDokument3 SeitenAcides BasesDaniela RusuNoch keine Bewertungen
- Acides Et Bases - Série 1Dokument3 SeitenAcides Et Bases - Série 1dxc77bs2wyNoch keine Bewertungen
- CHAPITRE I - Chimie en SolutionDokument3 SeitenCHAPITRE I - Chimie en SolutionNikabou Napo TCHANDIKOUNoch keine Bewertungen
- Cours 2. Structure Et Fonction Des ProtéinesDokument148 SeitenCours 2. Structure Et Fonction Des Protéinesmessage4you.11Noch keine Bewertungen
- C2 Équilibres AcidobasiquesDokument7 SeitenC2 Équilibres AcidobasiquesHiba Allah El AhnafNoch keine Bewertungen
- TD2 ChimieDokument3 SeitenTD2 ChimieSAMIA AQNOUCHNoch keine Bewertungen
- Equilibres Acido-BasiqueDokument43 SeitenEquilibres Acido-BasiqueRiani YosriNoch keine Bewertungen
- Chapitre 2 PH Des Solutions Acides BasesDokument26 SeitenChapitre 2 PH Des Solutions Acides BasesRottina RossyNoch keine Bewertungen
- Chapitre 3Dokument7 SeitenChapitre 3srhconnor_31Noch keine Bewertungen
- 01-SA1 Réactions Acido-BasiquesDokument12 Seiten01-SA1 Réactions Acido-BasiquesberthouNoch keine Bewertungen
- NYB PT Chapitre4 A08Dokument60 SeitenNYB PT Chapitre4 A08abderrahimn100% (1)
- Ds06 Acide Base Stereochimie CorrigeDokument2 SeitenDs06 Acide Base Stereochimie CorrigeAya BenhadiyaNoch keine Bewertungen
- Chapitre IIDokument28 SeitenChapitre IIchaima sagiNoch keine Bewertungen
- Cours Lipides 2 AG1 V 2023Dokument37 SeitenCours Lipides 2 AG1 V 2023Amani Mann'fangan EphremeNoch keine Bewertungen
- Capture D'écran . 2023-03-08 À 21.45.32 PDFDokument3 SeitenCapture D'écran . 2023-03-08 À 21.45.32 PDFManal ElkhoudiriNoch keine Bewertungen
- Documents CorrigesDokument4 SeitenDocuments CorrigesAimen D BouzidNoch keine Bewertungen
- TD Nomenclature Corrigé12goodprepa PDFDokument3 SeitenTD Nomenclature Corrigé12goodprepa PDFNour EddineNoch keine Bewertungen
- TD en Biochimie L1Dokument2 SeitenTD en Biochimie L1bonobogeantNoch keine Bewertungen
- Acide Gras2016Dokument7 SeitenAcide Gras2016sabrinaNoch keine Bewertungen
- Acides Aminés Structure Et ClassificationDokument13 SeitenAcides Aminés Structure Et ClassificationHana KouissaNoch keine Bewertungen
- Reactions Acido BasiquesDokument3 SeitenReactions Acido Basiquesh3r3t1kNoch keine Bewertungen
- CocaDokument5 SeitenCocatheobromine100% (4)
- PH ExoDokument35 SeitenPH ExoHicham Oublal100% (1)
- Chapitre 1 - Transformations Acide-BaseDokument7 SeitenChapitre 1 - Transformations Acide-BaseTia AmaneddineNoch keine Bewertungen
- Série TD 3 Chimie 2Dokument2 SeitenSérie TD 3 Chimie 2salma koudriNoch keine Bewertungen
- Chimie en SolDokument2 SeitenChimie en Solayyoub dhbNoch keine Bewertungen
- Nutriscreen ProtocoleDokument3 SeitenNutriscreen Protocoleapi-90395092Noch keine Bewertungen
- Titrage ABDokument4 SeitenTitrage ABEL Hassania EL HERRADINoch keine Bewertungen
- S 1516113138Dokument5 SeitenS 1516113138ra mziNoch keine Bewertungen
- 4.acide Fort, Acide Faible, Notion de Constante D'acidité Et de pKA PDFDokument4 Seiten4.acide Fort, Acide Faible, Notion de Constante D'acidité Et de pKA PDFkimmikNoch keine Bewertungen
- Acide BaseDokument4 SeitenAcide BaseanoiriNoch keine Bewertungen
- TD - BCG - S4 Sujet 4 - Corrigé - 2020-2021Dokument7 SeitenTD - BCG - S4 Sujet 4 - Corrigé - 2020-2021Abdel OihabNoch keine Bewertungen