Beruflich Dokumente
Kultur Dokumente
Plab 01 Preparacion y Estandarizacion de Kmno4 Josue Zavala
Hochgeladen von
Johann Albert Arroyo RojasOriginalbeschreibung:
Originaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Plab 01 Preparacion y Estandarizacion de Kmno4 Josue Zavala
Hochgeladen von
Johann Albert Arroyo RojasCopyright:
Verfügbare Formate
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 1 de 18
CONTENIDO
INTRODUCCION
I. OBJETIVOS ..................................................................................................4
1.1.OBJETIVO GENERAL ......................................................................................4
1.2.OBJETIVOS ESPECIFICOS.............................................................................4
II. MARCO TEORICO ......................................................................................4
2.1.TERMINOS Y DEFINICIONES .......................................................................4
2.2.CONDICIONES GENERALES .........................................................................5
2.3.CONDICIONES DE SEGURIDAD Y MEDIO AMBIENTE .........................7
III. DESARROLLO EXPERIMENTAL ...........................................................7
3.1.EQUIPOS Y MATERIALES .............................................................................7
3.2.REACTIVOS QUIMICOS .................................................................................8
3.3.PREPARACION DE SOLUCIONES ................................................................8
3.4.PROCEDIMIENTO DE ESTANDARIZACION DEL KMnO4 .....................9
3.5.DATOS OBTENIDOS EN LABORATORIO.................................................10
3.6.REACCION QUIMICA ....................................................................................10
3.7.CALCULOS Y RESULTADOS .......................................................................11
3.8.ANALISIS DE RESULTADOS OBTENIDOS ...............................................12
IV. CONCLUSIONES .......................................................................................16
V. RECOMENDACIONES .............................................................................16
VI. BIBLIOGRAFIA .........................................................................................16
VII. ANEXO .........................................................................................................17
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 2 de 18
INTRODUCCION
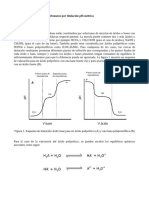
La volumetría redóx (óxido - reducción) consiste en la medición del volumen necesario
de una sustancia oxidante o reductora para determinar el punto final de una reacción
redóx.
Para calcular el peso equivalente de una sustancia oxidante o reductora, se debe dividir
el peso molecular de la misma con respecto al cambio del número de oxidación.
Las soluciones de los oxidantes más comunes en la titulación de los reductores son los
siguientes: KMnO4, K2Cr2O7 y el KI, mientras que los reductores más comunes
son: Na2C2O4, H2C2O4, y el Cl−.
El ion permanganato es uno de los oxidantes de uso más generalizado, debido no
solamente a su alto poder de oxidación, sino también a sus características de auto
indicador visual. La adición de la primera gota de solución de permanganato en exceso
imparte un color rosa a la solución.
La reducción del permanganato puede producir diferentes estados de oxidación del
manganeso, dependiendo de las condiciones de la solución.
En medios fuertemente ácidos, el permanganato produce una reducción de 5e- a ion
manganeso (II):
MnO−
4 + 8 H + 5e
-
Mn + H2O E0 = 1.51V
En soluciones débilmente ácidas, neutras o débilmente alcalinas, la reducción del
permanganato es de 3e- , formándose óxido de manganeso hidratado:
MnO− +
4 + 4H + 3e
-
MnO2 + H2O E0 = 1.69V
Para medios neutros o alcalinos:
4 4H2O 3e
MnO− MnO2
-
2OH-
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 3 de 18
Para medios fuertemente alcalinos:
MnO−
4 + e
-
MnO−2
4 E0 = 0.56V
La reducción del ión permanganato puede conducir también a Mn (VI) o Mn (III) bajo
ciertas condiciones, aunque estas reacciones son poco frecuentes.
Estabilidad de las soluciones de permanganato:
4 MnO−
4 2 H2O 4 MnO2 4 OH − 3 O2
Esta reacción verifica lentamente el medio neutro, y con mayor rapidez en soluciones
ácidas ya que es auto catalítica, pues el MnO2 que se forma acelera la descomposición.
Además, es catalizada por la luz y el ion Mn+2.
Es difícil obtener permanganato de potasio totalmente puro, pues casi siempre lleva
como impurezas al MnO2. Además, el agua destilada utilizada para prepararlo puede
contener vestigios de sustancias reductoras que darían lugar a la formación del mismo;
por lo tanto, se hace necesario filtrar la solución de permanganato sobre un filtro no
reductor (es decir no puede utilizarse papel de filtro).
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 4 de 18
I. OBJETIVOS
1.1.OBJETIVO GENERAL
1.1.1. Preparar una disolución 0.1N normal de KMnO4 (permanganato potásico) y
estandarizar con el patrón primario H2C2O4 (ácido oxálico).
1.2.OBJETIVOS ESPECIFICOS
1.2.1. Determinar por titulación la Normalidad de un agente reductor, para ello el
cambio de coloración de la sustancia reaccionante se emplea como
indicador.
1.2.2. Determinar experimentalmente el punto de equivalencia en una Titulación
Redóx.
1.2.3. Calcular los diferentes parámetros de calidad con la ayuda de un tratamiento
estadístico de errores para evaluar la exactitud y precisión de los resultados
obtenidos en el laboratorio de tecnología análisis Químico.
1.2.4. Familiarizar al estudiante con las titulaciones redóx.
1.2.5. Señalar la importancia de escoger el agente oxidante patrón adecuado
II. MARCO TEORICO
2.1.1. TERMINOS Y DEFINICIONES
2.1.2. Permanganimetría. – Método redóx de análisis cuantitativo, en donde el patrón
titulante es el KMnO4.
2.1.3. Agente Oxidante. – Es aquel compuesto que en una reacción química se
reduce, es decir gana electrones.
2.1.4. Agente Reductor. – Es aquel compuesto que en una reacción química cede
electrones a un agente oxidante
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 5 de 18
2.1.5. CONDICIONES GENERALES
2.1.6. REACCION DE OXIDO – REDUCCIÓN “REDOX”
Un proceso que da lugar a una transferencia de electrones se llama un proceso de
(óxido – reducción) una sustancia que cede electrones se oxida y la que los recibe se
reduce. En otras palabras, un agente oxidante se combina con electrones y por esto se
reduce, mientras que un agente reductor provee electrones. En una reacción de (óxido
– reducción) siempre intervienen dos sistemas de óxido – reducción, uno que
proporciona los electrones y el otro que se combina con ellos.
2.1.7. INDICADORES QUE SE USAN PARA EL RECONOCIMIENTO DEL
PUNTO FINAL EN LAS TITULACIONES DE OXIDO – REDUCCION
El reactivo puede servir como indicador de su propia acción. Si el reactivo es
intensamente coloreado y pierde el color por la acción de la sustancia que se determina
(o si se transforma en un compuesto poco coloreado), el color de un leve exceso de
reactivo señalará el punto final. Así, por ejemplo, en las titulaciones con
permanganato, por lo general, no es necesario agregar un indicador especial, puesto
que un leve exceso de permanganato se puede reconocer fácilmente por su color
rosado, aún en presencia de iones poco coloreados tales como el ión férrico e. Si es
necesario se puede determinar el exceso de permanganato requerido para el
reconocimiento del punto final haciendo un ensayo en blanco y sustrayendo el
resultado del volumen usado en la titulación.
2.1.8. PRINCIPIO DE LA METODOLOGIA
Se prepara una solución de permanganato de potasio (KMnO4) 0.1N, el cual debe ser
preparada al momento de hacer la determinación y se estandarización por titulación con
su patrón primario Na2C2O4 ó H2C2O4.
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 6 de 18
El oxalato de sodio anhidro, Na2C2O4, se consigue en alto estado de pureza y es estable
al aire.
En las valoraciones del permanganato, una cantidad exactamente pesada de esta sal se
disuelve en una solución de ácido sulfúrico y se titula con el permanganato. En medio
ácido, la oxidación se puede describir más convenientemente en términos del ácido
oxálico:
H2C2O4 → 2 H+ + CO2 ↑ + 2e-
Puesto que en la oxidación de cada molécula de ácido oxálico u oxalato intervienen dos
electrones, el peso equivalente es la mitad del peso de fórmula.
La reacción total entre el ión permanganato y el ácido oxálico es:
2 MnO4 + 5 H2C2O4 + 16 H+ → 2 Mn++ + 10 CO2 ↑ + 8 H2O
Al añadir inicialmente el ión permanganato a una solución de ácido oxálico, se obtiene
una coloración rosa que persiste durante un tiempo, indicando que se trata de una
reacción lenta. Al continuar la titulación, la decoloración se vuelve mucho más rápida,
pues el ión manganeso (II) que se forma por la reducción del permanganato, cataliza la
reacción. En las cercanías del punto final la decoloración suele ser prácticamente
instantánea. La velocidad de esta reacción puede incrementarse por calentamiento de la
solución. Sin embargo, a una temperatura demasiado elevada, así como en un medio
muy ácido, el ácido oxálico se descompone en la siguiente forma:
H2C2O4 → CO2 ↑ + CO ↑+ H2O
El ácido oxálico en solución puede ser oxidado por el aire:
H2C2O4 + O2 → 2 CO2 + H2O2
El peróxido de hidrógeno que se forma reacciona con el permanganato en una oxidación
de dos electrones, esto igual que el ácido oxálico; por consiguiente, la titulación no
produce errores si la solución se titula rápidamente antes de que se descomponga el
peróxido de hidrógeno.
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 7 de 18
2.1.9. CONDICIONES DE SEGURIDAD Y MEDIO AMBIENTE
2.1.10. El estudiante involucrado en la práctica debe cumplir en todo momento lo
establecido en las normas de seguridad y las BPL.
2.1.11. El estudiante involucrado en la práctica deberá usar en todo momento los
equipos de protección personal “EPPs adecuados” (respirador con filtros para
gases, lentes de seguridad, guantes de nitrilo, zapatos de cuero, delantal).
2.1.12. Se debe de inspeccionar los equipos y materiales para el control de riesgos
(extractor de gases, balanzas, patrones primarios, materiales de vidrio,
reactivos químicos).
2.1.13. Si se van realizar tareas nuevas se harán un análisis de riesgo teniendo en
cuenta el compromiso de calidad de seguridad y medio ambiente.
2.1.14. Al finalizar la práctica de laboratorio, realizar orden y limpieza.
III. DESARROLLO EXPERIMENTAL
3.1.EQUIPOS Y MATERIALES
3.1.1. Vidrios de reloj
3.1.2. Buretas
3.1.3. Soporte universal
3.1.4. Pinzas para buretas
3.1.5. Vasos de precipitados
3.1.6. Termómetros
3.1.7. Matraces Erlenmeyer
3.1.8. Placa de agitación y calentamiento
3.1.9. Pipetas graduadas
3.1.10. Pipeta volumétrica
3.1.11. Fibra de vidrio
3.1.12. Embudos de tallo corto
3.1.13. Anillo de fierro
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 8 de 18
3.1.14. REACTIVOS QUIMICOS
3.1.15. Ácido sulfúrico H2SO4
3.1.16. Permanganato de potasio KMnO4
3.1.17. Ácido Oxálico H2C2O4
3.1.18. Agua destilada H2O
3.1.19. PREPARACION DE SOLUCIONES
3.1.20. SOLUCION DE PERMANGANATO DE POTASIO 0.1 N
Sabemos que:
𝑾 𝟏𝟎𝟎
𝑵 = 𝑽𝒔𝒐𝒍𝒔𝒕𝒐∗𝑴
̅ ∗𝜽 y, 𝑾𝒓𝒆𝒂𝒍 𝒂 𝒑𝒆𝒔𝒂𝒓 = 𝑾𝒕𝒆𝒐𝒓𝒊𝒄𝒐 ∗ %
(𝒍) 𝒑𝒖𝒓𝒆𝒛𝒂 𝒓𝒆𝒂𝒄𝒕𝒊𝒗𝒐
Siendo: 𝑾𝒕𝒆𝒐𝒓𝒊𝒄𝒐 = 𝑾𝒔𝒕𝒐
1. Por la tanto para calcular la masa a pesar de reactivo (KMnO4 q.p) contenido en el
frasco una pureza de 99.00% nuestra ecuación simplificada a utilizar quedara de la
siguiente forma:
̅ ∗ 𝟏𝐎𝐎
𝐍 ∗ 𝐕𝐬𝐨𝐥(𝐋) ∗ 𝐌
𝐖𝐏𝐄𝐒𝐀𝐑 𝐑𝐄𝐀𝐂𝐓𝐈𝐕𝐎 =
𝛉 ∗ %𝐩𝐮𝐫𝐞𝐳𝐚 𝐝𝐞 𝐫𝐞𝐚𝐜𝐭𝐢𝐯𝐨
Se sabe que: Mn+7 Mn+2 ; por lo tanto pierde 5e− , entonces θ = 5
0.1 eq/L ∗ 0.1 L ∗ 158.034 g/mol ∗ 100
WPESAR REACTIVO
5 ∗ 99.00
WPESAR REACTIVO = 0.3193 g ; es la masa de reactivo a pesar KMnO4 (al 99.00% de
pureza) para preparar en 100 ml de KMnO4 0.1 N.
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 9 de 18
2. Pesar 0,3193 g de KMnO4 necesario para la preparación de la solución, teniendo
en cuenta el poder oxidante del permanganato de potasio en medio ácido. y luego
se disuelve en un volumen de 100 ml de agua destilada.
3. Se calienta a ebullición suave durante 30 minutos, se deja enfriar, se filtra a través
de lana de vidrio a un matraz aforado 100 ml, enrasar con agua destilada
completando el volumen propuesto con agua hervida y fría, finalmente
homogeneizar.
Nota1: Para enfriar se tapa el recipiente y se deja en reposo por lo menos durante 24
horas y preferiblemente durante más tiempo (para decantar el dióxido de manganeso
formado).
4. En un frasco ámbar limpio y seco se enjuaga con un poco de la solución preparada,
y luego se la transfiriere, tapar y guardar en la oscuridad.
3.1.21. PROCEDIMIENTO
3.1.22. ESTANDARIZACION DE LA SOLUCION DE KMnO4 CON EL
PATRON PRIMARIO H2C2O4
1. Cargar la bureta con la disolución preparada KMnO4 y enrasamos a cero. Luego
colocar en el soporte universal (setup para volumetría).
Nota2: antes de llenar la bureta con el agente titilante es necesario lavar bien la bureta,
es decir primero con agua q.p. y finalmente con la disolución preparada enjuagando la
bureta con esta disolución al menos tres veces “curado”.
2. Pesar 0,1260 g de ácido oxálico y lo agregamos a un matraz erlenmeyer de 250 ml,
luego lo disolvemos en 150 ml de agua destilada.
3. Seguidamente le agregamos 5 ml de H2SO4 qp y lo llevamos a calentar a una
temperatura de 70°C.
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 10 de 18
Nota3: La temperatura de la solución debe ser aproximadamente de 80 °C. (una
ebullición incipiente) pues a temperaturas menores la reacción es muy lenta y a
temperaturas mayores, ya en franca ebullición se produce la descomposición del H2C2O4
en CO2 y H2O.
4. Proceder a la estandarización abriendo la llave de la bureta lentamente (dejar caer
la disolución de KMnO4 gota a gota) hasta que permanezca un cambio de viraje
del indicador (una coloración rosada).
Nota4: En la valoración con KMnO4 0.1 N el indicador es el mismo KMnO4 pues bastan
unas gotas más para dar una coloración rosada. Este color del punto final desaparece
lentamente por la reducción gradual del KMnO4 por la presencia de iones Mn++ y Cl−,
por lo tanto, debemos esperar que tal coloración persista por espacio de treinta segundos.
5. Anotar el gasto del titulante en la tabla N°1 y proceder a los cálculos respectivos.
Nota5: la estandarización se debe de realizar por triplicado como mínimo.
3.1.23. DATOS OBTENIDOS EN LABORATORIO
TABLA N°1: Datos experimentales obtenidos:
DESCRIPCION ENSAYO 1 ENSAYO 2 ENSAYO 3
Peso del ácido oxálico H2C2O4 (g): 0.1260 g 0.1298 g 0.1209 g
Volumen gastado del KMnO4 (ml): 22 ml 31 ml 21 ml
Normalidad del KMnO4 (eq/L): 0.12722 N 0.09301 N 0.12789 N
Normalidad promedio del KMnO4 (eq/L): 0.11604 eq/L
Desviación estándar (eq/L): 0.01995 eq/L
3.1.24. REACCION QUIMICA
2 KMnO4 + 5 H2C2O4 + 3 H2SO4 K2SO4 + 2 MnSO4 + 10 CO2 + 8 H2O
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 11 de 18
3.1.25. CALCULOS Y RESULTADOS
3.1.26. CÁLCULOS REFERIDOS A LA ESTANDARIZACION DEL KMnO4
#𝑬𝑸𝑼𝑰𝑽𝑲𝑴𝒏𝑶𝟒 = #𝑬𝑸𝑼𝑰𝑽𝑯𝟐 𝑪𝟐 𝑶𝟒
𝑵𝑲𝑴𝒏𝑶𝟒 ∗ 𝑽𝑲𝑴𝒏𝑶𝟒 = 𝑵𝑯𝟐 𝑪𝟐 𝑶𝟒 ∗ 𝑽𝑯𝟐 𝑪𝟐 𝑶𝟒
𝑾𝑯𝟐 𝑪𝟐 𝑶𝟒
𝑵𝑲𝑴𝒏𝑶𝟒 = ∗𝜽
̅ 𝑯 𝑪 𝑶 ∗ 𝑽𝑮𝒂𝒔𝒕𝒐 𝑲𝑴𝒏𝑶 (𝑳)
𝑴 𝟐 𝟐 𝟒 𝟒
0.1260 g
NKMnO4 (1) = ∗ 2 = 0.12722 eq/L
90.035 g/mol ∗ 0.022 L
0.1298 g
NKMnO4 (2) = ∗ 2 = 0.09301 eq/L
90.035 g/mol ∗ 0.031 L
0.1209 g
NKMnO4 (3) = ∗ 2 = 0.12789 eq/L
90.035 g/mol ∗ 0.021 L
Calculamos el promedio 𝐱̅ de la normalidad del KMnO4, partir de:
∑ 𝒙𝒊
̅=
𝒙
𝑵
Donde:
- 𝐱 𝐢 : Normalidad del KMnO4 valorado en cada muestra (eq/L).
- N: Número de repeticiones (adimensional).
0.12722 eq/L + 0.09301 eq/L + 0.12789 eq/L
x̅ =
3
x̅ = 0.11604 eq/L
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 12 de 18
Calculamos la desviación estándar 𝛅 a partir de:
̅) 𝟐
∑(𝒙𝒊 − 𝒙
𝛿= √
𝒏−𝟏
(0.12722 − 0.11604)2 + (0.09301 − 0.11604)2 + (0.12789 − 0.11604)2
δ=√
3−1
(0.01118)2 + (−0.02303)2 + (0.01185)2
δ=√
2
0.00012499 + 0.00053038 + 0.00014042
δ=√
2
δ = √0.0003979
δ = 0.01995 eq/L
3.2.ANALISIS DE RESULTADOS
3.2.1. LINEALIZACION
Tabla Nº2: Valores en la estandarización de KMnO4.
masa H2C2O4 Volumen gasto KMnO4 Normalidad Parcial
N°
(g) (ml) (eq/L)
1 0.1260 22 0.12722
2 0.1298 31 0.09301
3 0.1209 21 0.12789
Normalidad promedio (eq/L): 0.11604
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 13 de 18
Grafico Nº1: Linealización de la estandarización, Gasto de Valorante, ml
(KMnO4) vs Masa Patrón Primario, g (H2C2O4).
LINEALIZACION DE LA ESTANDARIZACION KMnO4
32.000
31.000
30.000
Gasto de Valorante, ml (KMnO4)
29.000
28.000
27.000
26.000
25.000
24.000
23.000
22.000
y = 1072.2x - 109.97
21.000
R² = 0.7558
20.000
0.120 0.121 0.122 0.123 0.124 0.125 0.126 0.127 0.128 0.129 0.130
Masa de Patron Primario, g (H2C2O4)
3.2.2. CALCULO DE LINEABILIDAD “TEST DE GRUBSS” A LA
ESTANDARIZACION DEL KMnO4
Para ello utilizaremos la prueba Grubss, a través de la siguiente ecuación:
̅𝐦
𝐗 𝐦𝐚𝐱 − 𝐗
𝐆𝐦𝐚𝐱 =
𝐒𝐫
̅ 𝐦 −𝐗 𝐦𝐢𝐧
𝐗
𝐆𝐦𝐢𝐧 =
𝐒𝐫
Donde:
- Gmax: Es la significancia de la observación más grande de la población
dispersa en una prueba interlaboratorio.
- Gmin: Es la significancia de la observación más pequeña de la población
dispersa en una prueba interlaboratorio.
- Sr: Desviación estándar
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 14 de 18
La evaluación de la prueba Grubbs se realiza según los valores críticos dada por la
ISO-5725, es decir si la prueba estadística para Grubss es:
a) Menor que o igual al valor critico referido a un nivel de significancia del
5%, la muestra probada se acepta como correcta.
b) Mayor que su valor critico referido a un nivel de significancia del 5% y
menor que o igual a su valor critico referido a un nivel de significancia
del 1%, la muestra probada se determina como dudosa (straggler).
c) Mayor que el valor critico referido a un nivel de significancia del 1%, la
muestra probada se determina como outlier.
Tabla Nº3: Calculo de lineabilidad en la estandarización de KMnO4 según el test
Grubss.
Escrutinio (Test de Grubss)
SE ACEPTA Indicadores Valor Critico* Experimental
GmaxE < GmaxVC Gmax 1.764 0.594
GminE < GminVC Gmin 1.715 1.155
(*) Valor crítico para la prueba estadística Grubss a un nivel de significancia del 5%,
según la ISO-5725.
Por lo que, la muestra probada se acepta como correcta, por ende, se le asignara el
valor de la normalidad (0.11604 eq/L) a la solución preparada de KMnO4.
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 15 de 18
3.2.3. CALCULO DEL % ERROR EXPERIMENTAL
𝐕𝐚𝐥𝐨𝐫𝐓𝐄𝐎𝐑𝐈𝐂𝐎 − 𝐕𝐚𝐥𝐨𝐫𝐄𝐗𝐏𝐄𝐑𝐈𝐌𝐄𝐍𝐓𝐀𝐋
𝐄𝐫𝐫𝐨𝐫% = ∗ 𝟏𝟎𝟎
𝐕𝐚𝐥𝐨𝐫𝐓𝐄𝐎𝐑𝐈𝐂𝐎
Donde:
- Valorteorico: Normalidad supuestamente preparada inicialmente.
- Valorexperimental: Normalidad Real (Experimental) luego de la
estandarización.
0.10000 eq/L − 0.11604 eq/L
Error% = ∗ 100
0.10000 eq/L
Error% = −16.04%
Esto quiere decir que el resultado se encuentra en un 16.04% de error por encima del
valor de concentración supuestamente preparada de KMnO4 a 0.1N, y esto pudo haberse
debido a errores aleatorios (medición, temperatura, humedad relativa) y sistemáticos
(patrón, balanza, material volumétrico).
IV. CONCLUSIONES
Podemos decir en un breve resumen que, en la práctica de titulación redóx del KMnO4,
coincidieron todos los resultados con el marco teórico, con lo que se cumplieron todos
los objetivos de la práctica.
4.1.Finalmente como reporte final de nuestra medición “mensurando” de la forma 𝑥̅ ±
𝛿, nuestra solución preparada y estandarizada de KMnO4 durante la práctica
realizada en el laboratorio tiene una concentración normal de: 0.11604 ± 0.01995
eq/L.
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 16 de 18
V. RECOMENDACIONES
En términos generales, se recomienda:
5.1.La disolución de KMnO4, debe de almacenarse en un frasco oscuro y mantenerse
aislado de la luz y de contaminación por polvos, de lo contrario sufrirán alteraciones
en sus propiedades químicas.
5.2.La disolución de KMnO4 mayores a 0.02 N, cuando se preparan y conservan tal
como se describió en el párrafo anterior, son estables durante muchos meses.
5.3.La reducción del ion (MnO4)- a Mn+2 es un proceso muy complejo que implica la
formación de estados intermedios de oxidación del manganeso. Sin embargo si se
ajustan las condiciones para que el producto final sea Mn+2 se puede establecer la
estequiometria entre el permanganato y el agente reductor, independientemente del
mecanismo de la reacción.
VI. BIBLIOGRAFIA
Jr., L. W. (2004). Química Orgánica. Pearson-Prentice Hall.
McMURRY, J. (2001). Química Orgánica. International Thomson.
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 17 de 18
VII. ANEXO
Anexo A: CUESTIONARIO
1. Escriba la reacción que ocurre entre el KMnO4 y el Na2C2O4 en medio
acido
2 KMnO4 + 5 Na2C2O4 + 8 H2SO4 K2SO4 + 5 Na2SO4 + 2 MnSO4 + 10 CO2 + 8 H2O
2. Escriba la semirreacción de reducción
𝟐 ( 𝑀𝑛𝑂4 − + 8 𝐻 + + 5 𝑒 − → 𝑀𝑛+2 + 4 𝐻2 𝑂 ) 𝐸 0 = 1.51𝑉
3. Escriba la semirreacción de oxidación
𝟓 ( 𝐶2 𝑂4 −2 → 2 𝐶𝑂2 + 2 𝑒 − ) 𝐸 0 = 0.50𝑉
4. Calcule el peso equivalente del agente reductor
𝑷𝒆𝒔𝒐 𝒎𝒐𝒍𝒆𝒄𝒖𝒍𝒂𝒓
𝑷𝒆𝒒𝒖𝒊𝒗𝑲𝑴𝒏𝑶𝟒 =
# 𝒆− 𝒄𝒆𝒅𝒊𝒅𝒐𝒔
158.038 𝑔/𝑚𝑜𝑙
𝑃𝑒𝑞𝑢𝑖𝑣𝐾𝑀𝑛𝑂4 =
5
𝑃𝑒𝑞𝑢𝑖𝑣𝐾𝑀𝑛𝑂4 = 31.608 𝑔/𝑒𝑞
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
TECNOLOGÍA DE ANÁLISIS QUÍMICO
QUIMICA ANALITICA CUANTITATIVA II
PREPARACION Y ESTANDARIZACION DE
PERMANGANATO DE POTASIO ( KMnO4 )
Código: PLAB-01 Docente: Ing. Josué Zavala B. Pág. 18 de 18
5. Calcule el peso equivalente del agente oxidante
𝑷𝒆𝒔𝒐 𝒎𝒐𝒍𝒆𝒄𝒖𝒍𝒂𝒓
𝑷𝒆𝒒𝒖𝒊𝒗𝑵𝒂𝟐 𝑪𝟐 𝑶𝟒 =
# 𝒆− 𝒈𝒂𝒏𝒂𝒅𝒐𝒔
134.00 𝑔/𝑚𝑜𝑙
𝑃𝑒𝑞𝑢𝑖𝑣𝑁𝑎2 𝐶2 𝑂4 =
2
𝑃𝑒𝑞𝑢𝑖𝑣𝑁𝑎2 𝐶2 𝑂4 = 67.00 𝑔/𝑒𝑞
6. Calcule la normalidad de una solución de permanganato de potasio que para la
valoración de una solución que contiene 0.3 g de Na2C2O4 en medio acido
requiere 40 ml de solución de KMnO4
Para la resolución de este ítem utilizaremos la siguiente ecuación química
simplificada:
𝑴𝒂𝒔𝒂𝑵𝒂𝟐 𝑪𝟐 𝑶𝟒 (𝒈)
𝑵𝑲𝑴𝒏𝑶𝟒 (𝒆𝒒/𝑳) =
𝑷𝒆𝒒𝒖𝒊𝒗𝑵𝒂𝟐 𝑪𝟐 𝑶𝟒 (𝒈/𝒆𝒒) ∗ 𝑽𝑮𝑨𝑺𝑻𝑶 𝑲𝑴𝒏𝑶𝟒 (𝑳)
0.30 g
NKMnO4 (eq/L) =
67.00 g/eq ∗ 0.040 L
NKMnO4 (eq/L) = 0.11194 eq/L
Instituto de Educación Superior Tecnológico Publico “Catalina Buendía de Pecho”
Das könnte Ihnen auch gefallen
- Informe Determiancion de Hierro Por Dicromatometria TERMINADODokument16 SeitenInforme Determiancion de Hierro Por Dicromatometria TERMINADOAnonymous 28dbyt100% (1)
- Ejercicios de Uímica AnaliticaDokument34 SeitenEjercicios de Uímica AnaliticamarcosNoch keine Bewertungen
- DicromatometriaDokument5 SeitenDicromatometriaVictor Vera DonosoNoch keine Bewertungen
- Practica No. 3 Determinacion de NiquelDokument20 SeitenPractica No. 3 Determinacion de NiquelJOSE MARIA VASQUEZ BECERRANoch keine Bewertungen
- Volumetría de Oxido - Reducción IDokument10 SeitenVolumetría de Oxido - Reducción IingrossNoch keine Bewertungen
- Determinacion Del Hierro Como Oxido FerricoDokument12 SeitenDeterminacion Del Hierro Como Oxido FerricoDalhia Susan Romero Villanueva100% (2)
- Examen Final Analisis Instrumental SolucionDokument3 SeitenExamen Final Analisis Instrumental SolucionMachaca Mamani Scarlen Patricia100% (1)
- Semana 12. COMPLEXOMETRÍADokument66 SeitenSemana 12. COMPLEXOMETRÍAJhon LeivaNoch keine Bewertungen
- Valoracion Ácido BaseDokument4 SeitenValoracion Ácido BaseBladimir Alex Quispe RochaNoch keine Bewertungen
- Determinacion Del Peroxido de HidrogenoDokument19 SeitenDeterminacion Del Peroxido de HidrogenoJohann Albert Arroyo Rojas100% (1)
- Lixiviacion de CobreDokument22 SeitenLixiviacion de CobreJohann Albert Arroyo RojasNoch keine Bewertungen
- Analisis Bromatologico de MantequillaDokument14 SeitenAnalisis Bromatologico de MantequillaAnghela Cueva Vidal100% (2)
- Modulo 1Dokument23 SeitenModulo 1Johann Albert Arroyo RojasNoch keine Bewertungen
- PermanganometriaDokument3 SeitenPermanganometriaAlejandra CorsiNoch keine Bewertungen
- Cuestionario 7Dokument2 SeitenCuestionario 7erizoNoch keine Bewertungen
- Meta 1.7.GarciaAndreaDokument2 SeitenMeta 1.7.GarciaAndreaandrea munguiaNoch keine Bewertungen
- Práctica Calificada 3 QACDokument4 SeitenPráctica Calificada 3 QACOscar Mariano Solorzano HuancaNoch keine Bewertungen
- Conductividad de Soluciones ElectroliticasDokument12 SeitenConductividad de Soluciones ElectroliticasKaren Andrade MoralesNoch keine Bewertungen
- Determinacion de Carbonato de Calcio Mediante RetrocesoDokument8 SeitenDeterminacion de Carbonato de Calcio Mediante RetrocesolorenaNoch keine Bewertungen
- Acidez Total en CervezaDokument3 SeitenAcidez Total en CervezaBibiana TovarNoch keine Bewertungen
- Preparacion y Valoracion de Una Solucion de Tiosulfato de SodioDokument2 SeitenPreparacion y Valoracion de Una Solucion de Tiosulfato de SodioAlfonso HernangilNoch keine Bewertungen
- Identificacion de Cationes Del Grupo IIIDokument16 SeitenIdentificacion de Cationes Del Grupo IIIDaniel AguilarNoch keine Bewertungen
- Desea Que Los Resultados Se Obtengan Con Cuatro Cifras SignificativasDokument1 SeiteDesea Que Los Resultados Se Obtengan Con Cuatro Cifras SignificativasBrando Kevin Palomino MorenoNoch keine Bewertungen
- Practica N 1Dokument11 SeitenPractica N 1JOEL ESLEMEN LOAYZA FERREYRANoch keine Bewertungen
- Laboratorio #4 - Determinacion de Hierro en LentejasDokument8 SeitenLaboratorio #4 - Determinacion de Hierro en LentejasGian F. Alvarez100% (1)
- Informe #9 Determinación Permanganimetrica.Dokument5 SeitenInforme #9 Determinación Permanganimetrica.richard dominguezNoch keine Bewertungen
- Experiencia 4 SensibilidadDokument2 SeitenExperiencia 4 Sensibilidadeduardohk18Noch keine Bewertungen
- Aplicaciones de Las Titulaciones PotenciométricasDokument8 SeitenAplicaciones de Las Titulaciones Potenciométricas708170Noch keine Bewertungen
- Guia de Soluciones ReguladorasDokument9 SeitenGuia de Soluciones ReguladorasPaola Serena Galean AyardeNoch keine Bewertungen
- Química Analítica Clase 13 Uct 2021 - Gravi de Comb TDokument45 SeitenQuímica Analítica Clase 13 Uct 2021 - Gravi de Comb TAzabache Blas BrayanNoch keine Bewertungen
- ArgentometríaDokument5 SeitenArgentometríaCcortesO100% (1)
- Compuestos Oxigenados de NitrogenoDokument5 SeitenCompuestos Oxigenados de NitrogenoRut Gutíerrez100% (1)
- Informe # 1 Estandarización de NaOHDokument13 SeitenInforme # 1 Estandarización de NaOHTania Álvarez OliveraNoch keine Bewertungen
- Informe # 9 Determinación de Calcio en CalizasDokument9 SeitenInforme # 9 Determinación de Calcio en CalizasJulio BurgosNoch keine Bewertungen
- Examen Final de Inorganica 2020b Ss Quispe LuyoDokument6 SeitenExamen Final de Inorganica 2020b Ss Quispe LuyoQUISPE LUYO ROSALINDANoch keine Bewertungen
- Estandarización de Solución de AgNO3 Con Solución de Bromuro de PotasioDokument2 SeitenEstandarización de Solución de AgNO3 Con Solución de Bromuro de PotasioNNNNoch keine Bewertungen
- Avance Lab 5Dokument21 SeitenAvance Lab 5omarNoch keine Bewertungen
- Metodo AlcalimetricoDokument5 SeitenMetodo AlcalimetricoluzNoch keine Bewertungen
- Aminoacidos y ProteinasDokument6 SeitenAminoacidos y Proteinasfrancisco gomezNoch keine Bewertungen
- Cuestionario N º7, 8, 9 y 10Dokument12 SeitenCuestionario N º7, 8, 9 y 10Jean Carla Canedo Zambrana100% (2)
- Teoría de Formacion de Complejos PDFDokument5 SeitenTeoría de Formacion de Complejos PDFgerson95Noch keine Bewertungen
- #1 Informe Titulación Ácido BenzoicoDokument6 Seiten#1 Informe Titulación Ácido BenzoicoSamuel Flores RamirezNoch keine Bewertungen
- Práctica 5 Análisis Carbonatos BicarbonatosDokument4 SeitenPráctica 5 Análisis Carbonatos BicarbonatosFranklin Pastrana ArteagaNoch keine Bewertungen
- Informe 5 Argentometría Parte IDokument9 SeitenInforme 5 Argentometría Parte IJesxy PxrdoNoch keine Bewertungen
- Aplicaciones de YodimetriaDokument5 SeitenAplicaciones de YodimetriaSebastian VillacresNoch keine Bewertungen
- Hidrolisis Acida de Acetato de EtiloDokument14 SeitenHidrolisis Acida de Acetato de Etilokarina huayhuaNoch keine Bewertungen
- Calor de Descomposición h202Dokument7 SeitenCalor de Descomposición h202Enrique Palma SánchezNoch keine Bewertungen
- Resumen Del Complejo de NiquelDokument3 SeitenResumen Del Complejo de NiquelCamila MolanoNoch keine Bewertungen
- GRUPO 4 Informe Electrosíntesis de Hipoclorito de SodioDokument15 SeitenGRUPO 4 Informe Electrosíntesis de Hipoclorito de SodioENOC ISAIAS ROSALES VERASTEGUINoch keine Bewertungen
- Volumetria de NeutralizacionDokument14 SeitenVolumetria de NeutralizacionEsperanza Mendoza100% (1)
- Marcha Sistematica de Cationes 1Dokument1 SeiteMarcha Sistematica de Cationes 1Tahic PNoch keine Bewertungen
- Cuestionario Grupo I Cationes AnaliticaDokument4 SeitenCuestionario Grupo I Cationes AnaliticaIsrael NarvastaNoch keine Bewertungen
- GUÍA No. 06 OBTENCIÓN DEL DIOXALATO CUPRATO DE POTASIODokument6 SeitenGUÍA No. 06 OBTENCIÓN DEL DIOXALATO CUPRATO DE POTASIOYamilex FrancisNoch keine Bewertungen
- Determinación de Cloruros Por El Método de FajansDokument5 SeitenDeterminación de Cloruros Por El Método de FajansMontserrat CansinoNoch keine Bewertungen
- Informe 3 Química Analitica - p103 - Joselyn Bello - Jenniffer GalarzaDokument10 SeitenInforme 3 Química Analitica - p103 - Joselyn Bello - Jenniffer GalarzaChristiam PereroNoch keine Bewertungen
- Determinación de Ácido Ascórbico Por Volumetría RedoxDokument4 SeitenDeterminación de Ácido Ascórbico Por Volumetría Redoxcristian david londoño river0% (1)
- Volumetria de NeutralizaciónDokument10 SeitenVolumetria de NeutralizaciónKevin RojasNoch keine Bewertungen
- Acidimetria y AlcalimetriaDokument32 SeitenAcidimetria y AlcalimetriathonyNoch keine Bewertungen
- Volhard OriginalDokument5 SeitenVolhard OriginalAlejandra CorsiNoch keine Bewertungen
- Informe VolumetriaDokument31 SeitenInforme VolumetriaCristobal Alejandro Z100% (1)
- Informe Cao FinDokument18 SeitenInforme Cao FinjuanNoch keine Bewertungen
- Laboratorio #6 Determinacion de PeroxidosDokument9 SeitenLaboratorio #6 Determinacion de Peroxidossebas48889Noch keine Bewertungen
- Informe 9 - VALORACIONES REDOXDokument23 SeitenInforme 9 - VALORACIONES REDOXSTEFHANY PAOLA MENDOZA HERNANDEZNoch keine Bewertungen
- Fundo La Capilla OwDokument1 SeiteFundo La Capilla Owyordin vargasNoch keine Bewertungen
- Chemcal Lab.Dokument4 SeitenChemcal Lab.Johann Albert Arroyo RojasNoch keine Bewertungen
- Catalogo de AspersoresDokument4 SeitenCatalogo de AspersoresJohann Albert Arroyo RojasNoch keine Bewertungen
- Presentacion Compost.Dokument7 SeitenPresentacion Compost.Johann Albert Arroyo RojasNoch keine Bewertungen
- Estimación de Incertidumbre en Esayos Fisicoquimicos en El Marco de La Norma Isoiec 17025 - CompressedDokument3 SeitenEstimación de Incertidumbre en Esayos Fisicoquimicos en El Marco de La Norma Isoiec 17025 - CompressedJohann Albert Arroyo RojasNoch keine Bewertungen
- EstratoferaDokument28 SeitenEstratoferaAnalyts ArjNoch keine Bewertungen
- Catalogo de AccesoriosDokument5 SeitenCatalogo de AccesoriosJohann Albert Arroyo RojasNoch keine Bewertungen
- CatalogoDokument13 SeitenCatalogoJohann Albert Arroyo RojasNoch keine Bewertungen
- Evalucion Estadistica Aplicada A Laboratorios 02Dokument3 SeitenEvalucion Estadistica Aplicada A Laboratorios 02Johann Albert Arroyo RojasNoch keine Bewertungen
- Trabajo Edit NecocheaDokument22 SeitenTrabajo Edit NecocheaChemical student JohannNoch keine Bewertungen
- Cookbook de AAS EspañolDokument297 SeitenCookbook de AAS EspañolJhonny CorillocllaNoch keine Bewertungen
- Brochure - Adsorción, Desorción Del Oro y Regeneración Del Carbón Activado - CompressedDokument3 SeitenBrochure - Adsorción, Desorción Del Oro y Regeneración Del Carbón Activado - CompressedJohann Albert Arroyo RojasNoch keine Bewertungen
- Evalucion Estadistica Aplicada A Laboratorios 02Dokument3 SeitenEvalucion Estadistica Aplicada A Laboratorios 02Johann Albert Arroyo RojasNoch keine Bewertungen
- Contaminacion Del Suelo MonograficoDokument28 SeitenContaminacion Del Suelo MonograficoJohann Albert Arroyo RojasNoch keine Bewertungen
- Modulo 01Dokument22 SeitenModulo 01Johann Albert Arroyo RojasNoch keine Bewertungen
- Du Reza AguaDokument18 SeitenDu Reza AguaBriian Michael Fuentes SanchezNoch keine Bewertungen
- Visita Tecnica TacamaDokument18 SeitenVisita Tecnica TacamaChemical student JohannNoch keine Bewertungen
- Visita Tecnica TacamaDokument18 SeitenVisita Tecnica TacamaChemical student JohannNoch keine Bewertungen
- SUELOSDokument28 SeitenSUELOSJohann Albert Arroyo RojasNoch keine Bewertungen
- Trabajo - de - Quimica - Analitica 02 AQUIJEDokument13 SeitenTrabajo - de - Quimica - Analitica 02 AQUIJEJohann Albert Arroyo RojasNoch keine Bewertungen
- Informe de Trabajo ProfesionalDokument115 SeitenInforme de Trabajo ProfesionalRosmel Mamani Ramos100% (1)
- Entre Vista DorDokument2 SeitenEntre Vista DorAnalyts ArjNoch keine Bewertungen
- Los Maestros de Control de CalidadDokument18 SeitenLos Maestros de Control de CalidadJohann Albert Arroyo RojasNoch keine Bewertungen
- PLAB 03 ALQUINOS JosueZavalaDokument19 SeitenPLAB 03 ALQUINOS JosueZavalaJohann Albert Arroyo RojasNoch keine Bewertungen
- Año Del Dialogo y La Reconciliacion NacionalDokument1 SeiteAño Del Dialogo y La Reconciliacion NacionalJohann Albert Arroyo RojasNoch keine Bewertungen
- Año Del Dialogo y La Reconciliacion NacionalDokument2 SeitenAño Del Dialogo y La Reconciliacion NacionalJohann Albert Arroyo RojasNoch keine Bewertungen
- PertDokument35 SeitenPertpatriciaNoch keine Bewertungen
- Ficha Técnica Junta Universal CardánicaDokument3 SeitenFicha Técnica Junta Universal CardánicaasdfNoch keine Bewertungen
- Generalidades de La MaderaDokument55 SeitenGeneralidades de La MaderaRoberto Carlos Cornejo PalominoNoch keine Bewertungen
- Itinerario Turístico-1 - 202Dokument21 SeitenItinerario Turístico-1 - 202Alex Rodrigo Quispe PumaNoch keine Bewertungen
- Nec Se Vivienda Parte 1Dokument40 SeitenNec Se Vivienda Parte 1Edison CampoverdeNoch keine Bewertungen
- Guia Taller 04 ESR-2019-2Dokument13 SeitenGuia Taller 04 ESR-2019-2Jhon Guzman0% (1)
- ManualDokument16 SeitenManualAlejandraNoch keine Bewertungen
- Construccion Instalacion Pilotes AnexosDokument22 SeitenConstruccion Instalacion Pilotes AnexosARLSNoch keine Bewertungen
- Metodos de Produccion Feb 16 2015 PDFDokument146 SeitenMetodos de Produccion Feb 16 2015 PDFmiguemillosangelNoch keine Bewertungen
- PRECOMISIONADODokument9 SeitenPRECOMISIONADOAlfredo R LarezNoch keine Bewertungen
- Documento Final Presa IpaDokument235 SeitenDocumento Final Presa IpaGonzalo Chocala Bellido100% (1)
- Mvag 24 Desgaste Los Angeles Astm C 131 PDFDokument9 SeitenMvag 24 Desgaste Los Angeles Astm C 131 PDFLedy Ana Pernia CastroNoch keine Bewertungen
- Trabajo Domiciliario de Consolidacion 2019 CorregidoDokument3 SeitenTrabajo Domiciliario de Consolidacion 2019 CorregidoAnonymous 03TLwlNoch keine Bewertungen
- Aeropuertos Capitulo 7 Caracteristicas Fisicas de Las Calles de RodajeDokument21 SeitenAeropuertos Capitulo 7 Caracteristicas Fisicas de Las Calles de RodajeJohn Nelo Aruquipa MNoch keine Bewertungen
- Ruedas Fonicas 36 60Dokument17 SeitenRuedas Fonicas 36 60William Ramírez100% (4)
- Preparaciones Funcionales WordDokument30 SeitenPreparaciones Funcionales WordmarcosNoch keine Bewertungen
- Superflex-EVA 3x120 +1x70 mm2 1kV Rev 3Dokument2 SeitenSuperflex-EVA 3x120 +1x70 mm2 1kV Rev 3Roberto Daniel Jimenez EspejoNoch keine Bewertungen
- Turbo ElectronicoDokument13 SeitenTurbo Electronicorobyn100Noch keine Bewertungen
- Explosivos IDokument132 SeitenExplosivos IDaissy Pulido100% (1)
- Curso de Física Atómica AvanzadaDokument71 SeitenCurso de Física Atómica AvanzadaIsaac Lael Gómez FolNoch keine Bewertungen
- Proyecto EscolarDokument11 SeitenProyecto EscolarInterian Pacheco Ángel DavidNoch keine Bewertungen
- MT. ExtintoresDokument9 SeitenMT. ExtintoresGeoffrey Collantes JulcaNoch keine Bewertungen
- ORDENANZASDokument53 SeitenORDENANZASreaxiumNoch keine Bewertungen
- Teclas para Arranque PCDokument3 SeitenTeclas para Arranque PCAndres Mauricio HernandezNoch keine Bewertungen
- Manual de Instrucciones y Condiciones de Instalación Msa400dc 110V MonofásicaDokument8 SeitenManual de Instrucciones y Condiciones de Instalación Msa400dc 110V MonofásicaSOPORTE TECNICONoch keine Bewertungen
- Prueba Diagnostica InformaticaDokument1 SeitePrueba Diagnostica InformaticaIvan De La PeñaNoch keine Bewertungen
- Ejercicio 3-70Dokument2 SeitenEjercicio 3-70putoNoch keine Bewertungen
- Especificaciones Tecnicas PavimentoDokument34 SeitenEspecificaciones Tecnicas PavimentoOsman Menacho BernalNoch keine Bewertungen
- BDB CMD VT: Ventiladores Centrífugos de Doble AspiraciónDokument10 SeitenBDB CMD VT: Ventiladores Centrífugos de Doble AspiraciónJose MartinezNoch keine Bewertungen
- Termofisica y TermoquimicaDokument7 SeitenTermofisica y TermoquimicaRuben Manuel Moyer ManzurNoch keine Bewertungen