Beruflich Dokumente
Kultur Dokumente
Caract de Um Motor PG 24 A 35
Hochgeladen von
carlosmilfontOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Caract de Um Motor PG 24 A 35
Hochgeladen von
carlosmilfontCopyright:
Verfügbare Formate
1/19
2.4:- CARACTERÍSTICAS DE UM MOTOR: (Potências, Rendimentos, Pressões)
(pág. 15-20 apostila)
a) Potências:
1) Potência Efetiva: Ne - potência desenvolvida no eixo do motor, [CVe, kWe ou CV, kW], [BHP],
(Brake Horse Power).
2) Potência Indicada: Ni - potência determinada na cabeça do pistão [CVi, kWi], [IHP] (Indicated Horse
Power).
3) Potência de Atrito: Nat - potência devida aos atritos da máquina. Nos dinamômetros elétricos é
facilmente determinada, fazendo-se o dinamômetro trabalhar como motor
elétrico e medir então a potência desenvolvida [CVat, kWat], [FHP]
(Friction Horse Power). Nat = Ni - Ne
4) Potência de Combustível: Ncomb – potência fornecida ao motor, na forma de combustível [CV, kW], [HP]
b) Rendimento Mecânico: m – é a relação entre a potência efetiva e a indicada.
Ne Ni Nat
1
Nat
m =
m = Ni Ni Ni
Nat
1 1
Ni
c) Pressão Efetiva Média: pme (pressão média efetiva)
Define-se pressão efetiva média (pme), como sendo a altura de um retângulo, que tem por base o volume
deslocado pelo pistão e a área igual ao trabalho realizado pelo ciclo.
Quando referida à potência efetiva Ne, [CV, kW ou BHP], tem-se a pressão média efetiva pme (bmep),
“brake mean efective pressure”, se é referida à potência indicada (IHP), tem-se a pressão média indicada
(imep), “indicated mean effective pressure”.
Ne [CV, kW ou CVe, kWe] pme Ni [CVi, kWi] pmi
Ne [BHP] “BMEP:- brake mean effective pressure”.
Ni [IHP] “IMEP:- indicated mean effective pressure”.
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
2/19
P
[Kgf/m2]
3
L [kgfm]
2 4
Pm 1
V[m3]
L L – kgfm
pm = pm – [kgf/m2] ou L = pm x Vc
Vc Vc – m 3
Pode-se relacionar o trabalho L com a potência N, como segue:-
N = K x L onde K – constante de proporcionalidade
Ne = K x Le
N 1
Ni = K x Li ou N = K x pm x Vc pm = = KI então
Vc K
N KI
pm
Vc
1. Referindo-se à potência indicada:
I
Li Ni 1 Ni x K
Pressão indicada média
x
pmi = Vc Vc K Vc
2. Referindo-se à potência efetiva:
I
Pressão efetiva média Le Ne 1 Ne x K
x
pme = Vc Vc K Vc
A diferença entre a pmi e a pme é a pmat (pressão de atrito média).
pmat = pmi - pme
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
3/19
Local Entrada no Ciclo Ciclo Efetiva no
Combustão Atrito
Parâmetro Motor Teórico Real Eixo
Niid ou
Potências Ncomb Nc Nir Ne Nat
Nit
Pressões Pmiid ou
pmcomb pmc pmir pme pmat
Médias pmit
c tid T m
Rendimentos
e
Ncomb x c = Nc
Ne
Nc x tid = Niid
e = Ncomb c x tid x T x m
Niid x T = Nir
Nir x m = Ne Ne = m x T x tid x c x Ncomb
Ne Nir Nat Nat
1 1
Ne = Nir – Nat m = Nir Nir Nir
2-.4.1:- Cálculo da Potência em Função da Pressão Média:
a) Equação Geral dos MCIE:
Considerando-se que:
s – curso do pistão [m]
d – diâmetro do pistão [m]
n – número de rotação rpm [min-1] ou [tempo-1]
x – número de rotações necessárias para cada curso motor:
x = 2 motores de quatro tempos, simples efeito
x = 1 motores de dois tempos, simples efeito
z – número de cilindros
pme – pressão efetiva média [kgf/m2]
pmi – pressão indicada média [kgf/m2]
πd 2
- área da cabeça do pistão [m2]
4
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
4/19
πd 2
pme x 4 força efetiva sobre o pistão [kgf]
πd 2
pme x 4 x s – trabalho efetivo dado por um curso motor, por cilindro [kgfm]
πd 2 n
pme x 4 x s x z x x trabalho efetivo dado por todos os cilindros, por minuto [kgfm/min]
Sabendo-se ainda que 1 CV = 75kgfm/s teremos;
πd 2 n 1
s z Potência Efetiva em CV, no eixo do motor.
Ne = pme x 4 x 60 75
A esta igualdade, costuma-se dar o nome de Equação Geral dos MCIE.
Para um dado motor, podemos considerar d, s, n, x, z = constantes e ainda, sabemos que N = K x pm
então podemos estabelecer as correlações;
K x pmcomb x c = K x pmc pmcomb x c = pmc
K x pmc x tid = K x pmiid pmc x tid = pmiid
K x pmiid x T = K x pmir pmiid x T = pmir
K x pmir x m = K x pme pmir x m = pme
pme = m x T x tid x c x pmcomb
pme
e = pmcomb
cx tid x T x m
Então na equação geral, se substituirmos pme pela pmi fica:-
Ni= pmi x Potência indicada, em CV, na cabeça do pistão
πd 2 n 1
s z
4 x 60 75
b) Cilindrada v:-
O volume deslocado por um êmbolo, entre o ponto morto superior e o inferior, chama-se de “cilindrada”
πd 2
v s [m3, cm3, l]
4
Se o motor tiver z cilindros, chama-se de “cilindrada do motor” à cilindrada de um cilindro multiplicada
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
5/19
por z.
πd 2
sz
Vm = v x z = 4
Vm - [m3, cm3, l]
c) Relação de compressão rv:- (taxa de compressão)
O volume do cilindro, quando o pistão se encontra no ponto morto inferior PMI, dividido pelo volume do
cilindro, quando o pistão se encontra no ponto morto superior PMS, recebe o nome de “Relação de
Compressão” rv então:
V V – volume no PMI
rv = V0 V0 – volume no PMS
Para motores à gasolina, rv varia de 7 a 10.
Para motores à álcool e a gás natural (GNV), rv varia de 9 a 14.
Para motores Diesel, normalmente é acima de 14.
Considerando-se a equação geral e o volume de cilindrada total dos motores, podemos escrever:
v
πd 2 n 1 pme n
s z Ne xVm
4500 x
Ne = pme x 4 x 60 75 Vm = z x v
Vm
Para uma determinada classe de motores, a pme, n e x são praticamente constantes, logo o tamanho dos
mesmos e a suas potências, são funções das cilindradas totais destes motores.
d) Consumo específico Ce:-
Se chamarmos B o consumo de combustível em kg/h e sendo Ne a potência efetiva em CV, define-se o
consumo específico como sendo:
B B – kg/h
Ce Ce - [kg/CVh, kg/kWh]
Ne para
Ne –CV, kW
O Ce é um meio (parâmetro) muito eficaz para comparar motores, quanto ao seu rendimento.
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
6/19
e) Rendimento térmico t:-
É a relação entre o equivalente térmico do trabalho executado e o calor fornecido.
AL Sempre é necessário, definir-se onde é
ηt
Q medido o “trabalho executado”
f) Correlação entre o consumo específico e o rendimento global do motor (Ce, e):-
Considerando-se que:-
Ne – potência efetiva em [CV]
B – consumo de combustível, em [kg/h]
Pci – poder calorífico do combustível em [kcal/kg]
B x pci – consumo de calor em [kcal/h]
B x pci
3600 consumo de calor em [kcal/s], sabendo-se que 1 kcal = 427 kgfm, então:
427
x B x pci
3600 consumo de calor em unidades mecânicas [kgfm/s], mas 1 CV = 75 kgfm/s assim:
427
xB x pci
3600 75 consumo de calor em [CV]
427 x B x pci
Uma parte de 3600 x 75 é transformada em potência efetiva Ne, então pode-se escrever:
427 427 1 1
3600 x 75 x B x pci x e = Ne 3600 x 75 632,3185012 632,32
B x pci x η e 632,32 Ne B
Ne x Ce
632,32 e = pci B mas Ne - consumo específico [kg/CVh] então
632,32 632,32
ou η x pci
e = Ce x pci Ce = e
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
7/19
g) Relação Ar/Combustível (A/C):-
É o consumo de Ar em relação ao consumo de combustível; A/C = kgar/kgcomb
Vamos ver para a octana C8H18
Inicialmente reagindo estequiometricamente (reação ideal) com o oxigênio O2.
C8H18 + O2 CO2 + H2O
C–8==8 H – 18 = 2 = 9
2β γ 2 8 9 25
12,5
O - 2 = 2 + = 2 2 2
Então a reação com o O2 fica:
C8H18 + 12,5 O2 8 CO2 + 9 H2O
Sendo as massas atômicas iguais a:
C = 12 kg H = 1,0 kg O = 16 kg, teremos:
C8H18 + 12,5 O2 8 CO2 + 9 H2O
(12 x 8) + (1 x 18) + 12,5(16 x 2) 8[12 + (2 x 16)] + 9[(2 x 1) + 16]
114 + 400 352 + 162
514 514
114kg de C8 H18 352kg de CO2 3,09kg de CO2
necessitam de para formar e então 1kg de C8H18 produz
400kg de O2 162kg de H2O 1,42kg de H2O
No entanto, o Ar atmosférico tem 23,15% em peso de oxigênio, logo se necessita de:
400
1.727
A = 0,2315 kg de Ar para queimar 114kg de C8H18 então (1.727 – 400 = 1.327kg de N2) é a
massa de N2 aquecida na combustão.
* Para efeito de cálculo, o Ar é considerado como sendo (O2 + 3,7585N2)
[mostrar o conceito da dedução da fórmula química do Ar]
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
8/19
Com isto a reação total será:
C8H18 + 12,5 O2 + (12,5 x 3,7585) N2 8 CO2 + 9 H2O + (12,5 x 3,7585) N2 ou ainda,
C8H18 + 12,5 (O2 + 3,7585 N2) 8 CO2 + 9 H2O + (12,5 x 3,7585) N2
C8H18 + 12,5 O2 + 47 N2 8 CO2 + 9 H2O + 47 N2
114 + 400 + 1.316 352 + 162 + 1.316
114 + 1.716 352 + 162 + 1.316
1.830 1.830
114kg de C8H18 352kg de CO2 3,09kg de CO2
necessitam de para formar 162kg de H2O, assim 1kg de C8H18 produz 1,42kg de H2O
1.716kg de Ar 1.316kg de N2 11,54kg de N2
1.716
15,05
Então se tem A/C = 114 kg Ar/kg comb.
Esta é a relação estequiométrica para a combustão da C8H18 (octana), com o Ar.
Normalmente, no motor a gasolina, toma-se A/C = 15
Pode-se ainda definir a relação Combustível / Ar C/A = kg comb/kg Ar
1
C/A = A/C que no caso do motor a gasolina, vale:
1
0,066 6,6%
C/A = 15 C/A = 6,6%
Ainda para os motores a gasolina, tem-se:
A/C = 22 C/A = 4,5%
Limite de inflamabilidade
A/C = 15 Estequiométrico C/A = 6,6% (explosividade) da mistura
A/C = 8 C/A = 12,5%
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
9/19
Exercícios:
1. Calcular o A/C para o etanol anidro, reagindo estequiométricamente com o Ar. Considerar: C = 12,
H = 1,0, N = 14, O = 16, o Ar (O2 + 3,76N2) e o etanol anidro C2H5OH ou C2H6O.
C2H6O + (O2 + 3,76N2) CO2 + H2O + N2
2β γ 1 2 2 3 1
α 3
C–2==2 O–1+2=2+ 2 2 =3
H–6=2=3 N – 2 x 3,76 x = 2 = 3,76 x = 11,28
C2H6O + 3 (O2 + 3,76N2) 2 CO2 + 3 H2O + 11,28 N2
2 x 12 + 6 x 1 + 16 x 1 + 3 (2 x 16 + 3,76 x 2 x 14 2 (12 x 1 + 2 x 16) + 3 (2 x 1 + 16) + 11,28 (2 x 14)
46 412 88 54 316
458 458
Então:
46kg de álcool 88kg de CO2 1,91kg de CO2
reagem com formando 54kg de H2O, então 1kg de C2H6O produz 1,17kg de H2O
412kg de Ar 316kg de N2 6,86kg de N2
Com isto, para o etanol anidro (álcool anidro)
412 1
8,9 0,112
A/C = 46 A/C = 9,0 C/A = 9 C/A = 11,2%
Para os motores a álcool, tem-se:
A/C = 18,6 C/A = 5,4%
A/C = 9,0 Estequiométrico C/A = 11,2% Limite de inflamabilidade
(explosividade) da mistura
A/C = 2,7 C/A = 37%
2. Calcular o A/C e o teor dos gases resultantes da combustão estequiométrica para o Metano CH 4,
reagindo com o Ar. Considerar: C = 12, H = 1,0, N = 14 O = 16 e o ar (O2 + 3,7585 N2).
CH4 + (O2 + 3,7585N2) CO2 + H2O + N2
2β γ 2 1 2
α 2
C–1==1 O–2=2+ 2 2 =2
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
10/19
H–4=2=2 N – 2x 3,7585 x = 2 = 3,7585 x 2 = 7,517
Reação estequiométrica de combustão
CH4 + 2 (O2 + 3,7585N2) 1 CO2 + 2 H2O + 7,517 N2
Verificação:
C – 1 = 1 O – 2 x 2 = 2 x 1 + 1 x 2 = 4
H – 4 = 2 x 2 N – 2 x 3,7585 x 2 = 2 x 7,517 7,517 = 7,517
Relação Ar/combustível A/C
CH4 + 2 (O2 + 3,7585N2) 1 CO2 + 2 H2O + 7,517 N2
12 + 4 x 1 + 2 (2 x 16 + 3,7585 x 2 x 14 · 1 (12 x 1 + 2 x 16) + 2 (2 x 1 + 16) + 7,517 (2 x 14))
16 274,476 44 36 210,476
290,476 290,476
Então:
16kg de Metano 44kg de CO2 2,75kg de CO2
reagem com formando 36kg de H2O, então 1kg de Metano produz 2,25kg de H2O
274,476kg de Ar 210,476kg de N2 13,15kg de N2
Com isto, o A/C para o Metano é:
1
0,058
A/C = CA/C = 17,15kgar/kgCH4. C/A = 17,1 C/A = 5,8%
Teor dos gases resultantes da combustão:
% em massa %em volume
44 1
x100 15,1% x100
TCO2 = 290,476 TCO2 = 1 2 7,517 = 9,5%
36 2
x100 12,4% x100
TH2O = 290,476 TH O = 1 2 7,517 = 19,0%
2
210,476 7,517
x100 72,5% x100
TN2 = 290,476 TN2 = 1 2 7,517 = 71,5%
100% 100%
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
11/19
Segundo www.gamagases.com.br/propriedades_metano.htm, o metano (CH4), tem massa especifica
γCH4 = 0,7174 kg/m3 a 101,325 kPa a 0oC e limites de inflamabilidade no Ar, entre 5,0 e 15,4% (em
volumes), portanto os limites de inflamabilidade volumétricos para a mistura Metano/Ar são:
A/C = 20,0 C/A = 5,0%
Limite de inflamabilidade
A/C = 9,5 Estequiométrico C/A = 10,5% (explosividade) da mistura
A/C = 6,5 C/A = 15,4%
Os mesmos limites, considerando as massas de Ar e de Metano ficam:
A/C = 36,0 C/A = 2,8%
Limite de inflamabilidade
A/C = 17,1 Estequiométrico C/A = 5,8% (explosividade) da mistura
A/C = 11,5 C/A = 8,7%
OBS: Para transformar as relações A/C volumétricas em massas, além da densidade do metano, deve-se
considerar a densidade absoluta do Ar, nas mesmas condições, ou seja; pressão de 101,325kPa e
temperatura de 0oC.
Considerando a equação de estado dos gases p x V = M x R x T onde R Ar = 29,26 kgfm/kgK, 0oC =
273,16K, então para o volume de 1,0 m3, a massa de Ar correspondente é dada por (I):
pV 1hPa
M
RT
(I) como p = 101,325kPa = 101,325 x 10 3Pa x =1.013,25hPa = 1.013,25mBAR =
10 2 Pa
1,01325BAR como 1BAR = 1,01972kgf/cm2 = 1 Atmosfera, então:
1,01972kgf/cm 2 kgf 10 4 cm 2
p = 1,01325BAR x = 1,03323 x = 10.332,3kgf/m2, substituindo em (I)
BAR cm 2 m2
fica:
kgf
10.332,32
1,0m3
M m 1,2927kg , ou seja, 1m3 de Ar pesa 1,2927kg/m3.
kgfm
29,26 273,16K
kg K
Assim o γAr = 1,2927 kg/m3
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
12/19
3. Determinar a equação de combustão e a relação Ar/combustível (A/C) para a Octana C 8H18, reagindo
com 80% do Ar estequiométrico. Considerar: C = 12, H = 1,0, N = 14 O = 16 e o Ar (O2 + 3,7585 N2).
A reação estequiométrica da Octana com o Ar é:
C8H18 + 12,5 (O2 + 3,7585 N2) 8 CO2 + 9 H2O + 47 N2
Então 12,5 moles de Ar é a quantidade estequiométrica necessária para queimar a Octana, assim se a
quantidade disponível de Ar é de apenas 80%, então o n° de moles será de 80% do valor estequiométrico,
ou seja, a nova reação será:
C8H18 + 0,8 x 12,5 (O2 + 3,7585 N2) CO2 + CO + H2O + N2
C–8=+ +=8 [I]
H – 18 = 2 = 9,0
O – 2 x 10 = 2 + + 20 = 2 + + 9 2 + = 11 [II]
N – 2 x 3,7585 x 10 = 2 = 37,585
Resolvendo [I] e [II] fica: + = 8 (-1) e +
2 + = 11
= 3,0, substituindo em [I] 3 + = 8, então = 5,0
Assim a reação de combustão, com falta de Ar fica:
C8H18 + 10 (O2 + 3,7585 N2) 3 CO2 + 5 CO + 9 H2O + 37,585 N2
Nesta reação substituindo-se as massas atômicas dos elementos obtém-se:
C8H18 + 10 (O2 + 3,7585 N2) 3 CO2 + 5 CO + 9 H2O + 37,585 N2
(8x12+18x1) + 10(16x2+3,7585x2x14) 3(12+2x16) + 5(12+16) + 9(2x1+16) + 37,585x2x14
114 + 1.372,38 132 + 140 + 162 + 1.052,38
1.486,38 1.486,38
A 1.372,38
12,038 12
A relação Ar/combustível A/C será : C 114 A/C = 12
4. Determinar a equação de combustão e a relação Ar/combustível (A/C) para a Octana C 8H18, reagindo
com o Ar que está em excesso de 20% em relação ao estequiométrico. Considerar: C = 12, H = 1,0, N =
14 O = 16 e o Ar (O2 + 3,7585 N2).
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
13/19
A reação estequiométrica da Octana com o Ar é:
C8H18 + 12,5 (O2 + 3,7585 N2) 8 CO2 + 9 H2O + 47 N2
Com o excesso de Ar de 20% a reação passa a ser:
C8H18 + 1,2 x 12,5 (O2 + 3,7585 N2) 8 CO2 + 9 H2O + N2 + O2
15
30 25
O – 2 x 15 = 2 x 8 + 9 + 2 30 = 25 + 2 β = 2,5
2
N – 2 x 3,7585 x 15 = 2 = 56,378
Assim a reação de combustão, com excesso de Ar fica:
C8H18 + 15 (O2 + 3,7585 N2) 8 CO2 + 9 H2O + 56,378 N2 + 2,5 O2
Nesta reação substituindo-se as massas atômicas dos elementos obtém-se:
C8H18 ....+.... 15 (O2 + 3,7585 N2) 8 CO2 + 9 H2O + 56,378 N2 + 2,5 O2
(8x12+18x1) + 15(16x2+3,7585x2x14) 8(12+2x16) + 9(12+16) + 56,378(2x14) + 2,5x2x16
114 + 2.058,57 352 162 1.578,584 80
2.172.57 2.172,58
A 2.058,57
18,058 18
A relação Ar/combustível A/C será: C 114 A/C = 18
h) Rendimento volumétrico v:-
É a relação entre a massa de ar realmente aspirada e a massa de ar, correspondente ao volume deslocado
pelo êmbolo, nas condições atmosféricas.
Massa de ar realmente aspirada - Gr
Massa de ar deslocada pelo êmbolo – Gt
V – volume total [m3]
V
G= v v – volume específico [m3/kg]
Normalmente para os motores se usa G na unidade de tempo, (vazão mássica) G [kg/h, kg/s, etc]
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
14/19
Vr
Gr = v r p x V = G x R x T ou se (G) tem-se p x v = R x T então
Vt RT p r Vr p t Vt
Gt = v t v= p logo Gr = R Tr e Gt = R Tt mas;
Vr = Vt = V – volume do cilindro então;
p r Vr p r
Gr R Tr p Tt p r Tt
Tr r
Gt p t Vt p t p t Tr v =
p t Tr
v = R Tt Tt
v 1 – para motores de aspiração natural
v 1 – para motores sobre-alimentados
[entregar folhas com Dados Práticos de Rendimentos dos Motores de Combustão Interna de
Êmbolos.]
i) Relações para comparação de motores:-
1) Consumo específico Ce [kg/CVh, kg/kWh]
2) Pressão média efetiva pme [kgf/m2, kgf/cm2]
3) Peso “específico” do motor [kg de motor/CVe]
Ne pme n
4) Potência liberada por cilindrada, a qual já envolve a rotação. Vm 4500 x
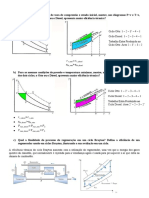
j) Tipos de testes:-
Podem ser de dois tipos
I – Testes com velocidade variável:-
a) Motores a explosão:
Abre-se totalmente a borboleta reguladora da aceleração, no carburador, e varia-se a carga, variando-se,
portanto a rotação. Em diversas rotações, fazem-se as leituras da potência, torque, consumo específico,
temperaturas e se obtém gráficos conforme segue:
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
15/19
Nemax
Mtmax
ηtmax
Cemin ηtmax
Cemin
n [rpm]
n1 Mtmax n2 Cemin n3 Nemax
n1 = Rotação de torque máximo, n2 = Rotação de Ce mínimo e max, n3 = Rotação de potência máxima Nemax.
b) Motores Diesel:
Também se varia a rotação, mantendo-se o acelerador todo aberto, quando então se obtém curvas
semelhantes às do motor a explosão (gasolina, álcool).
Nos motores Diesel de aspiração natural a plena carga é notada facilmente, pois a injeção de combustível
pode ultrapassar a relação estequiométrica e a combustão torna-se incompleta, com a conseqüente
formação de fumaça escura, que é um indício de que nem todo o combustível, encontrou o oxigênio
necessário e como o hidrogênio é mais facilmente combinável com o oxigênio, resulta carbono livre, em
forma de fuligem. Tal fenômeno, entretanto não é observado nos motores turbo–alimentados.
II – Testes com velocidade constante:
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
16/19
Mantém-se o motor numa determinada rotação e varia-se a carga, consequentemente, há uma variação do
consumo. Normalmente a carga é referida em porcentagem da carga máxima. (geradores de energia
elétrica)
Consumo
Específico
Ce [kg/CVh
Ce mínimo
% de Carga
25 50 75 100 110
(estudar Problema da Página 20 na apostila e os exercícios da lista I).
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
17/19
DADOS PRÁTICOS DE RENDIMENTOS
NOS MOTORES DE COMBUSTÃO INTERNA DE ÊMBOLOS
I - RENDIMENTO MECÂNICO E RENDIMENTO ECONÔMICO OU GLOBAL
Rendimento econômico é o rendimento total do motor.
TABELA I
TIPOS DE MOTORES m e
1 – Motores a gás, pequenos 0,72 a 0,74 0,20 a 0,22
2 – Motores a gás, médios 0,78 a 0,82 0,26 a 0,29
3 - Motores a gás, grandes 0,80 a 0,83 0,26 a 0,30
4 – Motores à gasolina e benzina 0,78 a 0,82 0,22 a 0,29
5 – Motores de culatra incandescente 0,74 a 0,76 0,20 a 0,24
6 – Motores diesel médios 0,76 a 0,78 0,32 a 0,34
7 – Motores diesel grandes 0,78 a 0,80 0,34 a 0,36
8 – Motores diesel grandes, sem compressor 0,82 a 0,85 0,34 a 0,38
9 – Motores diesel turbo-alimentados, 0,82 a 0,92 0,36 a 0,42
marítimos, de baixa rotação
TABELA II
TIPOS DE MOTORES e
1 – Pequenos motores de dois tempos à carburação 0,15 a 0,20
2 – Motores de dois tempos, grandes, com lavagem de cilindros 0,18 a 0,22
3 – Motores de automóveis, à gasolina, quatro tempos, a 2000 rpm
RAZÃO DE COMPRESSÃO VOLUMÉTRICA
4:1 0,23
5:1 0,27
6:1 0,30
7:1 0,32
4 – Motores de corrida, alta velocidade, rv = 10:1 0,35
5 – Motores de aviação, com superalimentação rv = 7: a 8,5:1 0,31 a 0,36
6 – Motores diesel, com válvulas comuns, rv = 10:1 a 18:1 0,36 a 0,39
7 – Motores diesel modernos, a 1300 rpm, câmara de combustão 0,40
tipo Ricardo, rv = 15:1
Em motores de dois tempos, com bomba de lavagem especial, temos:
m 2T = (0,85 a 0,90) x m4T
Em motores de dois tempos, com lavagem por compressão no Carter, temos:
m 2T = (0,70 a 0,80) x m4T
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
18/19
TABELA III
RENDIMENTOS MECÂNICOS
MOTORES 4 TEMPOS 2 TEMPOS
1 - Automóveis 0,75 a 0,85 0,50 a 0,70
2 – Estacionários pequenos 0,80 a 0,87 0,70 a 0,75
3 – Estacionários grandes 0,84 a 0,90 0,75 a 0,85
4 – Motores de popa 0,80 a 0,85 0,60 a 0,70
II - RENDIMENTO VOLUMÉTRICO
Uma das fórmulas experimentais existentes e das mais usadas é a de MINTER & FINN:
1,4
1 R 1
177,4 1 108,2 V
V =
RV RV
177,4 e 108,2 são constantes experimentais
rv = razão de compressão volumétrica
V = rendimento volumétrico em %
Para:
rv V
6:1 80 %
7:1 79 %
III - RENDIMENTO VOLUMÉTRICO EM FUNÇÃO DA VELOCIDADE MÉDIA DO PISTÃO
Para os motores de automóveis temos:
VELOCIDADE MÉDIA DO PISTÃO V
5,10 m/s 0,75 a 0,90
7,67 m/s 0,74 a 0,85
10,18 m/s 0,70 a 0,80
16,25 m/s 0,60 a 0,70
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
19/19
RENDIMENTO VOLUMÉTRICO EM FUNÇÃO DA VELOCIDADE MÉDIA DOS GASES
ATRAVÉS DAS VÁLVULAS:
Alguns autores relacionam o rendimento volumétrico, com a velocidade média dos gases, através das válvulas.
VELOCIDADE DOS GASES V
30,5 m/s 0,78
61,0 m/s 0,73
91,5 m/s 0,56
/conversion/tmp/scratch/393138195.doc Revisão: 02/10/13
Das könnte Ihnen auch gefallen
- Medindo O Fator De Potência Com Stm32f103c8 Programado No ArduinoVon EverandMedindo O Fator De Potência Com Stm32f103c8 Programado No ArduinoNoch keine Bewertungen
- Motores Combustão Interna PDFDokument24 SeitenMotores Combustão Interna PDFGabriel AlvesNoch keine Bewertungen
- Medindo O Fator De Potência Com Esp32 Programado No ArduinoVon EverandMedindo O Fator De Potência Com Esp32 Programado No ArduinoBewertung: 5 von 5 Sternen5/5 (1)
- 3 - Parâmetros de Desempenho e GrométricosDokument29 Seiten3 - Parâmetros de Desempenho e GrométricoslucasdacunhaborowiakNoch keine Bewertungen
- Desenvolvendo Um Datalogger Para Medir Energia Com PicVon EverandDesenvolvendo Um Datalogger Para Medir Energia Com PicNoch keine Bewertungen
- Turbina HeólicaDokument63 SeitenTurbina HeólicaNilson J. GuiseliniNoch keine Bewertungen
- Exercícios Resolvidos MotoresDokument13 SeitenExercícios Resolvidos MotoresGermana SouzaNoch keine Bewertungen
- Conversor cc-cc para aplicações veiculares: conversor cc-cc com características de tensão e corrente compatíveis com aplicações e veículos elétricosVon EverandConversor cc-cc para aplicações veiculares: conversor cc-cc com características de tensão e corrente compatíveis com aplicações e veículos elétricosNoch keine Bewertungen
- Aula2 Parâmetros MCIDokument36 SeitenAula2 Parâmetros MCIElias BerbettyNoch keine Bewertungen
- Programação Em C Para Controle De Ângulo De DisparoVon EverandProgramação Em C Para Controle De Ângulo De DisparoNoch keine Bewertungen
- Roteiro Projeto Bomba CentrífugaDokument21 SeitenRoteiro Projeto Bomba CentrífugaEmerson Borges SantanaNoch keine Bewertungen
- Formulário de Motores de Combustão InternaDokument3 SeitenFormulário de Motores de Combustão InternaJuliano MilherNoch keine Bewertungen
- Exemplo 8.1 ShigleyDokument8 SeitenExemplo 8.1 ShigleyRennan ReneNoch keine Bewertungen
- Apresentação de Potência EfetivaDokument15 SeitenApresentação de Potência Efetivaadriano_frNoch keine Bewertungen
- Análise Teórica Do Dimensionamento de Uma Caixa de ReduçãoDokument5 SeitenAnálise Teórica Do Dimensionamento de Uma Caixa de ReduçãoCarlos EduardoNoch keine Bewertungen
- F 07.47 - 00 Memorial de Calculo MC15 - Haste GloboDokument3 SeitenF 07.47 - 00 Memorial de Calculo MC15 - Haste Globothiagorep17Noch keine Bewertungen
- Problemas Física2 - TermodinâmicaDokument24 SeitenProblemas Física2 - TermodinâmicaAndré AntunesNoch keine Bewertungen
- Pratica 2Dokument8 SeitenPratica 2Andre RodriiguesNoch keine Bewertungen
- Exercícios - Resolvidos - TU2 - Rev - F (1) - 1 PDFDokument49 SeitenExercícios - Resolvidos - TU2 - Rev - F (1) - 1 PDFLuiz SilvaNoch keine Bewertungen
- FormulárioDokument10 SeitenFormulárioRobby BobbyNoch keine Bewertungen
- Memorial de Calculo - Motor Redutor de Parafuso Semfim e Coroa Do Carro LongitudinalDokument33 SeitenMemorial de Calculo - Motor Redutor de Parafuso Semfim e Coroa Do Carro LongitudinalEleno RibeiroNoch keine Bewertungen
- Projetos MecanicosDokument58 SeitenProjetos MecanicosDiabolos SidNoch keine Bewertungen
- Sistema de Elevação Com MoitãoDokument1 SeiteSistema de Elevação Com MoitãoWilton CarvalhoNoch keine Bewertungen
- APTA-ET108-2014-Gas-Folha de Calculo-Formula Da Velocidade de Escoamento 796Dokument1 SeiteAPTA-ET108-2014-Gas-Folha de Calculo-Formula Da Velocidade de Escoamento 796GingubaNoch keine Bewertungen
- Aula07-Eixos Tensão de ConfrontoDokument30 SeitenAula07-Eixos Tensão de Confrontogildoan santosNoch keine Bewertungen
- Solução Exercício Forca TorneamentoDokument4 SeitenSolução Exercício Forca TorneamentoAnna BastosNoch keine Bewertungen
- Projeto de Maquinas VL07Dokument20 SeitenProjeto de Maquinas VL07igormlacerdaNoch keine Bewertungen
- Prova 1 - RespostaDokument3 SeitenProva 1 - RespostaYago DantasNoch keine Bewertungen
- Atividade Pratica - Controle ContinuoDokument9 SeitenAtividade Pratica - Controle ContinuoAprovouNoch keine Bewertungen
- Aula 7 Eixos - Tensão de ConfrontoDokument29 SeitenAula 7 Eixos - Tensão de ConfrontoZickson ManjateNoch keine Bewertungen
- Projeto de Redutor - Memória de CálculoDokument30 SeitenProjeto de Redutor - Memória de CálculoNilton SantosNoch keine Bewertungen
- Memorial de Calculo Ponte RolanteDokument135 SeitenMemorial de Calculo Ponte RolanteMarcelo Issler Ferreira SousaNoch keine Bewertungen
- Apostila de Análise Estrutural I - Vigas Isostáticas - Parte 1Dokument7 SeitenApostila de Análise Estrutural I - Vigas Isostáticas - Parte 1CaykeLuisNoch keine Bewertungen
- Conceitos Iniciais - Mecanica Dos FluídosDokument7 SeitenConceitos Iniciais - Mecanica Dos FluídosRUBIA DAIANENoch keine Bewertungen
- Sistemas Térmicos - Imprimir 1Dokument14 SeitenSistemas Térmicos - Imprimir 1Sumaia Benjamin TelesNoch keine Bewertungen
- M Quinas T Rmicas Prova Final NassauDokument13 SeitenM Quinas T Rmicas Prova Final Nassaudsoliveira.lfiNoch keine Bewertungen
- Teoria CineticaDokument32 SeitenTeoria CineticatchepssilveiraNoch keine Bewertungen
- Atividade Pratica - Controle Continuo - Automacao IndustrialDokument9 SeitenAtividade Pratica - Controle Continuo - Automacao IndustrialAprovouNoch keine Bewertungen
- V2 - Projeto de Redutor de Parafuso Semfim e CoroaDokument35 SeitenV2 - Projeto de Redutor de Parafuso Semfim e CoroaEleno RibeiroNoch keine Bewertungen
- Apostila de Dimensionamento C - HidráulicaDokument10 SeitenApostila de Dimensionamento C - HidráulicaAndre RodriiguesNoch keine Bewertungen
- AulaTEE 04 17Dokument13 SeitenAulaTEE 04 17Felippe Fernando BarbosaNoch keine Bewertungen
- F 07.47 - 00 Memorial de Calculo Mc35 - Torque Dos Prisioneiro Cam-SetDokument1 SeiteF 07.47 - 00 Memorial de Calculo Mc35 - Torque Dos Prisioneiro Cam-Setthiagorep17Noch keine Bewertungen
- Memorial de Calculo Ponte RolanteDokument135 SeitenMemorial de Calculo Ponte Rolantejeferson clecioNoch keine Bewertungen
- RendimentosDokument14 SeitenRendimentosffsjrNoch keine Bewertungen
- Apostila Eixos Emaq IDokument37 SeitenApostila Eixos Emaq Igiu100% (1)
- Aula 5 - Hidrodinâmica - Teorema de Bernoulli em Turbinas e Condutos ForçadosDokument10 SeitenAula 5 - Hidrodinâmica - Teorema de Bernoulli em Turbinas e Condutos ForçadosMário SérgioNoch keine Bewertungen
- Força e Potência de CorteDokument13 SeitenForça e Potência de CortevictorNoch keine Bewertungen
- 1 Atividade SMII Nomenclatura BásicaDokument5 Seiten1 Atividade SMII Nomenclatura BásicaFabio SilvaNoch keine Bewertungen
- MC Dimensionamento Redutor MODELO 12jan24Dokument8 SeitenMC Dimensionamento Redutor MODELO 12jan24Kalipse FerreiraNoch keine Bewertungen
- Trabalho G2Dokument4 SeitenTrabalho G2Alessandro MarguttiNoch keine Bewertungen
- Aula 06 - SlidesDokument33 SeitenAula 06 - Slidesleandro_mendes_econoNoch keine Bewertungen
- Estudo de Protecao - SE 15kVDokument23 SeitenEstudo de Protecao - SE 15kVLucas BatistaNoch keine Bewertungen
- Teoria Da SemelhançaDokument18 SeitenTeoria Da SemelhançaDaniel0% (1)
- Aula 4 - Potencia ComplexaDokument33 SeitenAula 4 - Potencia ComplexaVo SantosNoch keine Bewertungen
- EME610 2015 Aula 04 Hidraulica 04Dokument26 SeitenEME610 2015 Aula 04 Hidraulica 04André MariaNoch keine Bewertungen
- Exercicios Resolvidos Unidade 1 Curso Básico de Mecânica Dos FluidosDokument10 SeitenExercicios Resolvidos Unidade 1 Curso Básico de Mecânica Dos FluidossodajovemNoch keine Bewertungen
- PINS NelsonDokument13 SeitenPINS NelsonJaime HuoNoch keine Bewertungen
- Conversor CC CCDokument27 SeitenConversor CC CCIago Oliveira deSouzaNoch keine Bewertungen
- ApostilaSEP IDokument112 SeitenApostilaSEP IClaudia InnaNoch keine Bewertungen
- Passagem de PigDokument38 SeitenPassagem de Pigcarlosmilfont100% (1)
- Dimensionamento de Linha de Vida para Atividades em Alturas No CT 20Dokument16 SeitenDimensionamento de Linha de Vida para Atividades em Alturas No CT 20carlosmilfontNoch keine Bewertungen
- Inspeção Inicial FT 44504801ADokument12 SeitenInspeção Inicial FT 44504801AcarlosmilfontNoch keine Bewertungen
- Valvula de Controle, Fonte de Pesquisa e TrabalhoDokument259 SeitenValvula de Controle, Fonte de Pesquisa e TrabalhoLu SampaioNoch keine Bewertungen
- Incerteza Medicao PDFDokument177 SeitenIncerteza Medicao PDFcarlosmilfontNoch keine Bewertungen
- Interpretacao de Texto Que Apetite 1 Ou 2 AnoDokument1 SeiteInterpretacao de Texto Que Apetite 1 Ou 2 AnocarlosmilfontNoch keine Bewertungen
- NR 32 Perguntas e RespostasDokument9 SeitenNR 32 Perguntas e RespostascarlosmilfontNoch keine Bewertungen
- Certificado de Teste Hidrostático FT 445048101BDokument2 SeitenCertificado de Teste Hidrostático FT 445048101BcarlosmilfontNoch keine Bewertungen
- Certificado de Teste Hidrostático FT 445048101ADokument2 SeitenCertificado de Teste Hidrostático FT 445048101Acarlosmilfont100% (2)
- NT 6010 Rev.02 VACDokument19 SeitenNT 6010 Rev.02 VACSérgio Leonardo CarmoNoch keine Bewertungen
- Livro de Fisica IDokument165 SeitenLivro de Fisica Ivanderlei ongarato100% (2)
- LivroCpp 2nd NovatecDokument757 SeitenLivroCpp 2nd Novatecraphaelgava100% (1)
- Centrifuga Automatica MAC-MACmasterIII PDFDokument6 SeitenCentrifuga Automatica MAC-MACmasterIII PDFJoão Paulo Mendes RosaNoch keine Bewertungen
- RTN 950 910 - Tela - Basicas - ConfDokument41 SeitenRTN 950 910 - Tela - Basicas - ConfFredy Benites100% (2)
- Lei 8616 de 14 de Julho de 2003Dokument55 SeitenLei 8616 de 14 de Julho de 2003Gizelle Moreira Pinto Rozensvaig100% (1)
- Apostila AbapDokument45 SeitenApostila Abapanon_776118453Noch keine Bewertungen
- MSFZ0005 - Cvu26b Vcu30bDokument7 SeitenMSFZ0005 - Cvu26b Vcu30bValdir BerkembrockNoch keine Bewertungen
- Prospecto Rolo Vibratorio Caterpillar cb534d SatelDokument16 SeitenProspecto Rolo Vibratorio Caterpillar cb534d Satelfabiano silva100% (3)
- Call Mídias Sociais Uma Reflexão Sobre As Novas Ferramentas de Marketing Na HotelariaDokument15 SeitenCall Mídias Sociais Uma Reflexão Sobre As Novas Ferramentas de Marketing Na HotelariaSaulo PereiraNoch keine Bewertungen
- Cabeçote Do CilindroDokument4 SeitenCabeçote Do CilindroDiesel DynamicsNoch keine Bewertungen
- Artigo "Fatores de Qualidade Pontos Positivos Do Emprego Da Tecnologia EAD No Curso de Administração Do Consórcio CEDERJ - UFRRJ"Dokument10 SeitenArtigo "Fatores de Qualidade Pontos Positivos Do Emprego Da Tecnologia EAD No Curso de Administração Do Consórcio CEDERJ - UFRRJ"Wesley Pessanha AlvesNoch keine Bewertungen
- Formando Criancas LeitorasDokument2 SeitenFormando Criancas LeitorasErica GaldinoNoch keine Bewertungen
- Do Erro Como Fonte de Castigo Ao Erro Como Fonte de VirtudeDokument8 SeitenDo Erro Como Fonte de Castigo Ao Erro Como Fonte de VirtudeDejaci AlvesNoch keine Bewertungen
- Fispq Rigon PeletsDokument4 SeitenFispq Rigon PeletsValdir Fonseca VieiraNoch keine Bewertungen
- Concurso JavaWeb Cap2 Abstracao PDFDokument9 SeitenConcurso JavaWeb Cap2 Abstracao PDFValetinoHerreraNoch keine Bewertungen
- Análise para Tomada de Decisões Econômicas de Uma Marmitaria Com Base No Sistema de Apoio À Decisão Poc®Dokument12 SeitenAnálise para Tomada de Decisões Econômicas de Uma Marmitaria Com Base No Sistema de Apoio À Decisão Poc®Taylane CaldasNoch keine Bewertungen
- Min Aula 13Dokument28 SeitenMin Aula 13Rosana LopesNoch keine Bewertungen
- Aula 10 - Nocoes de Informatica PDFDokument11 SeitenAula 10 - Nocoes de Informatica PDFseth_fx8231Noch keine Bewertungen
- Como Instalar TSMDokument6 SeitenComo Instalar TSMIris DebergesNoch keine Bewertungen
- Lista 3 - Psicrometria e Secagem 2021Dokument3 SeitenLista 3 - Psicrometria e Secagem 2021Ana PaulaNoch keine Bewertungen
- Manual Auto-Radio Phaser Ard330Dokument32 SeitenManual Auto-Radio Phaser Ard330Anonymous UnHDui0Q100% (1)
- Módulo Fotovoltaico Jinko Mono 390w Jkm390m-72-VDokument2 SeitenMódulo Fotovoltaico Jinko Mono 390w Jkm390m-72-VP&D CarmehilNoch keine Bewertungen
- Material Quimico e InflamavelDokument16 SeitenMaterial Quimico e InflamavelFF GAMERNoch keine Bewertungen
- Bte26 - 2017 - NOVO CCT Construção PDFDokument147 SeitenBte26 - 2017 - NOVO CCT Construção PDFfmtocnetNoch keine Bewertungen
- Terceiro SetorDokument16 SeitenTerceiro SetorvaniamarNoch keine Bewertungen
- Aquabio Peixes OrnamentaisDokument6 SeitenAquabio Peixes OrnamentaisThalita RodriguesNoch keine Bewertungen
- Informática e InternetDokument203 SeitenInformática e InternetFacuryNoch keine Bewertungen
- Arvore IndustrialDokument30 SeitenArvore IndustrialDiego AzevedoNoch keine Bewertungen