Beruflich Dokumente
Kultur Dokumente
Destilacion Final
Hochgeladen von
lolaOriginalbeschreibung:
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Destilacion Final
Hochgeladen von
lolaCopyright:
Verfügbare Formate
ESCUELA DE INGENIERIA QUIMICA
Operaciones Unitarias 1
Destilación
Asignación Final.
Nombre: Stefany Rocha Ortega Fecha: 30 de Septiembre/09.
Código: 2061286
Grupo: O1
PRIMER PUNTO:
Las presiones de vapor del heptano y del octano son las siguientes (en mmHg)
T(ªC) P7(mm Hg) P8(mm Hg)
98,4 760 377
100 795 356
102 841 380
104 890 406
106 941 429
108 993 452
110 1049 479
112 1104 510
114 1165 540
116 1228 574
118 1296 609
120 1368 647
122 1442 687
124 1528 729
125,6 1593 760
Si las mezclas de estos componentes cumplen la ley de Raoult, determine:
a) Los datos de equilibrio para este sistema a la presión de una atmósfera, calculados
directamente a partir de las presiones de vapor.
b) La volatilidad relativa de cada temperatura.
c) Valor medio aritmético de la volatilidad relativa para todo el intervalo.
d) La relación entre las composiciones de equilibrio de la mezcla a la presión de una
atmósfera, tomando el valor medio de la volatilidad relativa.
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
Datos:
punto de ebullición del octano
en ªC 125,6
punto de ebullición del heptano
en ªC 98,4
PT (atm) 1
PT (mm Hg) 760
Las ecuaciones trabajadas en este ejercicio fueron:
Para las composiciones :
x = (PT - P7) / (P8 - P7)
y = P7 * x / PT
Para la volatilidad relativa
= P7 /P8
Para el valor medio de la volatilidad
M = / n ; n=15
Para la relación de composiciones con M
y’ = *x / (1+x*( -1))
Parte a. Datos de equilibrio.
X Y
1 1
0,920273349 0,962654358
0,824295011 0,912147505
0,731404959 0,856513702
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
0,646484375 0,800449733
0,569316081 0,743856406
0,492982456 0,680445522
0,420875421 0,611376927
0,352 0,539578947
0,28440367 0,459536456
0,219796215 0,374810388
0,156726768 0,282108183
0,096688742 0,183454165
0,038798498 0,078005401
0 0
Parte b. Volatilidad Relativa.
2,01591512
2,23314607
2,21315789
2,19211823
2,19347319
2,19690265
2,18997912
2,16470588
2,15740741
2,13937282
2,12807882
2,11437403
2,09898108
2,09602195
2,09605263
Parte c. valor medio de la volatilidad relativa
M
2,148645793
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
Parte d. Relación entre las composiciones de equilibrio tomando el valor medio de la
volatilidad.
Y'
1
0,961242581
0,909747836
0,854034368
0,797131088
0,739601641
0,676288213
0,609606162
0,538567799
0,460610828
0,377066891
0,285375926
0,186983286
0,079807548
0
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
SEGUNDO PUNTO:
Una mezcla liquida de hexano y benceno que contiene un 40 % molar de hexano, se
somete a destilación instantánea a la presión atmosférica y temperatura constante hasta
que el 40% del líquido inicial pasa a la fase vapor.
Calcule:
a) La temperatura a que ha de realizarse la operación y las composiciones del líquido
residual y del vapor separado.
b) La cantidad de calor necesario
T (°C) x y'
80.1 0 0
78.5 0.05 0.111
77.1 0.10 0.191
76 0.15 0.258
75.1 0.20 0.317
74.4 0.25 0.371
73.7 0.30 0.422
72.7 0.35 0.470
72.2 0.40 0.518
71.5 0.45 0.563
71 0.50 0.602
70.6 0.55 0.640
70.3 0.60 0.676
69.9 0.65 0.710
69.5 0.70 0.744
69.3 0.75 0.782
69.1 0.80 0.822
68.9 0.85 0.862
68.8 0.90 0.906
68.7 0.95 0.952
68.7 0.97 0.971
68.7 1 1
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
Datos:
B.C del alimento F (Kmol) 100 moles de vapor (kmol) 40
moles de hexano ( Kmol) 40 moles del liquido
(kmol) 60
moles de benceno (kmol) 60
Punto de ebullición del hexano: 69 ªC
Punto de ebullición del benceno:80.1 ªC
Componente más volátil: hexano
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
Ecuación de aproximación:
Y=-8.3903X6 + 27.5425X5 + 34.3705X4 + 21.8688X3 - 74.88X2 + 2.83X
Con el balance global y del componente A (hexano). Encontramos la expresión de la
recta de operación, que además es también graficada.
BALANCE GLOBAL
F=L+V;
BALANCE DEL COMPONENTE A
F*XF = L*XL + V*YV ;
(L+V)*XF = L*XL + V*YV ;
-(L / V) = (XF - YV) / (XF - XL);
Con -(L / V) = -1.5
YV = -1.5*XL + 1;
Con las dos ecuaciones conocidas, (línea de operación y curva de equilibrio, las
interceptamos para encontrar los valores de las composiciones del destilado y el
residuo.
a) Composiciones y temperatura de la operación
XW=0.351;
YD=0.472;
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
b)calor necesario para la operación
Cantidad de Hexano en el destilado (D); 0,47 * 40 18,8Kmol
Cantidad de Benceno en el destilado (D); 0,53 * 40 21,2 Kmol
El calor necesario será;
Q = λH *DH + λB*DB ;
λH = 80 cal / gr
λB = 94.1 cal / gr
PMH = 86.177 gr / mol
PMB = 78.114 gr / mol
Entonces;
cal gr 10 3 mol Kmol cal gr 10 3 mol Kmol
Q 80 * 86,177 *18,8 94,1 * 78,114 * 21,2
gr mol 1Kmol h gr mol 1Kmol h
Q= 2.85 * 108 cal/h
Q=2.85*105 kcal/h
Para
100 kmol de F/h
Q= 2.85*10^3Kcal/Kmol F
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
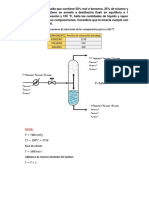
TERCER PUNTO
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
D= A
50 O.8
A
F=
B
100
B
W= A
50
O.
B
66
6
A=Tetracloruro de carbono CCl4 (Teb=77°C)
B=Tolueno (C6H5CH3) (Teb=110°C)
BC=100moles de F
XF=0.6
Relacion final:
D=0.5*F=50 moles.
W=0.5*F=50 moles.
Conocemos F y W:
Ln[F/W]=∫Xw[dx/(y
XF*-x)]
Ln[100/50]=∫Xw[dx/(y*-x)]
0.6931=∫Xw[dx/(y0.6
*-x)]
0.6
Realizamos una grafica de 1/[/(y*-x)] Vs X para hallar el valor de Xw. Comenzamos
suponiendo valores de Xw=o.6 calculando el área bajo la curva y comparando con el
criterio de parada ln[100/50]. El valor de Xw disminuirá hasta que las dos areas bajo la
curva sean iguales.
X=[0.6 0.55 0.5 0.45 0.4 0.35 0.3 0.25 0.2 0.15 0.1 0.05 0]
Y=[.784 0.748 0.708 0.665 0.618 0.565 0.506 0.442 0.369 0.29 0.202 0.107 0]
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
1 =[ 5.435 5.051 4.8077 4.6512 4.5872 4.6512 4.8544 5.2083 5.9172
7.1429 9.8039 17.5439]
(y*-x)
a) Xw=0.4602
b) Ahora para hallar Yd sabemos que:
F*Xf = D*Yd + W*Xw
100*0.6 = 50* Yd + 50*0.4602
Yd=0.7398
c) La proporcion de CCl4 que pasa al destilado seria:
D*Yd/ F*Xf
50*0.7398/100*0.6
0.6165
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
4. Una mezcla de hidrocarburos que tiene la siguiente composición molar se somete a
una destilación instantánea:
Componente Fracción molar
Etano 0,050
Propano 0,150
Isobutano 0,100
n-Butano 0,300
n- Pentano 0,400
a). Si la presión de operación es de1068,4 kPa y la temperatura de vaporización es de
90ºC, calcule la relación L/V y la composición de las fases.
Después de hacer una simulación en Hysys, el programa arrojo los siguientes datos:
Se supuso un flujo inicial de 1000 kmol/h
Características Total Fase Vapor Fase Líquida
Vapor/ Fraccion de fase 0,5504 0,5504 0,4496
Temperatura (ºC) 90 90 90
Presión (bar) 10,68 10,68 10,68
Flujo molar (kmol/h) 1000 550,4 449,6
Flujo másico (kg/h) 60230000 30930000 29300000
Entalpia (kcal/kmol) -31770000 -28430000 -35860000
Entropia (kJ/kmol ºC) 139,9 163,2 111,4
Flujo de Calor (kcal/h) -31170000000 -15650000000 -16120000000
𝐿 449,6
= = 0,8168
𝑉 550,4
b). Para una temperatura de 90ºC y recuperación en el líquido del 98% del n-Butano,
calcule la presión de operación; la relación L/V y la composición y la composición de las
fases.
Caracteristicas Total Fase Vapor Fase Líquida
Vapor/ Fraccion de fase 0,0289 0,0289 0,9711
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
Temperatura (ºC) 90 90 90
Presión (bar) 18,34 18,34 18,34
Flujo molar (kmol/h) 1000 28,94 971,1
Flujo másico (kg/h) 60230000 1359 58870000
Entalpia (kcal/kmol) -33760000 -25430000 -34010000
Entropia (kJ/kmol ºC) 116,1 166 114,6
Flujo de Calor (kcal/h) -33760000000 -73600000000 -33030000000
𝐿 971,1
= = 33,5556
𝑉 28,94
c). Si la presión de operación es de 1068,4 kPa y se recupera en el líquido el 90% del n-
Pentano, calcule la temperatura de operación; la relación L/V y la composición de las
fases.
Caracteristicas Total Fase Vapor Fase Líquida
Vapor/ Fraccion de fase 0,2514 0,2514 0,7486
Temperatura (ºC) 78,4 78,4 78,4
Presión (bar) 10,68 10,68 10,68
Flujo molar (kmol/h) 1000 251,4 748,6
Flujo másico (kg/h) 60230000 13060000 47170000
Entalpia (kcal/kmol) -33410000 -27250000 -35480000
Entropia (kJ/kmol ºC) 120,8 162,8 106,7
Flujo de Calor (kcal/h) -33410000000 -68520000000 -26560000000
𝐿 748,6
= = 2,9777
𝑉 251,4
d). Para L/V=2/3 y una temperatura de vaporización de 90ºC; calcule la presión de
operación y la composición de las fases.
Zf Presión de vapor m yd x
Etano 0,05 37500 4,69336671 0,07296856 0,01554717
Propano 0,15 30002,4 3,75499374 0,21230677 0,05653985
Isobutano 0,1 13126,05 1,64280976 0,11855571 0,07216643
n-Butano 0,3 9375,75 1,17343554 0,31885064 0,27172404
n-Pentano 0,4 3800 0,47559449 0,27757487 0,58363769
1,00025655 0,99961517
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
𝐿 400
= = 0,6667
𝑉 600
La presión de operación es: 7990 mm Hg
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
QUINTO PUNTO
Una mezcla equimolar heptano-octano entra como alimentación en un plato
intermedio de una columna de rectificación que trabaja a la presión atmosférica
normal. Se desea obtener un producto destilado que contenga 98% molar de heptano
y un producto de fondos que sólo ha de contener 5% molar de heptano.
El alimento entra a la columna a su temperatura normal de ebullición. El vapor
procedente del primer plato entra en el condensador de reflujo, que en esta columna
es un condensador total; una parte del condensado vuelve a la columna a su
temperatura de condensación y otra sale como producto destilado, de tal modo que la
relación entre el líquido que retorna y el vapor que llega (relación de reflujo) es
L/V=0.75.
Calcule el número de platos teóricos y la posición del plato de alimentación, usando el
método gráfico de McCabe-Thiele. (Los datos de equilibrio son los datos en el ejercicio
No. 1)
Para comenzar, los datos de equilibrio del sistema heptano-octano están en función de las
presiones parciales de los componentes, los cuales al pasarlos a las composiciones en el
equilibrio x e y resultan:
Datos de equilibrio Sistema Heptano-Octano
T (ºC) P7(mm Hg) P8 (mm Hg) x y
98,40 760 377 1 1
100,00 795 356 0,92027335 0,96265436
102,00 841 380 0,82429501 0,91214751
104,00 890 406 0,73140496 0,8565137
106,00 941 429 0,64648438 0,80044973
108,00 993 452 0,56931608 0,74385641
110,00 1049 479 0,49298246 0,68044552
112,00 1104 510 0,42087542 0,61137693
114,00 1165 540 0,352 0,53957895
116,00 1228 574 0,28440367 0,45953646
118,00 1296 609 0,21979622 0,37481039
120,00 1368 647 0,15672677 0,28210818
122,00 1442 687 0,09668874 0,18345417
124,00 1528 729 0,0387985 0,0780054
125,60 1593 760 0 0
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
Datos:
Presión total: 760 mm Hg
Razón de Reflujo (L/V): 0,75
Con estos datos hallamos la siguiente curva de equilibrio, con y en función de x:
1
y = 0.5066x3 - 1.5x2 + 1.993x + 0.0026
0.9
R² = 1
0.8
0.7
0.6
y 0.5
0.4
0.3
0.2
0.1
0
0 0.2 0.4 0.6 0.8 1
x
Ya que nos dicen que la temperatura del alimento ingresa a la torre de destilación a la
temperatura normal de ebullición, ésto implica que el alimento entra como vapor
saturado.
Esto nos hace deducir que q es igual a cero, información que junto con las fracciones
del componente más volátil en la corriente del alimento, del destilado y de los fondos
de la torre. Con estos datos ya es posible hallar la ecuación de la recta de alimentación
como se muestra a continuación:
xF 0,5
xD 0,98
xB 0,05
(Vapor
q 0 saturado)
Pendiente recta
alimentación 0
y=(-q/(1-q))*x+xF/(1-q) 0,5
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
Como el valor de q es cero, la recta de alimentación no tiene pendiente, es decir, es
una línea horizontal paralela al eje x que corta al eje y en el punto que indica el valor
de xF/(1-q) que en este caso es igual a 0.5.
Al intersectar esta recta con la curva de equilibrio, se hallan los valores en el equilibrio
x´ e y´, y se puede entonces hallar la relación de reflujo mínimo de la torre de
destilación, que es igual a RD=(xD-y´)/(y´-x´):
y=(-q/(1-q))*x+xF/(1-q) 0,5
Curva de equilibrio 0,5
f(x) Debe valer cero 0
x´ 0,31769848
y´ 0,5
Reflujo mínimo 2,63300049
Se puede observar que el valor mínimo de reflujo debe ser 2.633, y según los datos del
problema, se da una razón de reflujo de L/V = 0.75, a simple vista pareciera que no es
posible resolver el problema ya que el reflujo especificado es menor que el mínimo.
Sin embargo, el reflujo mínimo hallado es una relación de L/D, no de L/V, así que es
necesario hallar una expresión que permita pasar de L/V a L/D y verificar si el reflujo
específicado es mayor que el mínimo:
𝐿 𝐿
𝑅𝑣 = = = 0.75
𝑉 𝐿+𝐷
0.75𝐿 + 0.75𝐷 = 𝐿
0.25𝐿 = 0.75𝐷
𝐿
=3
𝐷
Donde
𝐿
= 𝑅𝑑
𝐷
Que es la misma forma en que está dado el reflujo mínimo, entonces:
L/V 0,75
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
L/D min 2,63300049
L/D 3
Con la relación de reflujo se puede hallar la recta de operación que va del alimento
hasta el destilado. A su vez, al hallar el punto donde entra el alimento, es posible
construir también la recta que desciende hasta la zona de agotamiento:
Relación de reflujo 3
Ecuación sección de rectificación
(Cabeza)
Pendiente 0,75
Corte con el eje x 0,245
y(x) 0,5
x 0,34
y=(-q/(1-q))*x+xF/(1-q) 0,5
f(x) Debe valer cero 0
Con estos datos ya es posible construir un diagrama donde están dibujadas la curva de
equilibrio, la curva de y=x sobre la que se encuentran las composiciones de entrada y
salida de la torre de destilación y las rectas de operación, tanto la de rectificación
como la de agotamiento.
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
Para hallar gráficamente el número de platos
Recta 1 (Rectificación) Recta 2 (Agotamiento) Recta 3 (x=y)
x y x y x y
0,34 0,5 0,34 0,5 0 0
0,98 0,98 0,05 0,05 1 1
Y se obtiene la siguiente imagen, donde se determinó gráficamente el número de
platos:
a) Numero de platos=15.
b) La posicion del plato de alimentacion es 7.
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
SEXTO PUNTO:
. Se proyecta una columna de rectificación continua para separar 20000 kg/h de una
mezcla de cloroformo-benceno cuya composición es 35% molar de cloroformo, para
suministrar un producto de cabeza de composición 97% molar de cloroformo y un
producto de fondo de composición 97% de benceno. La columna debe trabajar a la
presión atmosférica normal, y la alimentación entra a 16°C. La cabeza de la columna
va provista de un condensador total y, tanto el reflujo como el producto destilado
salen del condensador a la temperatura de condensación.
Los datos de equilibrio cloroformo-benceno a 760 mm Hg expresados en fracción
molar son:
Datos de equilibrio Sistema Cloroformo-Benceno
T (ºC) xA yA
80,6 0,00 0,0000
80,0 0,05 0,0630
79,5 0,10 0,1300
79,1 0,15 0,2006
78,3 0,20 0,2722
77,9 0,25 0,3427
77,1 0,30 0,4146
76,8 0,35 0,4848
75,9 0,40 0,5488
75,3 0,45 0,6052
74,7 0,50 0,6586
73,4 0,55 0,7102
72,9 0,60 0,7558
72,0 0,65 0,7966
71,0 0,70 0,8343
69,8 0,75 0,8707
68,8 0,80 0,9047
66,2 0,85 0,9329
64,1 0,90 0,9572
63,0 0,95 0,9794
61,4 1,00 1,0000
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
Calcule:
Datos:
Calores específicos:
Ccloroformo= 0.23 Kcal / Kg ªC
Bbenceno = 0.44 Kcal / Kg ªC
λcloroformo = 6800 Kcal/Kmol
λbenceno = 7420 Kcal/ Kmol
valor medio de la volatilidad
= 1.7
Pesos moleculares:
PM cloroformo: 119.4 Kg/Kmol
PM benceno: 78.1 Kg/Kmol
PMm=0.35*119.4 + 0.65*78.1 = 92.6 Kg/Kmol
a) Caudales y productos
Flujo de alimentación:
F=20000/92.6=216 Kmol/h
Caudales de los productos de cabeza y fondo son:
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
Balances global
216=D+W ;
216*0.35=0.97*D+0.03*W ;
216(0.35)=0.97*D+0.03(216-D) ;
75.6=0.97*D+6.48-0.03D ;
69.12 = 0.94D;
D = 73.53 Kmol/h
W=216-73.53 = 142.47 Kmol/h
Entalpía de origen=0
Calor especifico medio de la alimentación
Cpr=0.23*0.35*119.4+0.44*0.65*78.1 = 32 Kcal/Kmol ªC
Teb = 76.8 ªC
H = 32*16 = 512 Kcal/Kmol
HL = 32*76.8 = 2458 Kcal/Kmol
HV-HL = 0.35*6800+0.65*7420 = 7200 Kcal/Kmol
HV-H = 7200+HL - H =7200 + 2458 – 512 = 9145 Kcal/Kmol
Φ = (Hsat - H) / (Hsat - HL)
Φ = 9145 / 7200 = 1.27
Coeficiente angular
1.27/(1.27-1) = 4.70 (pendiente de la recta)
(y-0.35)/(x-0.35) = 4.70 ; y=4.70*x-1.29; (1)
b) Relación flujo mínimo
La intercepción de la recta (1) con la curva de equilibrio da:
(L/V)min=0.76
c) Números de platos teóricos
Gráficamente se muestra los escalones que corresponden a cada plato entre la curva de
equilibrio y la diagonal en los puntos (0.97 ,0.97) hasta que el escalón alcance la
composición inferior a 0.03.
Nmin= 12
Nmin= log { ( 00.97/0.03 )*( 0.97/0.03 ) } / log1.7 – 1 = 12
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
d)ecuaciones de la recta superior e inferior de la operación
L / V = 0.76*1.20 = 0.91
Recta superior
Y=0.91X+0.09
Para la recta inferior tenemos:
L = 73.5 / [ ( 1/0.91 ) - 1] = 742 Kmol/h
L’ = 742 + 216*1.27 = 1017 Kmol/h
Con balance de materia global
V = L + D = 742 + 73.5 = 815.5 Kmol/h
V’ = 815.5 + 216*0.27= 874 Kmol/h
Y=1.16X+0.04
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
e) numero de platos y posición de estos
N=7
A partir de la cabeza de la columna
f) consumo horario de agua de refrigeración
Con la ayuda de un balance de entalpía en la cabeza de la columna
V*HV=L*HL+D*HD+perdidas
Se desprecia el calor sensible sobre el calor latente (HL=HD)
Qcedido=V* (HV-HL) = V*λ
Qcedido=815.5(0.97*6800+0.03*7420)=5.56*106 Kcal/h
Qagua=5.56*106/(45-16)=192000 Kg/h
g) consumo horario de vapor en el fondo
qsuministrado +L’*HL=V’*HV+W*HW
se desprecia los efectos del calor sensible sobre el calor latente (HL=HW)
L’=V’+W
Qsuministrado = V’*(HV’-HL’) = V’*λ’
Qsuministrado = 874(0.03*6800+0.97*7420) = 6.47*106 Kcal/h
Consumo de vapor
Qvapor = 6.47*106 / 532 = 12160 Kcal/h
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
ESCUELA DE INGENIERIA QUIMICA
Ciudad universitaria, Carrera 27 - calle 9.
E-mail: http://www.uis.edu.co
Das könnte Ihnen auch gefallen
- Problemas resueltos de Hidráulica de CanalesVon EverandProblemas resueltos de Hidráulica de CanalesBewertung: 4.5 von 5 Sternen4.5/5 (7)
- Vocabulario Sobre Redes Sociales PDFDokument41 SeitenVocabulario Sobre Redes Sociales PDFCarmen Julia GantierNoch keine Bewertungen
- OPERACIONES UNITARIAS en Los Procesos Industriales PDFDokument43 SeitenOPERACIONES UNITARIAS en Los Procesos Industriales PDFDaniel GarabitoNoch keine Bewertungen
- Guia Practicas Laboratorio - Biotecnologia - 305689 PDFDokument26 SeitenGuia Practicas Laboratorio - Biotecnologia - 305689 PDFMaurico CardonaNoch keine Bewertungen
- Columnas de Rectificacion 23Dokument25 SeitenColumnas de Rectificacion 23Rodrigo Salinas HuamancondorNoch keine Bewertungen
- Secado Continuo PDFDokument17 SeitenSecado Continuo PDFMaykol LamedaNoch keine Bewertungen
- Astm A TBP Con Su AplicacionDokument5 SeitenAstm A TBP Con Su AplicacionjahirczNoch keine Bewertungen
- Problema Ponchon 1Dokument4 SeitenProblema Ponchon 1Rene Gabriel LinaresNoch keine Bewertungen
- Pruebas de HipotesisDokument53 SeitenPruebas de HipotesisCarolina Bautista CamasiNoch keine Bewertungen
- Practica Nº4Dokument17 SeitenPractica Nº4John Hernan HidalgoNoch keine Bewertungen
- Flujo TaponDokument8 SeitenFlujo TaponCristhian AymaNoch keine Bewertungen
- Destilacion TrabajoDokument24 SeitenDestilacion TrabajololaNoch keine Bewertungen
- Ejercicios de DiseñoDokument3 SeitenEjercicios de DiseñoJefferson LazBacNoch keine Bewertungen
- Cuarta Asignación Control de Procesos 2021 - IIDokument7 SeitenCuarta Asignación Control de Procesos 2021 - IIBrayanNoch keine Bewertungen
- Termo Electroestatico1Dokument46 SeitenTermo Electroestatico1aristi51100% (1)
- Reservorios II Equilibrio de Fases Liquido VaporDokument67 SeitenReservorios II Equilibrio de Fases Liquido VaporWilliam Flores100% (1)
- PS 1-2008 2do ParcialDokument2 SeitenPS 1-2008 2do ParcialRosmaryan GuzmanNoch keine Bewertungen
- 2 2 Fugacidad y Coeficiente de FugacidadDokument3 Seiten2 2 Fugacidad y Coeficiente de FugacidadLeoNoch keine Bewertungen
- EJERCICIO ASPEN HYSYS para MasasDokument7 SeitenEJERCICIO ASPEN HYSYS para MasasAlonso Palacios GómezNoch keine Bewertungen
- PonchonDokument9 SeitenPonchonlrpln.mc100% (3)
- Tarea John GeankoplisDokument12 SeitenTarea John GeankoplisAbraham EdwinNoch keine Bewertungen
- Lección 1 Material de ApoyoDokument15 SeitenLección 1 Material de ApoyoMoises QuispeNoch keine Bewertungen
- Talller Dest y Secado 2019ADokument6 SeitenTalller Dest y Secado 2019AFrancisco OrozcoNoch keine Bewertungen
- Proyecto Termo FinalDokument37 SeitenProyecto Termo Finaltadeitobello50% (2)
- Ecuaciones de Estado y Factores CruzadosDokument21 SeitenEcuaciones de Estado y Factores CruzadosJosé Luis LMNoch keine Bewertungen
- Informe Práctica 5 Laboratorio de Operaciones Unitarias 1. LUZDokument17 SeitenInforme Práctica 5 Laboratorio de Operaciones Unitarias 1. LUZChibi MimiNoch keine Bewertungen
- Atomic Clase 1Dokument12 SeitenAtomic Clase 1JuanNoch keine Bewertungen
- Ejercicio II-problemas A ResolverDokument11 SeitenEjercicio II-problemas A ResolverMaria Fernanda Sanchez LopezNoch keine Bewertungen
- Diseño de EvaporadorDokument28 SeitenDiseño de EvaporadorBermudez Felipe50% (2)
- Problemas CursoDokument12 SeitenProblemas CursoDhrusAlvarezDominguezNoch keine Bewertungen
- EL METODO DE PONCHON y SAVARITDokument39 SeitenEL METODO DE PONCHON y SAVARITnicolasprofecolecrisNoch keine Bewertungen
- Práctica 3 Funcionamiento de Un Reactor de Mezcla Completa en Estado Estacionario (CSTR)Dokument4 SeitenPráctica 3 Funcionamiento de Un Reactor de Mezcla Completa en Estado Estacionario (CSTR)Ahn Edwin GjNoch keine Bewertungen
- Calculo y Diseño de Un AbsorbedorDokument5 SeitenCalculo y Diseño de Un AbsorbedorSantajmnzNoch keine Bewertungen
- Determinar El Diámetro de Un DepropanizadorDokument3 SeitenDeterminar El Diámetro de Un DepropanizadorRodrigo Salgueiro LlanosNoch keine Bewertungen
- Ejercicio de BMDokument7 SeitenEjercicio de BMJorge Torrico VasquezNoch keine Bewertungen
- Problema 7.1Dokument8 SeitenProblema 7.1Lalommoreno Moreno OvandoNoch keine Bewertungen
- Proyecto de Mecanica de FluidoDokument24 SeitenProyecto de Mecanica de FluidoJesús MorenoNoch keine Bewertungen
- Transferencia de MasaDokument5 SeitenTransferencia de MasaELIZABETHNoch keine Bewertungen
- Diseño de Columna Destilación Multicomponente Por Método RigurosoDokument11 SeitenDiseño de Columna Destilación Multicomponente Por Método RigurosoLeëonardo JvierrNoch keine Bewertungen
- Guia Derivadas Parciales de Orden SuperiorDokument13 SeitenGuia Derivadas Parciales de Orden SuperiorEddy Johanna Martinez Roa0% (1)
- Sintesis Del MetanolDokument2 SeitenSintesis Del MetanolJose Maria Herrera SaraviaNoch keine Bewertungen
- Simulacion en Aspen HysysDokument48 SeitenSimulacion en Aspen HysysBreky Mdz MjaNoch keine Bewertungen
- CH7 8Dokument108 SeitenCH7 8IsabelNoch keine Bewertungen
- 10 11treybalDokument18 Seiten10 11treybalKami JaraNoch keine Bewertungen
- Determinacion de La AeptDokument13 SeitenDeterminacion de La AeptJavier JulianNoch keine Bewertungen
- Destilación Al Vacío I y IiDokument35 SeitenDestilación Al Vacío I y IiLIBIO ESTEPANoch keine Bewertungen
- Proyecto LEM V Naranja BienDokument3 SeitenProyecto LEM V Naranja BienOscar Andrade Avila100% (1)
- Ocon y Tojo Evaporador SimpleDokument8 SeitenOcon y Tojo Evaporador SimpleQuetzalliNoch keine Bewertungen
- Destilacion Flash Con DatosDokument3 SeitenDestilacion Flash Con DatosHumberto Morales CorderoNoch keine Bewertungen
- Pract Ope 3Dokument7 SeitenPract Ope 3Salem Paco San MiguelNoch keine Bewertungen
- Evaporadores de Simple EfectoDokument7 SeitenEvaporadores de Simple Efecto3F3CT1V00Noch keine Bewertungen
- Destilacion - Trabajo Final Opus IDokument20 SeitenDestilacion - Trabajo Final Opus IlolaNoch keine Bewertungen
- Final Diseã oDokument9 SeitenFinal Diseã oLEONARDO V�CTOR EUGENIO PACHAS QUISPENoch keine Bewertungen
- Casos Especiales Del McCabe ThieleDokument13 SeitenCasos Especiales Del McCabe ThieleAlicia AvilaNoch keine Bewertungen
- Humidificación DeshumidificaciónDokument13 SeitenHumidificación DeshumidificaciónMarienny HerreraNoch keine Bewertungen
- Método de MccabeDokument7 SeitenMétodo de MccabeJosé Pedro Alcón LauraNoch keine Bewertungen
- Absorcion No IsotermicaDokument6 SeitenAbsorcion No IsotermicaNatalia Moreno MorenoNoch keine Bewertungen
- Diagrama Líquido Vapor Ecuación Wilson MatlabDokument5 SeitenDiagrama Líquido Vapor Ecuación Wilson Matlabaruazul100% (1)
- Diseño ReacDokument10 SeitenDiseño ReacivanNoch keine Bewertungen
- Destilacion DiferencialDokument12 SeitenDestilacion DiferencialaddaNoch keine Bewertungen
- Conversión de CurvasDokument15 SeitenConversión de CurvasGustavo Javier Pérez ContrerasNoch keine Bewertungen
- G01 TermodimanicaDokument12 SeitenG01 TermodimanicarobertNoch keine Bewertungen
- Equlibrio de Vapor Liquido (Evl) en Sistema Binario de Hexano y PentanoDokument7 SeitenEqulibrio de Vapor Liquido (Evl) en Sistema Binario de Hexano y PentanoLeonardo Condori MamaniNoch keine Bewertungen
- Asignación Destilación FINALDokument34 SeitenAsignación Destilación FINALJAMIT GUZMAN MARTINEZNoch keine Bewertungen
- Desti Laci On 2010Dokument6 SeitenDesti Laci On 2010lolaNoch keine Bewertungen
- FlashDokument6 SeitenFlashlolaNoch keine Bewertungen
- Previo de Destilación 7 de La NocheDokument9 SeitenPrevio de Destilación 7 de La NochelolaNoch keine Bewertungen
- FlashDokument7 SeitenFlashlolaNoch keine Bewertungen
- Opus IDokument8 SeitenOpus IlolaNoch keine Bewertungen
- DESTILACION4Dokument8 SeitenDESTILACION4lolaNoch keine Bewertungen
- Destilacion - Trabajo Final Opus IDokument20 SeitenDestilacion - Trabajo Final Opus IlolaNoch keine Bewertungen
- Punto 1 y 4 para Copiar y PegarDokument2 SeitenPunto 1 y 4 para Copiar y PegarlolaNoch keine Bewertungen
- Primerpuntodest (1) 1Dokument2 SeitenPrimerpuntodest (1) 1lolaNoch keine Bewertungen
- Viernes 2Dokument1 SeiteViernes 2lolaNoch keine Bewertungen
- Solucion Quiz 3Dokument13 SeitenSolucion Quiz 3lolaNoch keine Bewertungen
- Introduccion Al Analisis de Regresion Lineal Tercera Edicion Montgomery Peck ViningDokument6 SeitenIntroduccion Al Analisis de Regresion Lineal Tercera Edicion Montgomery Peck ViningMelissa UribeNoch keine Bewertungen
- DESTILACIÓNDokument5 SeitenDESTILACIÓNlolaNoch keine Bewertungen
- DESTILACION4Dokument8 SeitenDESTILACION4lolaNoch keine Bewertungen
- 3 AsignacionDokument7 Seiten3 AsignacionlolaNoch keine Bewertungen
- Destilacion MarianDokument27 SeitenDestilacion MarianlolaNoch keine Bewertungen
- CuartoDokument6 SeitenCuartololaNoch keine Bewertungen
- Desarrollo de Los Ejemplos Del Libro Rober E2ultimoDokument17 SeitenDesarrollo de Los Ejemplos Del Libro Rober E2ultimololaNoch keine Bewertungen
- Asignacion Destilacion YeniDokument17 SeitenAsignacion Destilacion YenilolaNoch keine Bewertungen
- 2 DestiDokument3 Seiten2 DestilolaNoch keine Bewertungen
- 1 PBDokument26 Seiten1 PBlolaNoch keine Bewertungen
- 3 AsignacionDokument2 Seiten3 AsignacionlolaNoch keine Bewertungen
- Lab 2 (19-I)Dokument7 SeitenLab 2 (19-I)Walther JesusNoch keine Bewertungen
- Resumen Sobre La Norma de Buenas Practicas de LaboratorioDokument5 SeitenResumen Sobre La Norma de Buenas Practicas de LaboratorioDavid SanabriaNoch keine Bewertungen
- Martín Felipe Castagnet - El Viaje de La Ciencia Ficción Argentina A Los Confines Del Espacio InteriorDokument10 SeitenMartín Felipe Castagnet - El Viaje de La Ciencia Ficción Argentina A Los Confines Del Espacio InteriorEmilia Macchi100% (1)
- Partes de La Ventana de WordDokument10 SeitenPartes de La Ventana de WordKennyRamirezNoch keine Bewertungen
- N-103-1001 1ra Ed. Seguridad en Construccion de Planta Externa (WVP)Dokument38 SeitenN-103-1001 1ra Ed. Seguridad en Construccion de Planta Externa (WVP)MiguelAngelCusipumaVillanuevaNoch keine Bewertungen
- FLASHMOBS: LA TRANSFORMACIÓN DE LA DRAMATURGIA A TRAVÉS DE LAS REDES SOCIALES Isabel MarcillasDokument14 SeitenFLASHMOBS: LA TRANSFORMACIÓN DE LA DRAMATURGIA A TRAVÉS DE LAS REDES SOCIALES Isabel MarcillasCompaXbalamQueNoch keine Bewertungen
- Mine CraftDokument15 SeitenMine Craftppnacho99Noch keine Bewertungen
- Semana 13 - Capítulo 10 - Lectura - Norma ISO 9001 - 2015Dokument2 SeitenSemana 13 - Capítulo 10 - Lectura - Norma ISO 9001 - 2015UnknownConNoch keine Bewertungen
- SINU-151 Unidad05 Material ReforzamientoDokument2 SeitenSINU-151 Unidad05 Material ReforzamientoAlex FloresNoch keine Bewertungen
- Componentes Del Diseño de Instrucción.Dokument54 SeitenComponentes Del Diseño de Instrucción.Francis Gil PerezNoch keine Bewertungen
- Microcontroladores Equipo 5Dokument29 SeitenMicrocontroladores Equipo 5isma_nikeNoch keine Bewertungen
- 02 Permiso Viaje1Dokument4 Seiten02 Permiso Viaje1Yanella Smith Arevalo GonzalesNoch keine Bewertungen
- Sugerencias para IntervenciónDokument2 SeitenSugerencias para IntervenciónuueeooNoch keine Bewertungen
- Rúbrica para Evaluar Árbol de Problemas PDFDokument1 SeiteRúbrica para Evaluar Árbol de Problemas PDFYheyson Marco E ANoch keine Bewertungen
- Seguridad Informatica IDokument8 SeitenSeguridad Informatica IAlexander BaldecNoch keine Bewertungen
- JonascatalogoDokument110 SeitenJonascatalogoalvaro chavezNoch keine Bewertungen
- Ejercicios 7 y 8Dokument2 SeitenEjercicios 7 y 8OMAR ELIOT PINEDA CHOQUENoch keine Bewertungen
- Plan Empresarial de Respuesta A EmergenciasDokument50 SeitenPlan Empresarial de Respuesta A EmergenciasJohn Fernando Bueno CorredorNoch keine Bewertungen
- Logica Predicados V1Dokument46 SeitenLogica Predicados V1Ricardo CisnerosNoch keine Bewertungen
- ProbabilidadDokument32 SeitenProbabilidadMiguel Pacheco PalominoNoch keine Bewertungen
- Guia Reparacion de Motores de Combustion InternaDokument58 SeitenGuia Reparacion de Motores de Combustion InternaAlfredo Quispe Alvaro0% (1)
- Medios PublicDokument8 SeitenMedios PublicKarla Alejandra Morales BriceñoNoch keine Bewertungen
- CAPITULO III - Placas Al CarbonoDokument8 SeitenCAPITULO III - Placas Al CarbonoJonathan Vasquez LNoch keine Bewertungen
- Metrados y Presupuestos de ObraDokument34 SeitenMetrados y Presupuestos de ObraGiancarlo AlarconNoch keine Bewertungen
- Unidad 3Dokument6 SeitenUnidad 3Ixchel MoctezumaNoch keine Bewertungen
- Informe de Logica DifusaDokument7 SeitenInforme de Logica DifusaAnonymous 9oRLz4VOG100% (1)