Beruflich Dokumente
Kultur Dokumente
Proceso Haber Bosch
Hochgeladen von
Miranda Roberta Pardo0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
309 Ansichten2 SeitenProceso Haber. Síntesis del amoniaco
Copyright
© © All Rights Reserved
Verfügbare Formate
DOCX, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenProceso Haber. Síntesis del amoniaco
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
309 Ansichten2 SeitenProceso Haber Bosch
Hochgeladen von
Miranda Roberta PardoProceso Haber. Síntesis del amoniaco
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 2
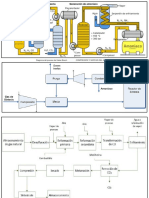
Proceso Haber-Bosch
El amoníaco es un compuesto químico cuya molécula está compuesta por un
átomo de nitrógeno (N) y tres átomos de hidrógeno (H) y cuya fórmula química es
NH3.
Propiedades físico químicas del amoníaco
Gas incoloro en condiciones normales
Temperatura de solidificación –77,7ºC
Temperatura normal de ebullición –33,4ºC
Calor latente de vaporización a 0ºC 302 kcal/kg
Presión de vapor a 0ºC 4,1 atm.
Temperatura crítica 132,4ºC
Presión crítica 113atm.
Densidad del gas (0ºC y 1atm.) 0,7714 g/l
La síntesis del amoniaco
𝑁2 (𝑔) + 3𝐻2 (𝑔) ⇄ 2𝑁𝐻3 (𝑔) ∆𝐻° = −92.4𝑘𝐽/𝑚𝑜𝑙
El nitrógeno es el gas más abundante de la atmósfera, alcanzando un porcentaje
de casi el 80 %, pero no son habituales sus compuestos en la corteza terrestre. La
reactividad del nitrógeno es mínima pero la de sus compuestos tiene gran
importancia biológica e industrial.
En 1908, el químico alemán Fritz Haber ideó el proceso de síntesis de amoniaco a
partir de sus elementos. Años después el ingeniero alemán Carl Bosch desarrolló y
diseñó el proceso industrial. Este método permitió emplear gas amoniaco en la
fabricación de abonos artificiales, que tanta influencia habrían de tener en el
desarrollo de la agricultura en todo el mundo. Las condiciones en las que se
produce esta síntesis se describen a continuación:
Altas presiones, superiores a 300 atmósferas
Elevadas temperaturas, entre 400 y 500ºC
Uso de catalizadores férricos u óxidos de aluminio
El nitrógeno se suministra en grandes cantidades, y se obtiene por destilación
fraccionada del aire licuado. El hidrógeno se obtiene haciendo reaccionar vapor de
agua con metano. En estas condiciones, alrededor del 30 % de los reactivos se
transforman en amoniaco. Los gases calientes de la cámara de reacción se enfrían
Nancy del Carmen Hernández García | Diseño de Proceso en Ing. Química I 1
para licuar y retirar el amoniaco. De esta manera, se separan el nitrógeno y el
hidrógeno que no han reaccionado y se reciclan.
Si observamos la reacción química, deducimos que, efectivamente, un exceso de
reactivo, la retirada continua de producto y un aumento de la presión conduce a
una mayor producción de amoniaco. Sin embargo, se trata de una reacción
exotérmica, por lo que las temperaturas altas favorecen el proceso inverso, de
disociación del amoniaco. Aunque las temperaturas elevadas no favorecen la
obtención de amoniaco, su uso se justifica por el considerable aumento de la
velocidad que provocan (junto con el uso de catalizadores adecuados). Se enfrentan
los factores termodinámicos a los cinéticos, y éstos últimos son los que determinan
la viabilidad del proceso.
El nitrógeno y el hidrógeno se inyectan continuamente en el reactor para favorecer
la formación de amoniaco. Además, aprovechando la solubilidad del amoniaco en
agua, se va eliminando de la mezcla gaseosa al disolverlo en una lluvia de agua
pulverizada, con lo que el equilibrio se desplaza para producir más amoniaco. Esta
forma de trabajar se denomina en régimen continuo.
Con estas condiciones se consigue un grado de conversión del 50% en un tiempo
razonablemente corto: se ha conseguido optimizar el proceso y que la producción
de amoniaco sea máxima en un tiempo determinado. Además, el nitrógeno y el
hidrógeno que no se han convertido en amoniaco se reciclan, volviéndose a inyectar
en el reactor.
Bibliografía
Castaños, E. (25 de Junio de 2015). La síntesis del amoniaco: El proceso de Haber-Bosch.
Obtenido de https://lidiaconlaquimica.wordpress.com/2015/06/25/la-sintesis-del-
amoniaco-el-proceso-de-haber/
Quimitube. (14 de Octubre de 2012). Producción industrial de amoniaco: el Principio de Le
Chatelier en acción . Obtenido de http://www.quimitube.com/produccion-industrial-
amoniaco-sintesis-de-haber-principio-le-chatelier
Nancy del Carmen Hernández García | Diseño de Proceso en Ing. Química I 2
Das könnte Ihnen auch gefallen
- Diagrama Del Proceso de HaberDokument4 SeitenDiagrama Del Proceso de HaberEdith Garcia0% (1)
- Pr-Tal-006 Procedimiento de Fabricacion de Spools de Tuberias AereasDokument21 SeitenPr-Tal-006 Procedimiento de Fabricacion de Spools de Tuberias AereasFrancisco Imaz100% (1)
- Mala Praxis en PsicologíaDokument8 SeitenMala Praxis en Psicologíapablo salazarNoch keine Bewertungen
- Como Realizar Un Examen Proctologico.Dokument2 SeitenComo Realizar Un Examen Proctologico.sheylliciousp100% (1)
- Tríptico - VibracionesDokument2 SeitenTríptico - VibracionesRocio Merino100% (3)
- Diseño Del Biorreactor - VinagreDokument35 SeitenDiseño Del Biorreactor - VinagreNasha AlvisNoch keine Bewertungen
- Vdocuments - MX Destilacion Binaria Por El Metodo Ponchon SavaritDokument139 SeitenVdocuments - MX Destilacion Binaria Por El Metodo Ponchon SavaritVíctor Javier Cruz Martinez100% (1)
- Formato de Evaluacion de PRMsDokument4 SeitenFormato de Evaluacion de PRMsmariaNoch keine Bewertungen
- Proyecto Final Química Bastian Madrid Cortes 2020Dokument12 SeitenProyecto Final Química Bastian Madrid Cortes 2020bastian madridNoch keine Bewertungen
- Endoscopia de ColumnaDokument31 SeitenEndoscopia de ColumnaTOMASNOEL5100% (2)
- Práctica #10 Diagrama Ternario. AbcDokument8 SeitenPráctica #10 Diagrama Ternario. AbcPierre LlerenaNoch keine Bewertungen
- Absorción Gaseosa-Agua CarbonatadaDokument6 SeitenAbsorción Gaseosa-Agua CarbonatadaMaigle Karina Guadama LopezNoch keine Bewertungen
- Diagrama Ternario Informe LaboDokument14 SeitenDiagrama Ternario Informe LaboIz RemyNoch keine Bewertungen
- Diapositiva 4 CSTR SeguridadDokument56 SeitenDiapositiva 4 CSTR SeguridadDENIS LEYVANoch keine Bewertungen
- Reporte Práctica 3-Síntesis de Acetato de IsoamiloDokument7 SeitenReporte Práctica 3-Síntesis de Acetato de IsoamiloAndy AldamaNoch keine Bewertungen
- Mapa Conceptual Mamiferos.1Dokument1 SeiteMapa Conceptual Mamiferos.1Ale Camargo67% (9)
- Cinetica Química AplicadaDokument92 SeitenCinetica Química AplicadaCarlos DoradoNoch keine Bewertungen
- Calculo Del Factor de Efectividad InternoDokument7 SeitenCalculo Del Factor de Efectividad InternoDiego Alejandro Montoya RamirezNoch keine Bewertungen
- La Energia de Gibbs en ExcesoDokument19 SeitenLa Energia de Gibbs en ExcesoSair Andres Ortiz DiazNoch keine Bewertungen
- PRACTICA - ADSORCIÓN - FisicoquimicaDokument16 SeitenPRACTICA - ADSORCIÓN - FisicoquimicaRodrigo Santiago CENoch keine Bewertungen
- Solucionario Cuestionario Destilación.RDokument4 SeitenSolucionario Cuestionario Destilación.Rdaniel arturoNoch keine Bewertungen
- Preparacion de Un Compuesto de Boro A Partir de Borax 1 1Dokument4 SeitenPreparacion de Un Compuesto de Boro A Partir de Borax 1 1Daniela AlejandroNoch keine Bewertungen
- Informe Pistones..Primera ParteDokument7 SeitenInforme Pistones..Primera ParteCleyby DavilaNoch keine Bewertungen
- Proceso Haber - BoschDokument10 SeitenProceso Haber - Boschanon_89788497100% (1)
- LAB1 - Determinacion de Naturaleza Quimica de Fibra Mediante Prueba de CombustionDokument6 SeitenLAB1 - Determinacion de Naturaleza Quimica de Fibra Mediante Prueba de CombustionRenzo SolorzanoNoch keine Bewertungen
- Gráfica Ley de HenryDokument1 SeiteGráfica Ley de Henrypaula avilaNoch keine Bewertungen
- Medición de Densidades y Pesos Moleculares de VaporesDokument2 SeitenMedición de Densidades y Pesos Moleculares de Vaporesrlh2022Noch keine Bewertungen
- Simunlacion ChemcadDokument16 SeitenSimunlacion ChemcadAxel AbarcaNoch keine Bewertungen
- Determinación Del Peso Molecular Mediante Viscosímetro OtswaldDokument7 SeitenDeterminación Del Peso Molecular Mediante Viscosímetro OtswaldFabricio Puma SerranoNoch keine Bewertungen
- P4 AspirinaDokument20 SeitenP4 AspirinaAndrea LemusNoch keine Bewertungen
- Planta de Producción de AcetonaDokument19 SeitenPlanta de Producción de AcetonaSebastián BaenaNoch keine Bewertungen
- Diseño de Un Reactor Químico para La Fabricación de JabónDokument5 SeitenDiseño de Un Reactor Químico para La Fabricación de JabónRaul Andres Giler VelizNoch keine Bewertungen
- Informe Secado Directo Grupo 2Dokument7 SeitenInforme Secado Directo Grupo 2Carlos Vargas de MontoyaNoch keine Bewertungen
- INFORME 1. Porfirinas y MetaloporfirinasDokument10 SeitenINFORME 1. Porfirinas y MetaloporfirinasAnggie412100% (1)
- Chemcad 6Dokument10 SeitenChemcad 6Rocio Guadalupe Ortega SanchezNoch keine Bewertungen
- Pec 1 Inorganica ExperimentacionDokument5 SeitenPec 1 Inorganica ExperimentacionAlberto RodríguezNoch keine Bewertungen
- Ejercicio D2 WankaDokument4 SeitenEjercicio D2 WankaJenisser Avalos VasquezNoch keine Bewertungen
- Procesos Quimicos Industriales Tercer ExamenDokument3 SeitenProcesos Quimicos Industriales Tercer ExamenCristhianw QcNoch keine Bewertungen
- Composición Elemental P.pastorisDokument99 SeitenComposición Elemental P.pastorisDenize JozzNoch keine Bewertungen
- Propiedades Parciales MolaresDokument9 SeitenPropiedades Parciales MolaresIvanGonzalezNoch keine Bewertungen
- Problemas Del Cap. 2 - LevenspielDokument7 SeitenProblemas Del Cap. 2 - LevenspielEmilio Tafur EspinozaNoch keine Bewertungen
- P. Lab. 03 - Determinación de GammaDokument11 SeitenP. Lab. 03 - Determinación de GammaLUIS ALBERTO PEREZ GARCIA100% (1)
- Lab Analisis 2 Determinación Del Error Relativo de La ConcentraciónDokument9 SeitenLab Analisis 2 Determinación Del Error Relativo de La Concentraciónjamop7Noch keine Bewertungen
- Práctica 11 - Destilación DiferencialDokument9 SeitenPráctica 11 - Destilación DiferencialGracieladeLeónNoch keine Bewertungen
- KC KP Ky: Atm Atm - L. SDokument4 SeitenKC KP Ky: Atm Atm - L. SMei CelisNoch keine Bewertungen
- Cálculo de Un Intercambiador de Tubo y CorazaDokument10 SeitenCálculo de Un Intercambiador de Tubo y CorazaAlvaro MathisonNoch keine Bewertungen
- Azeotropo PDFDokument7 SeitenAzeotropo PDFAngel Pablo Morales100% (1)
- El Proceso Cativa para La Producción de Ácido AcéticoDokument14 SeitenEl Proceso Cativa para La Producción de Ácido AcéticoPedro Juan100% (1)
- Ejercicios Reacciones 2019-2020Dokument1 SeiteEjercicios Reacciones 2019-2020Carolina AyoviNoch keine Bewertungen
- Práctica 7. Estudio de La Cinetica de Yodacion de La Acetona PDFDokument4 SeitenPráctica 7. Estudio de La Cinetica de Yodacion de La Acetona PDFCristian ArámbulaNoch keine Bewertungen
- Cap1 Smith EspanolDokument17 SeitenCap1 Smith EspanolErin Ford100% (1)
- kg m3 con μ kg m3 con μ m m m V ρ V ρ V V V ρ V ρ Donde tendriamos que X representariala fraccion molar X V V X V V ; X V VDokument1 Seitekg m3 con μ kg m3 con μ m m m V ρ V ρ V V V ρ V ρ Donde tendriamos que X representariala fraccion molar X V V X V V ; X V VWences RqtNoch keine Bewertungen
- Equilibrio Líquido-Vapor Del Sistema Binario N-Hexano-EtanolDokument9 SeitenEquilibrio Líquido-Vapor Del Sistema Binario N-Hexano-EtanolMiliana MorgadoNoch keine Bewertungen
- Diagrama de Produccion de AmoniacoDokument8 SeitenDiagrama de Produccion de AmoniacoSoraya Ochoa VillamizarNoch keine Bewertungen
- Calor de Reacción y Trabajo EléctricoDokument8 SeitenCalor de Reacción y Trabajo EléctricoMoises CajiaNoch keine Bewertungen
- Tarea No.5 Isotermas de Langmuir y BETDokument6 SeitenTarea No.5 Isotermas de Langmuir y BETJulia Muñoz100% (1)
- Guia de Ejercicios de Cinetica Química (Ceing 2021)Dokument8 SeitenGuia de Ejercicios de Cinetica Química (Ceing 2021)jose jimenezNoch keine Bewertungen
- Practica N°3 Color-HarinasDokument10 SeitenPractica N°3 Color-HarinasMarcelo Alvarez GagliardiNoch keine Bewertungen
- Determinación Del Peso Molecular de Los Polímeros Mediante El Método ViscosimétricoDokument13 SeitenDeterminación Del Peso Molecular de Los Polímeros Mediante El Método ViscosimétricoElias Arenas Pancca80% (10)
- Porceos de Separación I Tarea AbsorciónDokument5 SeitenPorceos de Separación I Tarea AbsorciónMARCO ANTONIO FLORES BRISENONoch keine Bewertungen
- 7-Tipos de DestilaciónDokument11 Seiten7-Tipos de DestilaciónesmeraldaNoch keine Bewertungen
- 6 INFORME - Calor de Combustión...Dokument17 Seiten6 INFORME - Calor de Combustión...Anderson Alejandro Benites ZelayaNoch keine Bewertungen
- Simulación de La Planta de MTBEDokument9 SeitenSimulación de La Planta de MTBEJennia Jimenez VargasNoch keine Bewertungen
- Fabricacion de Acido Acetico Por Carbonilacion de Metanol Proceso Cativa 2Dokument34 SeitenFabricacion de Acido Acetico Por Carbonilacion de Metanol Proceso Cativa 2Antony Hernandez PereiraNoch keine Bewertungen
- Práctica 2. Fermentación AlcohólicaDokument3 SeitenPráctica 2. Fermentación Alcohólicaagustin zarate cruzNoch keine Bewertungen
- Balance de Materia 2019-IDokument18 SeitenBalance de Materia 2019-IYesi0% (2)
- Sintesis Del AmoniacoDokument9 SeitenSintesis Del AmoniacoRocio VenegasNoch keine Bewertungen
- Problemas. Procesos de SeparacionDokument10 SeitenProblemas. Procesos de SeparacionMiranda Roberta PardoNoch keine Bewertungen
- Coeficiente Global de Transferencia de CalorDokument4 SeitenCoeficiente Global de Transferencia de CalorMiranda Roberta PardoNoch keine Bewertungen
- Conducción SimpleDokument4 SeitenConducción SimpleMiranda Roberta PardoNoch keine Bewertungen
- Transferencia de CalorDokument4 SeitenTransferencia de CalorMiranda Roberta Pardo0% (1)
- Tarea No2conduccion PsimpleDokument1 SeiteTarea No2conduccion PsimpleMiranda Roberta PardoNoch keine Bewertungen
- DFP de Monocloro BencenoDokument1 SeiteDFP de Monocloro BencenoMiranda Roberta PardoNoch keine Bewertungen
- Intercambiadores de CalorDokument6 SeitenIntercambiadores de CalorMiranda Roberta PardoNoch keine Bewertungen
- Tenango OrigenDokument1 SeiteTenango OrigenMiranda Roberta PardoNoch keine Bewertungen
- Coefiente Global de Transferencia de Calor - Radio Crítico de AislamientoDokument4 SeitenCoefiente Global de Transferencia de Calor - Radio Crítico de AislamientoMiranda Roberta PardoNoch keine Bewertungen
- Industria Química en México PDFDokument16 SeitenIndustria Química en México PDFMiranda Roberta PardoNoch keine Bewertungen
- Nom 177 Bioeq FinalDokument41 SeitenNom 177 Bioeq FinalDarla SanchezNoch keine Bewertungen
- VUMI Anexo de Cobertura Adicional Travel VIP Light0Dokument1 SeiteVUMI Anexo de Cobertura Adicional Travel VIP Light0lourdesseguros1318Noch keine Bewertungen
- Analisis Bromatologico de FrutasDokument14 SeitenAnalisis Bromatologico de Frutasolivera100% (1)
- Especificacion Tecnica Productos JormenDokument44 SeitenEspecificacion Tecnica Productos JormenNestor Lopez VargasNoch keine Bewertungen
- Proteccion RadiologicaDokument152 SeitenProteccion RadiologicavladimirNoch keine Bewertungen
- NUTRICION Clase 4 TerminadoDokument7 SeitenNUTRICION Clase 4 TerminadoANMI Al FinNoch keine Bewertungen
- Microencapsulación de Aceites Esenciales para Su Aplicación Como Aditivo en Nutrición AvícolaDokument1 SeiteMicroencapsulación de Aceites Esenciales para Su Aplicación Como Aditivo en Nutrición AvícolaLuis Miguel Perez SolisNoch keine Bewertungen
- ViscoDokument3 SeitenViscoRUDDYNoch keine Bewertungen
- Trabajo Final Escrito Sobre Los Fundamentos Del CurriculumDokument5 SeitenTrabajo Final Escrito Sobre Los Fundamentos Del Curriculumclaudia montesNoch keine Bewertungen
- Artropofauna de La Necromasa E. GrandifloraDokument10 SeitenArtropofauna de La Necromasa E. GrandifloraOscar ZarateNoch keine Bewertungen
- Ejercicio Simulacro de Examen Planilla Corralon - 1Dokument75 SeitenEjercicio Simulacro de Examen Planilla Corralon - 1Marisol AlegreNoch keine Bewertungen
- Primer Examen Modulo 1Dokument6 SeitenPrimer Examen Modulo 1Ronald SanchezNoch keine Bewertungen
- Impugnación Sentencia Procesal ConstitucionalDokument15 SeitenImpugnación Sentencia Procesal ConstitucionalAndré Fabrizio Alcocer BecerraNoch keine Bewertungen
- Microbiología - Wikipedia, La Enciclopedia LibreDokument7 SeitenMicrobiología - Wikipedia, La Enciclopedia LibreReyna MalpasoNoch keine Bewertungen
- Modulo Entrega de ResultadosDokument36 SeitenModulo Entrega de Resultadossara camila pulgarin acevedoNoch keine Bewertungen
- "Influencia de La Humedad Del Aire en LosDokument142 Seiten"Influencia de La Humedad Del Aire en LosEduardoPulidoNoch keine Bewertungen
- Taller SST FISICA 2Dokument3 SeitenTaller SST FISICA 2Laura Balaguera0% (1)
- Manual Salud Bucal 2007 2008Dokument56 SeitenManual Salud Bucal 2007 2008Jeannette Elizabeth Lastra DiazNoch keine Bewertungen
- Cuestionario IVADokument9 SeitenCuestionario IVAMilan JscNoch keine Bewertungen
- Microbiología Primer ParcialDokument353 SeitenMicrobiología Primer ParcialNatySarmientoNoch keine Bewertungen
- Cálculo de Momentos y ReaccionesDokument23 SeitenCálculo de Momentos y ReaccionesAleco_CivilNoch keine Bewertungen
- Cuadro Médico Adeslas MUFACE PontevedraDokument132 SeitenCuadro Médico Adeslas MUFACE PontevedraJose PradoNoch keine Bewertungen
- Un Solo CampoDokument11 SeitenUn Solo CampoJoel MunzonNoch keine Bewertungen