Beruflich Dokumente
Kultur Dokumente
Relacion de Masa en Los Procesos Quimicos
Hochgeladen von
John Diaz0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
13 Ansichten2 Seitenen relaciones masa quimicos
Copyright
© © All Rights Reserved
Verfügbare Formate
DOCX, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenen relaciones masa quimicos
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
13 Ansichten2 SeitenRelacion de Masa en Los Procesos Quimicos
Hochgeladen von
John Diazen relaciones masa quimicos
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 2
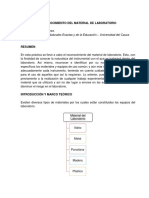
RELACION DE MASA EN LOS PROCESOS QUIMICOS
Esta práctica se trabajó la ley de Lomonósov-Lavoisier, la cual nos habla de la
conservación de la materia, mediante un proceso que se basó en mezclar ácido
nítrico, agua destilada, bicarbonato de sodio, ácido sulfúrico; obteniendo una
solución de sulfato de cobre a la cual se le agrego zinc se mezcló y calentó
finalmente se hizo el cálculo para saber qué porcentaje de cobre se recuperó.
RESULTADOS:
En este laboratorio se utilizó un vaso de precipitado de 100 ml el cual se pesó,
luego se procedió a pesar un vidrio reloj con 0,1 g de cobre metálico(Cu) para esto
se empleó la balanza analítica; En el tercer paso se trasvaso el cobre (Cu) al vaso de
precipitado y se colocó dentro de la campana de extracción, luego se le agrego 0.4
ml de solución de ácido nítrico(HNO3) al 69% esto se mezcló obteniendo una
disolución completa del cobre(Cu) se observó que la solución se tornó inicialmente
de un color verde claro, luego tomo un color verde oscuro, seguidamente adopto un
color azul aguamarina y finalmente obtuvo un color azul oscuro, posteriormente se
expuso a la plancha de calentamiento hasta secarla totalmente, y se dejó enfriar por
unos minutos se analizó que se evaporo el hidrogeno (H),la solución que se obtuvo
se cristalizo y se tornó de un color azul claro , luego se le agrego 20 ml de agua
destilada (H2O), se procedió a agitarlo con una varilla de vidrio hasta obtener la
disolución completa. Seguidamente se pesó 0.4g de bicarbonato de sodio
(NaHCO3) y se le agrego, Se observó un líquido de color azul claro, luego se le
adicionó 0.4 ml de ácido sulfúrico concentrado (H2SO4) al 97.5% se observó que la
solución pierde el color azul tornándose de un color traslucido, después se le agrego
5ml de agua (H2O) para disolver los cristales, seguidamente se le adiciono 0.1g de
zinc (Zn) para transformar el ion cobre (II) en cobre metálico, se analizó que al
introducir el zinc (Zn) y mezclarlo tomo un color verde. Finalizada la reacción se
separó el producto solido al someterlo al calor, se dejó enfriar por unos minutos y
luego se pesó el vaso de precipitado; para concluir la práctica se hizo el cálculo de
que cantidad de cobre (Cu) se recuperó.
ANALISIS DE RESULTADOS
En el momento que se trasvaso el cobre (Cu) al vaso de precipitado y se le
agrego 0,4 mL de sln de ácido nítrico (2HNO3) y se mezcló dentro de la campana
de extracción se obtuvo nitrato de cobre Cu (NO3)2 Cu+2HNO3 = Cu (NO3)2, al
someter el nitrato de cobre al calor el hidrogeno se desprende Cu (NO3)2 + H2 . El
nitrato de cobre Cu (NO3)2 + agua (H2O) nos da como resultado Cu2+(NO3)2-
.nitrato de cobre II CU2+(NO3)2-+acido sulfúrico (H2SO4) da como resultado la
sln de sulfato de cobre (CuSO4);Cu2+(NO3)-2+H2SO4 = CuSO4. Solución de
sulfato de cobre (CuSO4)+zinc (Zn)=Cu+ZnSO4 .A medida que la reacción avanzo,
el zinc se disolvió, el color azul debido al Cu++ se desvaneció y se depositó cobre
metálico +sulfato de zinc ZnSO4 que es incoloro el cual se disipo al exponerlo al
calor.
Vaso de precipitado con cobre:
51.896 g
Sometido al calor:
51.828 g
51.896 – 51.828 x 100 = 68%
O, 1
BIBLIOGRAFIA:
• Nitrato de cobre http://pt.wikipedia.org/wiki/Nitrato_de_cobre_(II)
• Sulfato de cobre www.ecured.cu/index.php/Sulfato_de_Cobre_(II)
• sulfato de zinc
www.fumex.cl/pdfs/fichas_tecnicas/SULFATO_DE_ZINC.pdf
Das könnte Ihnen auch gefallen
- Suma de Fracciones 26 de MayoDokument2 SeitenSuma de Fracciones 26 de MayoJohn DiazNoch keine Bewertungen
- Teoria de POTENCIACIÓN Y RADICACIÓN-160314145344Dokument8 SeitenTeoria de POTENCIACIÓN Y RADICACIÓN-160314145344NewBaby12Noch keine Bewertungen
- Ejercicios Suma Resta de FraccionesDokument12 SeitenEjercicios Suma Resta de FraccionesVictor Corona0% (1)
- Suma de Fracciones 26 de MayoDokument2 SeitenSuma de Fracciones 26 de MayoJohn DiazNoch keine Bewertungen
- Potencias, Raices y Logaritmos PDFDokument7 SeitenPotencias, Raices y Logaritmos PDFJohn DiazNoch keine Bewertungen
- Potencias, Raices y Logaritmos PDFDokument7 SeitenPotencias, Raices y Logaritmos PDFJohn DiazNoch keine Bewertungen
- Relato de Un Naufrago PruebaDokument5 SeitenRelato de Un Naufrago PruebaJohn Diaz100% (1)
- EXAMENDokument4 SeitenEXAMENJohn DiazNoch keine Bewertungen
- Ejercicios Suma Resta de FraccionesDokument12 SeitenEjercicios Suma Resta de FraccionesVictor Corona0% (1)
- Cronograma I Sem 2020Dokument2 SeitenCronograma I Sem 2020John DiazNoch keine Bewertungen
- Horario 2020Dokument15 SeitenHorario 2020John DiazNoch keine Bewertungen
- Material de Laboratorio Ii 2009-04 PDFDokument46 SeitenMaterial de Laboratorio Ii 2009-04 PDFAndy GO0% (1)
- SolucionarioDokument1 SeiteSolucionarioJohn DiazNoch keine Bewertungen
- El EcoDokument4 SeitenEl EcoJohn DiazNoch keine Bewertungen
- uNIDAD 1Dokument13 SeitenuNIDAD 1Alexa DiazNoch keine Bewertungen
- Cronica de Una Muerte Anunciada PruebaDokument5 SeitenCronica de Una Muerte Anunciada PruebaWendy Vivar AyalaNoch keine Bewertungen
- Cronica de Una Muerte Anunciada PruebaDokument5 SeitenCronica de Una Muerte Anunciada PruebaWendy Vivar AyalaNoch keine Bewertungen
- Recuperación SocialesDokument10 SeitenRecuperación SocialesJohn DiazNoch keine Bewertungen
- Caballero de La Armadura OxidadaDokument4 SeitenCaballero de La Armadura OxidadaJohn Diaz67% (3)
- Taller de Filosofía y Etica Grados 6, 7 10 y 11Dokument3 SeitenTaller de Filosofía y Etica Grados 6, 7 10 y 11John DiazNoch keine Bewertungen
- Mat y Equ de Uso Comun1Dokument20 SeitenMat y Equ de Uso Comun1John Jairo Gomez CaicedoNoch keine Bewertungen
- RIFADokument1 SeiteRIFAJohn DiazNoch keine Bewertungen
- Enlaces Quimicos 2Dokument6 SeitenEnlaces Quimicos 2John DiazNoch keine Bewertungen
- Report e 5931115232446777547Dokument1 SeiteReport e 5931115232446777547John DiazNoch keine Bewertungen
- Primer ExamenDokument1 SeitePrimer ExamenJohn DiazNoch keine Bewertungen
- Guia de Laboratorio Mb312Dokument71 SeitenGuia de Laboratorio Mb312AndreDavilaHidalgoNoch keine Bewertungen
- TEMA MUESTRA - El Laboratorio PDFDokument25 SeitenTEMA MUESTRA - El Laboratorio PDFNadia Ponton CaroNoch keine Bewertungen
- Ejemplo de Imforme Qca GeneralDokument6 SeitenEjemplo de Imforme Qca GeneralJohn Diaz50% (2)
- Elementos Del LaboratorioDokument2 SeitenElementos Del LaboratorioJohn DiazNoch keine Bewertungen
- Elementos Del LaboratorioDokument2 SeitenElementos Del LaboratorioJohn DiazNoch keine Bewertungen
- M. F Ejercicios Resueltos y Propuestos 2 017 1Dokument11 SeitenM. F Ejercicios Resueltos y Propuestos 2 017 1Alexandro TorresNoch keine Bewertungen
- Sustentación Soldados en La Lluvia 2023Dokument8 SeitenSustentación Soldados en La Lluvia 2023Yaneth MaldonadoNoch keine Bewertungen
- Acto de Comercio y Contabilidad Mercantil NicaraguaDokument2 SeitenActo de Comercio y Contabilidad Mercantil Nicaraguahellboy14ddNoch keine Bewertungen
- Las Evaluaciones Educativas Que América Latina NecesitaDokument6 SeitenLas Evaluaciones Educativas Que América Latina NecesitaYaya EscobarNoch keine Bewertungen
- Ejercicio Personal FodaDokument2 SeitenEjercicio Personal FodaYulimarie FerreraNoch keine Bewertungen
- IndexDokument34 SeitenIndexVicente DuboNoch keine Bewertungen
- Unidad 06 SesionDokument30 SeitenUnidad 06 SesionArturo AQUINO MOYANoch keine Bewertungen
- Modulo 1 DecimalesDokument13 SeitenModulo 1 DecimalesMabel MirandaNoch keine Bewertungen
- RESUMEN CUARTA Y QUINTA SEMANA (Imbestigacion Criminal) .Dokument3 SeitenRESUMEN CUARTA Y QUINTA SEMANA (Imbestigacion Criminal) .Nilson Torres DiazNoch keine Bewertungen
- HipótesisDokument6 SeitenHipótesisWendy Marleen Rodriguez Gutierrez100% (1)
- Conocimientos de Embarque y Manifiesto de CargaDokument3 SeitenConocimientos de Embarque y Manifiesto de CargaJUAN CARLOSNoch keine Bewertungen
- 6 DBN IwDokument3 Seiten6 DBN IwViviana CruzNoch keine Bewertungen
- Estudio de Caso 2 - Agnosias - AmnesiasDokument3 SeitenEstudio de Caso 2 - Agnosias - AmnesiasMariana ArredondoNoch keine Bewertungen
- El Movimiento Apostolico ContemporaneoDokument17 SeitenEl Movimiento Apostolico Contemporaneoblade_guardian100% (2)
- VictorialopithecusDokument38 SeitenVictorialopithecusmoradasdeliteraturaNoch keine Bewertungen
- Clase 6-Actos de HablaDokument18 SeitenClase 6-Actos de HablaFrancisca Coria100% (3)
- San Margarito Flores GarcíaDokument8 SeitenSan Margarito Flores GarcíaHelena LopezNoch keine Bewertungen
- Planeación Letra M 1BDokument6 SeitenPlaneación Letra M 1BLeYo CuPaNoch keine Bewertungen
- Streptococcus PneumoniaeDokument2 SeitenStreptococcus PneumoniaeIsac LimacheNoch keine Bewertungen
- Tribunal de Transparencia - Pedido ParticularDokument5 SeitenTribunal de Transparencia - Pedido Particularjavier quispe aquinoNoch keine Bewertungen
- Estructura Metálica PPRDokument7 SeitenEstructura Metálica PPRinfodontoulaNoch keine Bewertungen
- La Salvación Selectiva o PredestinaciónDokument5 SeitenLa Salvación Selectiva o PredestinacióndistritosamariaNoch keine Bewertungen
- El AscensorDokument4 SeitenEl AscensorGuillermo CédolaNoch keine Bewertungen
- Amenaza de Parto PreterminoDokument20 SeitenAmenaza de Parto PreterminoVero CriolloNoch keine Bewertungen
- Para Estudiantes Ficha de Lectio 2021Dokument2 SeitenPara Estudiantes Ficha de Lectio 2021Diego CRNoch keine Bewertungen
- Biografías - BP Constancio C Vigil-Rosario - Santa Fe PDFDokument10 SeitenBiografías - BP Constancio C Vigil-Rosario - Santa Fe PDFConabip Ministerio de CulturaNoch keine Bewertungen
- Formulario InvimaDokument5 SeitenFormulario Invimaprincesx171288% (8)
- Trabajo Modulo I - InflaciónDokument16 SeitenTrabajo Modulo I - InflaciónCarlos PeNoch keine Bewertungen
- Pregunta 1Dokument52 SeitenPregunta 1Jose Maria Ortigoza Ramiro0% (1)
- Fundamentos Python2Dokument5 SeitenFundamentos Python2Olga Marina Cuero RivasNoch keine Bewertungen