Beruflich Dokumente
Kultur Dokumente
Fisiopatología Del Tromboembolismo Pulmonar
Hochgeladen von
Lina Maria0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
49 Ansichten8 SeitenEste documento resume la fisiopatología del tromboembolismo pulmonar en 3 oraciones:
1) La obstrucción de las arterias pulmonares por una embolia aumenta la resistencia al flujo sanguíneo y la presión arterial pulmonar, lo que sobrecarga el ventrículo derecho.
2) Si el ventrículo derecho no puede manejar esta sobrecarga adicional, puede fallar, lo que a su vez afecta negativamente la función del ventrículo izquierdo.
3) La falla del ventrículo derecho ocurre cuando
Originalbeschreibung:
trombo
Copyright
© © All Rights Reserved
Verfügbare Formate
DOCX, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenEste documento resume la fisiopatología del tromboembolismo pulmonar en 3 oraciones:
1) La obstrucción de las arterias pulmonares por una embolia aumenta la resistencia al flujo sanguíneo y la presión arterial pulmonar, lo que sobrecarga el ventrículo derecho.
2) Si el ventrículo derecho no puede manejar esta sobrecarga adicional, puede fallar, lo que a su vez afecta negativamente la función del ventrículo izquierdo.
3) La falla del ventrículo derecho ocurre cuando
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
49 Ansichten8 SeitenFisiopatología Del Tromboembolismo Pulmonar
Hochgeladen von
Lina MariaEste documento resume la fisiopatología del tromboembolismo pulmonar en 3 oraciones:
1) La obstrucción de las arterias pulmonares por una embolia aumenta la resistencia al flujo sanguíneo y la presión arterial pulmonar, lo que sobrecarga el ventrículo derecho.
2) Si el ventrículo derecho no puede manejar esta sobrecarga adicional, puede fallar, lo que a su vez afecta negativamente la función del ventrículo izquierdo.
3) La falla del ventrículo derecho ocurre cuando
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 8
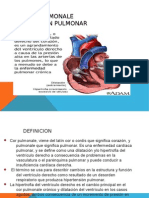
Fisiopatología del Tromboembolismo Pulmonar
Hector Fabio Sanchez G.* Oscar Saenz**
* Residente I Año Medicina Interna Fundacion Universitaria San Martin Hospital Santa Clara
** Médico Neumólogo. Coordinador Dpto. Fisiología pulmonar Hospital Santa Clara
Introducción:
El tromboembolismo pulmonar (TEP), es una patología de alta incidencia
en nuestro medio. Los deletéreos, cambios hemodinámicos que se
desarrollan una vez se ha instaurado la embolia, determinan las graves y
agudas complicaciones que este evento enmarca. El entendimiento de
dichos cambios fisio patológicos facilitará la aproximación diagnóstica del
evento embólico y la instauración de la terapia adecuada lo antes posible.
Este documento pretende solamente hacer una revisión a las actuales
bases fisiopatológicas del evento embólico pulmonar.
Modelo Circulatorio
Desde hace ya varios años se entiende que el sistema circulatorio es un
conducto cilíndrico abierto, con un gasto cardíaco definido como un
gradiente de presión contra una resistencia periférica. El sistema
circulatorio consiste en una bomba compuesta por un corazón derecho
(bomba derecha) que se enlaza con el corazón izquierdo. Como
consecuencia de este enlace entre el corazón izquierdo y derecho el gasto
cardíaco no puede exceder el retorno venoso y viceversa. En otras
palabras el gasto cardíaco izquierdo no puede exceder el gasto cardíaco
derecho lo cual permite conceptuar ambas bombas como una sola unidad
hidráulica. La bomba hidráulica funciona inicialmente a partir del volumen
de la capacitancia venosa el cual es entregado al sistema arterial.
Figura 1. Relaciones entre la
presión, la resistencia y el flujo sanguíneo.
Se reconoce que el gradiente de presión para el retorno venoso
corresponde a la la relación de la presión en la capacitancia venosa menos
la presión de la aurícula derecha ( RV= PVC – PAD). Se establece así el
papel fundamental de la aurícula derecha como enlace entre el sistema
venoso y la función hidráulica del corazón. La Presión venosa central está
dada en función del volumen venoso y el tono vascular, haciendo que la
aurícula derecha se deba esforzar para mantener la presión de retorno
venoso. La presión de la aurícula derecha no solo provee información
acerca de la presión en el corazón derecho sino una medida de la presión
en la capacitancia venosa. Así, el sistema circulatorio puede ser definido
como un sistema tri-compartimental; una capacitancia que provee volumen
a las bombas hidráulicas que generan flujo al sistema aterial. Cualquier
anormalidad hemodinámica puede ser generada por daños de una o más
de estas variables. Los similares de la capacitancia venosa, la bomba
hidráulica y el sistema de impedancia arterial son la presión en la aurícula
derecha, el gasto cardíaco y la resistencia vascular periférica
respectivamente.
Fisiopatología Del Trombo Embolismo Pulmonar
Mecanismo de la falla cardíaca
Cuando se presenta la obstrucción de las arterias pulmonares por
embolia se afectan: 1) El tejido pulmonar, 2) La circulación pulmonar, y 3)
La función del corazón derecho e izquierdo. El grado de compromiso
cardiopulmonar se correlaciona con la severidad de la oclusión producida
por el émbolo y con el grado de enfermedad de base del paciente.
La severidad de compromiso hemodinámico que ocurre con el embolismo
pulmonar agudo está en correlación con la magnitud de la obstrucción de
los vasos pulmonares en pacientes sin enfermedad cardiopulmonar previa.
De otra parte, en personas con enfermedad cardiopulmonar subyacente,
la inestabilidad hemodinámica severa puede ocurrir con obstrucciones que
no sobrepasan el 50% de la vascularización pulmonar. El embolismo
pulmonar trae consigo una consecuencia hemodinámica inicial, la cual
consiste en una reducción del área del lecho vascular pulmonar y un
aumento en la resistencia al flujo de sangre a través de los pulmones. Si
el trabajo cardíaco permanece constante o aumentado, se eleva la presión
arterial pulmonar. El mantenimiento del flujo a través de este lecho
vascular dependerá de la capacidad del ventrículo derecho de bombear en
contra de esta sobrecarga adicional. Si el ventrículo derecho no logra
vencer dicha resistencia entonces se produce la falla del ventrículo
derecho.
La falla cardíaca por TEP se produce por combinación del incremento de
la tensión sobre la pared ventricular derecha, y de la isquemia cardíaca
que compromete la función del ventrículo derecho, asociada a la
disminución del gasto cardíaco en el ventrículo izquierdo. Se ha
demostrado que el aumento en la presión de la arteria pulmonar se
relaciona con la severidad del embolismo. En personas sanas, la
hipertensión pulmonar severa generalmente no ocurre hasta que el 50%
del lecho vascular pulmonar se ocluye. Con más del 50% de oclusión, se
produce hipertensión pulmonar progresiva y aumento del trabajo
ventricular derecho. Si coexiste la enfermedad cardíaca o pulmonar y ya
han dañado la capacidad de la reserva vascular pulmonar; una cantidad
relativamente más pequeña de oclusión vascular produce hipertensión
arterial pulmonar mayor, y la disfunción ventricular derecha se instaura con
mayor facilidad. A menudo, la presión arterial pulmonar media en
pacientes con enfermedad cardiopulmonar previa excede los valores más
altos observados en pacientes libres de enfermedad cardiopulmonar
anterior lo cual hace pensar en la presencia de hipertrofia del ventrículo
derecho pre-existente.
En individuos normales, el ventrículo derecho es una cámara delgada que
no está preparada para desarrollar presiones altas y realizar trabajo de
alta-intensidad durante períodos extendidos de tiempo, además, hay
límites en la habilidad del ventrículo derecho para compensar la oclusión
embolica. En pacientes sin enfermedad cardiopulmonar preexistente, la
máxima presión arterial pulmonar que puede desarrollarse y puede
mantenerse es de aproximadamente 40 mm Hg
Dada la relación reciproca entre la presión de llenado del ventrículo
derecho y el volumen vascular venoso, la presión de llenado del ventrículo
derecho podría aumentar, ocasionando aumento en su carga de trabajo.
Inicialmente se inicia un mecanismo compensatorio orientado a mantener
el gasto cardíaco, dado por la combinación de aumento en los niveles de
catecolaminas, ocasionando taquicardia y utilización de la ley de starling.
Esto incrementa la presión del ventrículo derecho. Todo lo anterior
incrementa el consumo de oxígeno por parte del ventrículo derecho,
predisponiendo a la isquemia. Con el incremento de la carga del ventrículo
derecho y la tensión en su pared, se deprime la función sistólica y se
produce una caída del gasto cardíaco. Si esta carga de presión se
sostiene, la falla ventricular derecha ocurre, y el desarrollo de cor
pulmonale generalmente sobreviene.
Figura 2. El diagrama demuestra el efecto
del aumento del volumen del ventrículo derecho (VD) sobre la relación
presión-volumen diastólicos (llenado) del ventrículo izquierdo (VI), Note
que el aumento del volumen del VD disminuye la compliance diastólica del
VI, de tal modo que se requiere una mayor presión de llenado para generar
un volumen constante de fin de diástole (Taylor et al. Dependence of
ventricular distensibylity on filling the opposite ventricle. Am J Physiol 1967;
213:711-15)
Bajo condiciones de tensión del ventrículo derecho, los requerimientos de
oxígeno del músculo ventricular derecho aumentan, y el aporte de su
oxígeno por la pobre perfusión coronaria se torna crítica. Por consiguiente,
si la presión arterial sistémica se cae (como se comenta mas adelante), el
ventrículo derecho entra en isquemia llevando a una caída importante en
el gasto cardíaco y posteriormente a la muerte debido a arritmias o colapso
derecho. La función ventricular Izquierda es totalmente dependiente de la
función ventricular derecha en este escenario. Los datos animales indican
que la supervivencia puede ser mejorada por agentes que mantengan la
presión arterial sistémica y, por consiguiente, mejoren la perfusión
coronaria al ventrículo derecho, el cual se encuentra en ese momento
cargado excesivamente. Interesantemente, la presión sanguínea
sistémica se mantiene por vasoconstricción.
Se conoce que un incremento mayor del 20% de la precarga disminuye el
gasto cardíaco y podría elevar desproporcionadamente el volumen de fin
de sístole comparado con el volumen de fin de diástole. El concepto de
postcarga desigual viene siendo utilizado para describir el fenómeno de
incremento del volumen de trabajo del ventrículo derecho. Como
consecuencia de esta desigualdad, la precarga del ventrículo izquierdo
puede disminuir, dado el enlace ventricular ya descrito. Se ha demostrado
que el creciente volumen ventricular derecho y la disminución de la
distensibilidad del ventrículo izquierdo por desviación del septum
interventricular alteran la precarga del ventrículo izquierdo; Esto quiere
decir que el TEP puede dañar la función del ventrículo izquierdo
independientemente de los mecanismos de cambio en la precarga. Una
disminución mayor del flujo del ventrículo izquierdo resulta en hipotensión
sistémica.
La presión de perfusión coronaria del ventrículo derecho depende del
gradiente entre la PAM y la presión subendocardíaca del ventrículo
derecho. La disminución de la PAM se asocia con incremento en la presión
de fin de diástole del ventrículo derecho afectando directamente la
perfusión subendocárdica y el aporte de oxígeno. El incremento en la
demanda de oxígeno se asocia con elevación de la tensión en la pared del
ventrículo y se relaciona con una disminución en el aporte de oxigeno lo
que precipita la presencia de isquemia y finalmente causa la falla del
ventrículo derecho.
Se ha demostrado que el impacto del material embólico sobre el flujo de
salida de la vasculatura pulmonar, precipita un incremento en la resistencia
vascular sistémica. La disminución o el incremento en la RVS está
relacionada con la obstrucción mecánica y el estado cardiopulmonar previo
Otros factores han sido considerados al contribuir al incremento de la RVS
incluyendo reflejos neurales, reflejos humorales, acción de las plaquetas,
trombina, péptidos vaso activos, histamina e hipoxia arterial sistémica. El
papel de los mecanismos reflejos y humorales en la respuesta
hemodinámica después de la embolia ha recibido una gran atención. La
agregación plaquetaria acompañada de la descarga de varios mediadores
vaso activos probablemente contribuyen al proceso vaso constrictivo
pulmonar. Estos mecanismos reflejos y humorales se pueden considerar
para el serio grado de compromiso hemodinámico encontrado en algunos
pacientes después de lo que parece haber sido un evento de embolia
submasiva. El incremento agudo de la resistencia vascular sistémica
aumenta la presión y produce efectos múltiples sobre la función del
ventrículo izquierdo.
Es importante anotar que la severidad de compromiso hemodinámico no
puede ser calibrada por el grado de hipertensión pulmonar. Como el
ventrículo derecho falla y el gasto cardíaco cae, la presión arterial
pulmonar se cae a menudo, a pesar de la presencia de una resistencia
pulmonar vasculares sumamente alta. Por consiguiente, la presión arterial
pulmonar es un inadecuado y potencialmente engañoso marcador de la
severidad de la obstrucción embólica.
Alteraciones en el intercambio de gases
Las anormalidades del intercambio gaseoso en el ámbito pulmonar son
una consecuencia inevitable de embolización pulmonar. Es probable que
la etiología de la anormalidad del intercambio gaseoso sea compleja y
multifactorial, y puede diferir de un paciente a otro. Las anormalidades del
intercambio de gases en pacientes con TEP son complejas y dependen
del tamaño y características del material embólico, de la extensión de la
oclusión, del estado cardiopulmonar previo del paciente, y del tiempo
transcurrido desde la embolización. La hipoxemia se atribuye a:
1 Aumento del espacio muerto alveolar.
2 Incremento del corto circuito de derecha a izquierda.
3 Desequilibrio entre ventilación / perfusión.
4 Bajo nivel de oxígeno venoso mezclado.
Los anteriores mecanismos son propuestos para considerar la mayor
hipoxia e hipercarbia encontradas antes y después del tratamiento. Un
aumento en el espacio muerto alveolar es una consecuencia inevitable del
embolismo pulmonar. El cortocircuito de derecha-a-izquierda, una
alteración en la relación ventilación-perfusión y en ciertos pacientes, una
caída en la tensión de oxígeno de la sangre venosa, han tenido un papel
en el proceso del intercambio gaseoso anormal conduciendo a la
hipoxemia que sigue a la embolia pulmonar. La etiología de estas
alteraciones fisiológicas no se ha definido claramente, pero existen varias
hipótesis:
1) Áreas pulmonares con baja relación ventilación-perfusión las pueden
desarrollar debido a la sobre perfusión de regiones pulmonares no
embolizadas. Las bajas relaciones de ventilación / perfusión se pueden
desarrollar como consecuencia de la redistribución de sangre lejos del
área embolizada, resultando en una sobre perfusión de las áreas
pulmonares no embolizadas y atelectasias que inicialmente se desarrollan
distalmente a la obstrucción embólica que todavía persisten después de la
disolución temprana del embolismo y la reperfusión resultante.
2) Las Atelectasias se pueden desarrollar en áreas distales a la
obstrucción embólica y con la posterior disolución o con la migración distal
del material embólico, hay reperfusion de estas áreas pulmonares. La
inversión de la hipoxemia postembólica con ventilación con presión
positiva apoya la creencia a esta teoría. Las atelectasias pueden tener
muchas causas. Las atelectasias hemorrágicas parecen ser el resultado
de la pérdida de surfactantante que ocurre cuando el flujo de sangre de la
arteria pulmonar es ocluído. Un fenómeno de “movimiento de aire” puede
presentarse en la hipoperfusión pulmonar regional y ser la causa de la
hipocapnia regional que a su vez induce constricción bronquiolar y
neumoconstricción y llevar adicionalmente a atelectasias, adicionalmente
el material embólico es cubierto de plaquetas y esto se ha propuesto como
una causa de atelectasias promoviendo la neumoconstricción y la pérdida
de surfactante.
3) En una variedad de modelos de experimentación animal, el edema
pulmonar post-embólico ha demostrado jugar un papel importante en el
desarrollo de hipoxemia, pero estos resultados son difíciles de relacionar
a los humanos. Otra posibilidad que debe ser considerada es que, con el
desarrollo de hipertensión pulmonar, la sobrecarga ventricular derecha, y
una elevación de la presión auricular derecha le siguen a la embolia
pulmonar; allí se puede desarrollar una desviación del flujo a través de un
foramen ovale persistente. Aproximadamente el 15% de la población
normal tienen un foramen ovale persistente, por lo cual este mecanismo
debe tomarse en cuenta seriamente.
La enfermedad Pulmonar vascular generalmente se define como un
estrechamiento anatómico de la vascularización pulmonar, En un sentido
más amplio puede definirse también como un cambio en la impedancia
vascular pulmonar en ciertas regiones, que proviene de las anomalías en
el lumen o las paredes de vasos pulmonares. Existen diferentes
situaciones clínicas que causan enfermedad vascular pulmonar, donde el
intercambio de gases puede evaluarse utilizando la técnica de eliminación
múltiple de gas inerte, MIGET. La embolia pulmonar, la oclusión unilateral
de la arteria pulmonar, y la policitemia son algunas de las enfermedades
que producen dichos cambios.
Como ya se ha mencionado en este documento, la falla cardíaca que
ocurre en estas condiciones tiende a acentuar las perturbaciones en el
intercambio de gases como resultado de la interacción entre los factores
intra pulmonares y extra pulmonares que determinan valores de Pao2. Sin
embargo, la mayoría de las enfermedades cardíacas primarias ocurren en
pacientes con pulmones previamente normales. Se concluye entonces que
un cambio en el gasto cardíaco en la ausencia de cualquier anormalidad
pulmonar asociada, puede ser uno de los factores determinantes en las
alteraciones de intercambio de gases.
Das könnte Ihnen auch gefallen
- Presión Arterial Baja: Cómo reconocer, manejar y solucionar esta alteración que también puede afectar tu bienestarVon EverandPresión Arterial Baja: Cómo reconocer, manejar y solucionar esta alteración que también puede afectar tu bienestarBewertung: 5 von 5 Sternen5/5 (1)
- Hipertensión Pulmonar Arterial: (Ascitis) En Pollos De EngordaVon EverandHipertensión Pulmonar Arterial: (Ascitis) En Pollos De EngordaNoch keine Bewertungen
- Cardio 5Dokument16 SeitenCardio 5CatalinaNoch keine Bewertungen
- T24. Interaccion CardiopulmonarDokument7 SeitenT24. Interaccion CardiopulmonarZurisadaiAlbaNoch keine Bewertungen
- Efectos Hemodinamicos de La Ventilacion MecanicaDokument20 SeitenEfectos Hemodinamicos de La Ventilacion MecanicaSuarez De Vitali Elizabeth100% (6)
- Cortocircuitos IntracardiacosDokument8 SeitenCortocircuitos IntracardiacosPatricia Andrea Acevedo ArancibiaNoch keine Bewertungen
- Sistema de Dos BombasDokument1 SeiteSistema de Dos BombasMery JaraNoch keine Bewertungen
- Murias - Interacciones Cardiopulmonares Durante La Ventilación A Presión PositivaDokument24 SeitenMurias - Interacciones Cardiopulmonares Durante La Ventilación A Presión PositivaNicolas SuarezNoch keine Bewertungen
- Fisiopatologia Del ShockDokument14 SeitenFisiopatologia Del Shockluis diazNoch keine Bewertungen
- Taller Interaccion Corazon PulmonDokument6 SeitenTaller Interaccion Corazon PulmonCamilo QuinteroNoch keine Bewertungen
- MODULE TRANSCRIPTION - En.esDokument12 SeitenMODULE TRANSCRIPTION - En.esendy tovarNoch keine Bewertungen
- 3 Fisiopatologia Del TepDokument4 Seiten3 Fisiopatologia Del Tepapi-3697492100% (2)
- TEP e Hipertensivas-1Dokument13 SeitenTEP e Hipertensivas-1valentinavilloNoch keine Bewertungen
- Hipertension PulmonarDokument10 SeitenHipertension PulmonarMonica EstradaNoch keine Bewertungen
- De La Fisiología Al Ventilador, Interacción Corazón Pulmón Durante La Ventilación MecánicaDokument10 SeitenDe La Fisiología Al Ventilador, Interacción Corazón Pulmón Durante La Ventilación Mecánicamondial200Noch keine Bewertungen
- Cortocircuito de Derecha A IzquierdaDokument4 SeitenCortocircuito de Derecha A IzquierdaEdgar Ronán MoralesNoch keine Bewertungen
- Retorno VenosoDokument5 SeitenRetorno VenosoRossy FloresNoch keine Bewertungen
- UntitledDokument7 SeitenUntitledeuclydes BravoNoch keine Bewertungen
- Fisiología - Parcial Iii - Circulación Pulmonar y Circulación Mayor - TranscripciónDokument6 SeitenFisiología - Parcial Iii - Circulación Pulmonar y Circulación Mayor - TranscripciónMarines BarretoNoch keine Bewertungen
- Insuficiencia CoronariaDokument15 SeitenInsuficiencia CoronariaSofia FurtadoNoch keine Bewertungen
- Insuficiencia Coronaria 1Dokument7 SeitenInsuficiencia Coronaria 1Sofia FurtadoNoch keine Bewertungen
- Precarga y Post CargaDokument3 SeitenPrecarga y Post CargaMaria SalazarNoch keine Bewertungen
- 2448 8909 MCCMMC 34 05 283Dokument10 Seiten2448 8909 MCCMMC 34 05 283CARLOS A. BELTRAN QUIROZNoch keine Bewertungen
- Curva de Retorno VenosoDokument15 SeitenCurva de Retorno VenosoEL PAPI DE LAS NENASNoch keine Bewertungen
- 2nda Semana CardioDokument39 Seiten2nda Semana CardioFlorencia GuastalliNoch keine Bewertungen
- 64 Presentación Electrónica Educativa 123 1-10-20181121Dokument30 Seiten64 Presentación Electrónica Educativa 123 1-10-20181121Carlos SotgiuNoch keine Bewertungen
- Presiones CirculacionDokument5 SeitenPresiones CirculacionManuel Muñoz100% (1)
- Sistema Venoso o de Baja PresiónDokument20 SeitenSistema Venoso o de Baja PresiónIsabel AguilarNoch keine Bewertungen
- Gasto y PVCDokument4 SeitenGasto y PVCayari.hgo51Noch keine Bewertungen
- Interaccion Corazon PulmonDokument13 SeitenInteraccion Corazon Pulmonluiseponce5443100% (1)
- Traducción Revisión1Dokument15 SeitenTraducción Revisión1Heiron Tamako LópezNoch keine Bewertungen
- Corazón Resistencias Periféricas y PulmonaresDokument9 SeitenCorazón Resistencias Periféricas y PulmonaresAngélica Morales RoblesNoch keine Bewertungen
- Tsa5 - Práctica N 05 MorfofisiologíaDokument17 SeitenTsa5 - Práctica N 05 Morfofisiologíayamylexy mendozaNoch keine Bewertungen
- Flujo Sanguíneo PulmonarDokument5 SeitenFlujo Sanguíneo PulmonarStephy LlumiquingaNoch keine Bewertungen
- 172274-Text de L'article-254168-1-10-20100602Dokument21 Seiten172274-Text de L'article-254168-1-10-20100602Yuri PerezNoch keine Bewertungen
- EXPLICACIÓNDokument6 SeitenEXPLICACIÓNKeren OliveroNoch keine Bewertungen
- Caso Clinico de Fisiologia Cardiovascular 2022Dokument20 SeitenCaso Clinico de Fisiologia Cardiovascular 2022Gerson GarciaNoch keine Bewertungen
- Fisiopatologia de Las ValvulopatiasDokument17 SeitenFisiopatologia de Las ValvulopatiasPatricia Andrea Acevedo Arancibia100% (1)
- Circulación PulmonarDokument19 SeitenCirculación PulmonarArianna SaranteNoch keine Bewertungen
- Caso Clinco 1 GastoDokument6 SeitenCaso Clinco 1 Gastoscarleth jamileth vasquez alvarezNoch keine Bewertungen
- Estenosis MitralDokument4 SeitenEstenosis MitralMaría GabrielaNoch keine Bewertungen
- Taponamiento Cardiaco (Otoño 2021)Dokument24 SeitenTaponamiento Cardiaco (Otoño 2021)Victoria SánchezNoch keine Bewertungen
- 32.1.medición de Presión PulmonarDokument31 Seiten32.1.medición de Presión PulmonarLeslie Calle SánchezNoch keine Bewertungen
- Cateter Swan GanzDokument12 SeitenCateter Swan GanzChristianSaidFloresCancinoNoch keine Bewertungen
- Efectos de La VMDokument14 SeitenEfectos de La VMKatherine BangueroNoch keine Bewertungen
- Peep (Presion Positiva Al Final de La Exhalacion)Dokument35 SeitenPeep (Presion Positiva Al Final de La Exhalacion)ramon50% (4)
- XC XcsiopatolocDokument3 SeitenXC XcsiopatolocSegundo PicoNoch keine Bewertungen
- Cor Pulmonale AgudoDokument2 SeitenCor Pulmonale Agudoariadna0709Noch keine Bewertungen
- Cor Pulmonale ApuntesDokument3 SeitenCor Pulmonale ApuntesSorainy Vasquez GarciaNoch keine Bewertungen
- Guia de Enfermedades CardiovascularesDokument26 SeitenGuia de Enfermedades CardiovascularesJessica Andreina Andrade SosaNoch keine Bewertungen
- Clase de Fisiología CardiovascularDokument10 SeitenClase de Fisiología CardiovascularXena Katherine Gutarra SosaNoch keine Bewertungen
- Cor PulmonaleDokument25 SeitenCor PulmonaleWillian TaipeNoch keine Bewertungen
- Efectos de La Ventilacion MecanicaDokument26 SeitenEfectos de La Ventilacion MecanicaramonNoch keine Bewertungen
- Curvas Volumen - PresiónDokument4 SeitenCurvas Volumen - PresiónAna Belén Brito100% (1)
- Circulación PulmonarDokument112 SeitenCirculación PulmonarCindy RodriguezNoch keine Bewertungen
- Capitulo 15 Del Guyton - Distensibilidad Vascular y Funciones de Los Sistemas Arterial y VenosoDokument17 SeitenCapitulo 15 Del Guyton - Distensibilidad Vascular y Funciones de Los Sistemas Arterial y VenosoAlberto Jesús Guzman GarcíaNoch keine Bewertungen
- Cardiopatías CianógenasDokument4 SeitenCardiopatías CianógenasPedro M. De CastroNoch keine Bewertungen
- Presión Venosa CentralDokument8 SeitenPresión Venosa CentralCastro AlbinaNoch keine Bewertungen
- Interacción Corazón Pulmón en Ventilación MecánicaDokument3 SeitenInteracción Corazón Pulmón en Ventilación MecánicajesusNoch keine Bewertungen
- El Edema Pulmonar Cardiogenico Valdine y EmmanuelleDokument20 SeitenEl Edema Pulmonar Cardiogenico Valdine y EmmanuelleRadetzky CharlotinNoch keine Bewertungen
- Modelo de Examen NeurológicoDokument6 SeitenModelo de Examen NeurológicoAna Lucia Sencia CondoriNoch keine Bewertungen
- Costumbres y Gastronomía en El Siglo de OroDokument14 SeitenCostumbres y Gastronomía en El Siglo de OroblackkaterNoch keine Bewertungen
- Zombiavirus y Otras YerbasDokument7 SeitenZombiavirus y Otras YerbasCarolina MachucaNoch keine Bewertungen
- Importancia de La Interacción Genética-Ambiente en La Etiología de Las MaloclusionesDokument7 SeitenImportancia de La Interacción Genética-Ambiente en La Etiología de Las MaloclusionesRevmof Motricidad OrofacialNoch keine Bewertungen
- HiperlordosisDokument20 SeitenHiperlordosisAnny RoseNoch keine Bewertungen
- AV 37 Urolitiasis Manejo Nutricional PerroDokument7 SeitenAV 37 Urolitiasis Manejo Nutricional PerroMiguel Angel VPNoch keine Bewertungen
- Cisternas SubaracnoideasDokument2 SeitenCisternas Subaracnoideasfabricio_tejeraNoch keine Bewertungen
- ABC Del TraumaDokument9 SeitenABC Del TraumaNicoleMillánNoch keine Bewertungen
- Articulo4 - 37Dokument6 SeitenArticulo4 - 37German Andres Daza PenagosNoch keine Bewertungen
- Fibrinogeno SPDokument3 SeitenFibrinogeno SPandreaNoch keine Bewertungen
- ICTERICIADokument13 SeitenICTERICIAVictoria Castillo Gomez100% (1)
- Aprovechamiento de La Hidralgirita en La Salud HumanaDokument47 SeitenAprovechamiento de La Hidralgirita en La Salud HumanaDenisse Johans100% (1)
- Tema 4 Biologia y GeologiaDokument4 SeitenTema 4 Biologia y GeologiaVirginia MerinosanzNoch keine Bewertungen
- Rotafolio 2014 NeumoniaDokument26 SeitenRotafolio 2014 NeumoniaKatherin Ynga CarranzaNoch keine Bewertungen
- Simpaticomiméticos Farmacología e Indicaciones Terapéuticas en ReanimaciónDokument17 SeitenSimpaticomiméticos Farmacología e Indicaciones Terapéuticas en ReanimaciónRobert Michael Quintanilla Castilla100% (3)
- Patologias de Intestino DelgadoDokument139 SeitenPatologias de Intestino DelgadoCandelario HB100% (1)
- PeriostitisDokument7 SeitenPeriostitisabmis89100% (1)
- NOM017Dokument11 SeitenNOM017epimosko_85100% (5)
- Semiologia de Piel y FanerasDokument77 SeitenSemiologia de Piel y FanerasAlex Alain Mamani Flores100% (1)
- Ficha Excreción AnimalesDokument1 SeiteFicha Excreción AnimalesCiencias Naturales SSNoch keine Bewertungen
- Tratamiento Con TuinaDokument137 SeitenTratamiento Con TuinaPatricia GarciaNoch keine Bewertungen
- 3 1clases 140902042404 Phpapp02Dokument66 Seiten3 1clases 140902042404 Phpapp02OOZERHEX100% (1)
- PomeraniaDokument7 SeitenPomeraniaGustavo MartinezNoch keine Bewertungen
- Otitis Media Cronica (Presentacion)Dokument24 SeitenOtitis Media Cronica (Presentacion)Omar Casillas0% (1)
- Nyvad e IcdasDokument3 SeitenNyvad e IcdasLeandro Fierro FabresNoch keine Bewertungen
- 01 Evaluar y Clasificar Enfermedad Grave o Infecci N LocalDokument18 Seiten01 Evaluar y Clasificar Enfermedad Grave o Infecci N LocalpacsolanoNoch keine Bewertungen
- EndocardioDokument3 SeitenEndocardioOmae WaNoch keine Bewertungen
- Anestesia OriginalDokument105 SeitenAnestesia OriginalAlex SixtosNoch keine Bewertungen
- CrisopaDokument47 SeitenCrisopayadiraNoch keine Bewertungen
- Cuidado Del Nià o Sano (3) 1Dokument46 SeitenCuidado Del Nià o Sano (3) 1Fer PerezNoch keine Bewertungen