Beruflich Dokumente
Kultur Dokumente
Equation de Combustion
Hochgeladen von
abdessamadCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Equation de Combustion
Hochgeladen von
abdessamadCopyright:
Verfügbare Formate
MCI TECHNOLOGIE
EQUATION DE COMBUSTION
Résumé
1. COMBUSTION STOECHIOMÉTRIQUE
C’est une combustion idéale, le carburant et le comburant sont dans des proportions qui permettent une combustion
complète du mélange.
1.1. Rapport H/C
Ce rapport, désigné par la lettre y, représente le rapport hydrogène-carbone de l’hydrocarbure utilisé comme carburant.
Ex. : C7H12 = CH1,71 avec H/C = y = 1,71
1.2. Dosage stœchiométrique
Rapport masse de carburant / masse d’air dans les conditions de combustion stoechiométrique
1.3. Pouvoir comburivore : PCO
Masse d’air nécessaire à la combustion complète d’un gramme de carburant (condition stoechiométrique).
1.4. Richesse :
Rapport dosage réel / dosage stoechiométrique =
En condition stœchiométrique, = 1
1.5. Equation de combustion stœchiométrique ( = 1)
CHy + (1+y/4)(O2 + 3,78 N2) CO2 + y/2 H2O + (1 + y/4) 3,78 N2
Remarque : en plus des hydrocarbures (CHy), le carburant comprend d’autres composés tels que l’oxygène
(composés oxygénés de plus en plus utilisés dans la formulation des carburants), et le soufre.
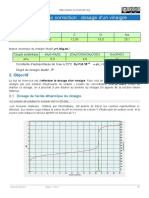
1.6. Relation PCO – H/C
Le PCO augmente avec le rapport H/C du carburant
PCO = f ( H/C )
15,60
15,40
15,20
15,00
14,80
PCO
14,60
14,40
14,20
14,00
13,80
1,5 1,7 1,9 2,1 2,3 2,5
H/C
Franco Trombini – Lycée Claveille Périgueux 1/2
MCI TECHNOLOGIE
2. LA COMBUSTION DANS UN MOTEUR
2.1. Equation générale
L’équation généralement utilisée est :
CHy + n ( O2 + 3,78 N2 ) a CO2 + b H2O + c CO + d H2 + e O2 + f CHy + g N2 + h NOx
On trouve également dans les gaz d’échappement des oxydes de soufre (principalement SO2) et des oxydes d’azote
(NOx), qui dans un but de simplification sont souvent négligés dans les équations, car rencontrés en ppm (partie par
million : 10000 ppm = 1%).
a, b, c, d, e, f, g et h sont liés aux concentrations (% volumique) des gaz correspondants dans les gaz d’échappement.
n dépend de la richesse : n = (1 + y/4 ) /
Pour les moteurs à allumage commandé, varie autour de 1.
Pour les moteurs à allumage par compression, est très inférieur à 1.
2.2. = 1 (dosage stœchiométrique)
La combustion produit à l’échappement du CO2, de l’H2O, et du N2 qui ne fait que traverser la chambre de combustion.
les coefficients c, d, e, et f = 0, on obtient alors :
CHy + (1 + y/4) ( O2 + 3,78 N2 ) CO2 + y/2 H2O + (1 + y/4) 3,78 N2 .
2.3. < 1 (mélange pauvre)
Les gaz d’échappement contiennent de l’oxygène résiduel, dû à l’excès d’air.
En théorie, les coefficients c, d, f et h = 0, on obtient alors :
CHy + n ( O2 + 3,78 N2 ) CO2 + y/2 H2O + (n – 1 – y/4) O2 + 3,78 n N2 .
En réalité, on trouve également, en faible quantité, du CO, de l’H2, des CHy et des NOx.
2.4. > 1 (mélange riche)
En théorie, les coefficients e, f et h = 0, on obtient alors :
CHy + n ( O2 + 3,78 N2 ) a CO2 + (2n – a – 1) H2O + (1 – a) CO + (y/2 – 2n + a + 1 )H2 + 3,78 n N2 .
Le coefficient a peut être défini grâce à une équation supplémentaire fournie par la réaction dite du « gaz à l’eau »,
réaction réversible CO2 + H2 CO + H2O
L’expérience fait apparaître un coefficient K constant 3,8.
K correspond au rapport des teneurs [CO][H2O] / [CO2][H2]
En réalité, on retrouve à l’échappement tous les éléments de l’équation générale.
2.5. Composition théorique des gaz d’échappement (base sèche)
Franco Trombini – Lycée Claveille Périgueux 2/2
Das könnte Ihnen auch gefallen
- NégaTep: Pour réduire les émissions de CO2 de la France d'ici 2050-60Von EverandNégaTep: Pour réduire les émissions de CO2 de la France d'ici 2050-60Noch keine Bewertungen
- 2017 Phys1Dokument11 Seiten2017 Phys1cours importantNoch keine Bewertungen
- Cisko-ibn-SBN Fasicule TD-L3PC-Thermodyn-chim-2018-2019Dokument55 SeitenCisko-ibn-SBN Fasicule TD-L3PC-Thermodyn-chim-2018-2019mame gor fayeNoch keine Bewertungen
- Combustion PDFDokument11 SeitenCombustion PDFfredonbenjaminNoch keine Bewertungen
- 09 Combustion Exerc6Dokument5 Seiten09 Combustion Exerc6KHAOULA AJLANENoch keine Bewertungen
- Chap 1Dokument104 SeitenChap 1MOHNISHKUMARJHA50% (2)
- Cours Gestion Du Froid Chap 6Dokument5 SeitenCours Gestion Du Froid Chap 6Rachid BouchenafaNoch keine Bewertungen
- CombustionDokument6 SeitenCombustionMuhcineNoch keine Bewertungen
- Fabrication Du Gaz de Synthèse: 2 CondDokument6 SeitenFabrication Du Gaz de Synthèse: 2 CondMa LiaNoch keine Bewertungen
- Combustion - Chap 2 PDFDokument18 SeitenCombustion - Chap 2 PDFAlekhya100% (2)
- Exercice1 GC 2023Dokument3 SeitenExercice1 GC 2023Kachemir SarahNoch keine Bewertungen
- Exam Bilan 2022 Avec DDLDokument5 SeitenExam Bilan 2022 Avec DDLvb8p4rx2knNoch keine Bewertungen
- Coupdecoeur2014 CorrigefinalDokument15 SeitenCoupdecoeur2014 Corrigefinalmadadi moradNoch keine Bewertungen
- ChaudièresDokument17 SeitenChaudièresAdil ELNoch keine Bewertungen
- Synth NH3 EDoc RDokument2 SeitenSynth NH3 EDoc Rlilia Bennaceur FarahNoch keine Bewertungen
- CombustionDokument14 SeitenCombustionamouhcine100% (1)
- Cours Thermochimie de La Combustion-Neila MhiriDokument7 SeitenCours Thermochimie de La Combustion-Neila MhiriYossri Sallem100% (1)
- SGE M1 Physico Chimie 2 2 2006Dokument45 SeitenSGE M1 Physico Chimie 2 2 2006Mohamed CHIBANNoch keine Bewertungen
- CombustionDokument28 SeitenCombustionHoucem Eddine MechriNoch keine Bewertungen
- Omposition de Himie NDokument15 SeitenOmposition de Himie Namandine gaianiNoch keine Bewertungen
- Série TD - 03 - OPU - Avec CorrigéDokument4 SeitenSérie TD - 03 - OPU - Avec Corrigéayoubhmdh 420% (1)
- Chapitre II M2 G Petro PARTIE 2 2022Dokument15 SeitenChapitre II M2 G Petro PARTIE 2 2022BoudardaraNoch keine Bewertungen
- Correction DcoDokument3 SeitenCorrection DcomohmedNoch keine Bewertungen
- Cours MGN24Dokument49 SeitenCours MGN24Youcef ZobaaNoch keine Bewertungen
- Contrôle #1 SMI-SMA Thermo-Phy1 - 2010-2011Dokument3 SeitenContrôle #1 SMI-SMA Thermo-Phy1 - 2010-2011ToufikJalalEddineNoch keine Bewertungen
- Fiche Guide GESDokument11 SeitenFiche Guide GESDelNoch keine Bewertungen
- 1 Cours CombustionDokument61 Seiten1 Cours Combustionbadrezzamane100% (1)
- CombustionDokument11 SeitenCombustionMouhamed AbdarrahmaneNoch keine Bewertungen
- Calcul Du FourDokument12 SeitenCalcul Du FourOussama LaribiNoch keine Bewertungen
- 2021 Centres Etrangers ExoB Sujet EsterRhum 5ptsDokument3 Seiten2021 Centres Etrangers ExoB Sujet EsterRhum 5ptsRaphael DEMIANNoch keine Bewertungen
- CoursDokument104 SeitenCoursSidiya DiakiteNoch keine Bewertungen
- Du Pétrole Brut Aux Matériaux OrganiquesDokument2 SeitenDu Pétrole Brut Aux Matériaux OrganiquesmecherguiNoch keine Bewertungen
- GP - 62 Procédés de DépollutionTD - Energies Fossiles Et CombustionDokument2 SeitenGP - 62 Procédés de DépollutionTD - Energies Fossiles Et CombustionAbNoch keine Bewertungen
- Corrigé de La Fiche #3 de Thermodynamiue - L1 - ST-2019-2020Dokument6 SeitenCorrigé de La Fiche #3 de Thermodynamiue - L1 - ST-2019-2020Ñar ĎjesNoch keine Bewertungen
- Devoir ExcelDokument25 SeitenDevoir ExcelrimNoch keine Bewertungen
- Energieplus-Lesite - Be-Combustion Et CombustiblesDokument6 SeitenEnergieplus-Lesite - Be-Combustion Et CombustiblesDjamila BENYOUCEF100% (1)
- M28 Thermo TD3 CorrectionDokument3 SeitenM28 Thermo TD3 CorrectionHassan Driouach100% (1)
- Exam-Corrige Chimie PDFDokument4 SeitenExam-Corrige Chimie PDFNassimaNoch keine Bewertungen
- TD 2 Bilan 2Dokument4 SeitenTD 2 Bilan 2Samira NjifenjouNoch keine Bewertungen
- Combustion Et CombustibleDokument71 SeitenCombustion Et CombustibleBachir NassaNoch keine Bewertungen
- 4-Procédés D'oxydationDokument13 Seiten4-Procédés D'oxydationsaa naaNoch keine Bewertungen
- Thermochimie 2020-1Dokument3 SeitenThermochimie 2020-1Salima SouhilaNoch keine Bewertungen
- Bts Cira U31-SujetDokument6 SeitenBts Cira U31-SujetVeron djonkepNoch keine Bewertungen
- °smc4 TD Thermodynamique Chimique Fsdm-Fes 19-20Dokument23 Seiten°smc4 TD Thermodynamique Chimique Fsdm-Fes 19-20Ayoub OuangliNoch keine Bewertungen
- Exercice Corrigé Sur DosageDokument5 SeitenExercice Corrigé Sur DosageIkram MgNoch keine Bewertungen
- OS Corrige OrganiqueDokument27 SeitenOS Corrige OrganiqueJimmy Wright100% (1)
- 3938 Combustion Sti2dDokument11 Seiten3938 Combustion Sti2dAchraf MoutaharNoch keine Bewertungen
- Web Combustions ExDokument7 SeitenWeb Combustions ExJawad HamritiNoch keine Bewertungen
- Choix Dun Moyen de TransportDokument3 SeitenChoix Dun Moyen de TransportJennyfer SamaniNoch keine Bewertungen
- Exam224 Bepc General Chimie 2021Dokument1 SeiteExam224 Bepc General Chimie 2021amnes69Noch keine Bewertungen
- Chapitre 1 Combustion Et CombustibleDokument79 SeitenChapitre 1 Combustion Et CombustibleRyad AsmaNoch keine Bewertungen
- Corrigé Type de EMD L3 RP 2021 2022Dokument2 SeitenCorrigé Type de EMD L3 RP 2021 2022AZIZI ELHADJ ALINoch keine Bewertungen
- 3938 Combustion Sti2dDokument11 Seiten3938 Combustion Sti2dAghai MohamedNoch keine Bewertungen
- Série N°06: 2NH (G) + 5/2O (G) 2NO (G) + 3H O (G)Dokument5 SeitenSérie N°06: 2NH (G) + 5/2O (G) 2NO (G) + 3H O (G)slbclqrkNoch keine Bewertungen
- Le Diagramme DOstwaldDokument18 SeitenLe Diagramme DOstwaldSafae SabirNoch keine Bewertungen
- Bac - Épreuve de Spécialité Physique-Chimie - Sujet Et Corrigé N°2Dokument11 SeitenBac - Épreuve de Spécialité Physique-Chimie - Sujet Et Corrigé N°2LETUDIANT100% (2)
- TD N°1 CombustionDokument4 SeitenTD N°1 CombustionPaul Julbin NJOCK100% (1)
- 07 590 Conversions Tableau de Correspondance Des Metaux Et AlliagesDokument4 Seiten07 590 Conversions Tableau de Correspondance Des Metaux Et Alliagesnovocaine67Noch keine Bewertungen
- Systeme D Injection D Essence Et D Allumage Gestion Moteur Electronique ME Schema Fonctionnel WDB2Dokument1 SeiteSysteme D Injection D Essence Et D Allumage Gestion Moteur Electronique ME Schema Fonctionnel WDB2andersontiti19Noch keine Bewertungen
- Cours Moteur OualiDokument26 SeitenCours Moteur OualiamelNoch keine Bewertungen
- Dossier Technique Essuie-Glace Bosch de Mercedes PDFDokument6 SeitenDossier Technique Essuie-Glace Bosch de Mercedes PDFKhalil FrikhaNoch keine Bewertungen
- AutoDokument116 SeitenAutoAhmedNoch keine Bewertungen
- Pfa 2018Dokument32 SeitenPfa 2018Gse Ingénieur100% (2)
- Moteur À CombustionDokument34 SeitenMoteur À Combustionrafcarl100% (6)
- Carnet D'entretien PeugeotDokument52 SeitenCarnet D'entretien PeugeotMed Ali JendoubiNoch keine Bewertungen
- Chap 2 PDFDokument6 SeitenChap 2 PDFMoh Abd BenNoch keine Bewertungen
- Procedure de Mise en Service D'un Train de LiquefactionDokument3 SeitenProcedure de Mise en Service D'un Train de LiquefactionSofiane HalimiNoch keine Bewertungen
- Manual Partes Torre de Iluminacion LT4Dokument28 SeitenManual Partes Torre de Iluminacion LT4Sergio TrejoNoch keine Bewertungen
- Le Secteur Automobile Au BrésilDokument4 SeitenLe Secteur Automobile Au BrésilEtienne64Noch keine Bewertungen
- Stage de 4ème Année - TexteDokument44 SeitenStage de 4ème Année - TexteRaul PrimonNoch keine Bewertungen
- Control Motor Perkins 1104D PDFDokument24 SeitenControl Motor Perkins 1104D PDFIordan Adrian100% (1)
- Caracteristiques MoteurDokument5 SeitenCaracteristiques MoteurClivv B1Noch keine Bewertungen
- 2935 2752 32 FRLR - tcm823-1706662Dokument2 Seiten2935 2752 32 FRLR - tcm823-1706662Ayoub SolhiNoch keine Bewertungen
- Machines ThermiquesDokument15 SeitenMachines ThermiquesntabNoch keine Bewertungen
- Expose Lundi Matin MouleDokument21 SeitenExpose Lundi Matin MouleSeif Habbachi100% (1)
- Elaboration Des Fontes Et Des Aciers 1PT4 Promotion 2008à l'IPEIEMDokument52 SeitenElaboration Des Fontes Et Des Aciers 1PT4 Promotion 2008à l'IPEIEMAkram Ben Khemis91% (11)
- Schema Electrique Velsatis Et Laguna II PDFDokument17 SeitenSchema Electrique Velsatis Et Laguna II PDFNaoufel Akr80% (5)
- Moteur Diesel Marin Alimenté Au Méthanol - Rapport de SéminaireDokument10 SeitenMoteur Diesel Marin Alimenté Au Méthanol - Rapport de Séminairenacer zidiNoch keine Bewertungen
- Ssiap 1Dokument158 SeitenSsiap 1ludovic197050% (2)
- T22KDokument6 SeitenT22KNainah LalaNoch keine Bewertungen
- 1997 SeaDoo XP (5662) Parts CatalogDokument103 Seiten1997 SeaDoo XP (5662) Parts CatalogCharles SignoreNoch keine Bewertungen
- Chapitre I Generalites Sur Les Moteurs A PistonsDokument13 SeitenChapitre I Generalites Sur Les Moteurs A PistonszeblaouarNoch keine Bewertungen
- Chapitre 1 - CopieDokument8 SeitenChapitre 1 - CopieBassirou GueroNoch keine Bewertungen
- Moteur Pour Aéromodélisme DDokument4 SeitenMoteur Pour Aéromodélisme DAymane MouhssineNoch keine Bewertungen
- Principe de Fonctionnement Du Moteur 4 TempsDokument10 SeitenPrincipe de Fonctionnement Du Moteur 4 Tempsibrahim rabbajNoch keine Bewertungen
- Tous Sur Les HuilesDokument74 SeitenTous Sur Les HuilesTM125Noch keine Bewertungen
- RAPPORT de Mehdi EddehbiDokument53 SeitenRAPPORT de Mehdi EddehbiRédouàne Eddahbi100% (1)