Beruflich Dokumente
Kultur Dokumente
Rodrigo Rafael Ricardo Paredes
Hochgeladen von
Jesus Chavez RodriguezOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Rodrigo Rafael Ricardo Paredes
Hochgeladen von
Jesus Chavez RodriguezCopyright:
Verfügbare Formate
PRÁCTICA No.
VELOCIDAD DE REACCIÓN EN MICROESCALA
OBJETIVOS
Adaptación de una práctica convencional, elegida entre las que cumplen los requisitos de Reactores
Químicos, para su realización en microescala. Con esta adaptación se persiguen varios objetivos: a)
determinar la velocidad de una reacción, b) concienciación de los estudiantes en materia de
sostenibilidad por medio de la realización de esta práctica de laboratorio bajo los criterios de “Química
Verde” y “Trabajo en Microescala”, c) disminuir los costos económicos asociados al consumo de
reactivos, y d) disminuir la generación de residuos.
FUNDAMENTOS TEÓRICOS
La rapidez con la que se produce una transformación química es un aspecto muy importante. Tanto
desde el punto de vista del conocimiento del proceso como de su utilidad industrial, interesa conocer
la velocidad de la reacción y los factores que pueden modificarla.
Se define la velocidad de una reacción química como la cantidad de sustancia formada (si tomamos
como referencia un producto) o transformada (si tomamos como referencia un reactivo) por unidad
de tiempo.
La velocidad de reacción no es constante. Al principio, cuando la concentración de reactivos es mayor,
también es mayor la probabilidad de que se den choques entre las moléculas de reactivo, y la
velocidad es mayor. a medida que la reacción avanza, al ir disminuyendo la concentración de los
reactivos, disminuye la probabilidad de choques y con ella la velocidad de la reacción. La medida de
la velocidad de reacción implica la medida de la concentración de uno de los reactivos o productos a
lo largo del tiempo, esto es, para medir la velocidad de una reacción necesitamos medir, bien la
cantidad de reactivo que desaparece por unidad de tiempo, bien la cantidad de producto que aparece
por unidad de tiempo. La velocidad de reacción se mide en unidades de concentración/tiempo, esto
es, en moles/s.
El aumento de la concentración de los reactivos hace más probable el choque entre dos moléculas de
los reactivos, con lo que aumenta la probabilidad de que entre estos reactivos se de la reacción. En el
caso de reacciones en estado gaseoso la concentración de los reactivos se logra aumentando la
presión, con lo que disminuye el volumen.
La velocidad de una reacción depende generalmente de la temperatura, la presión y las
concentraciones de las especies involucradas en ella. También puede depender de la fase o fases en
las que ocurre la reacción.
PRE-REPORTE
1- Proponer las ecuaciones integradas de velocidad de reacción para un sistema de orden cero,
primer y segundo orden.
2- Investigar los métodos experimentales para determinar velocidades de reacción
3- Generar un diagrama de flujo de proceso de la producción de biodiesel catalizada por una
base.
MATERIALES Y REACTIVOS
Materiales Reactivos
Matraz aforado de 10 mL (3) Azul de metileno
Erlenmeyer 3 mL (5) 10 ml hidróxido de sodio (0.5 M)
Vaso de precipitados de 10 mL (5) 10 ml ácido ascórbico (0.5 M)
Magneto Metanol (2 mL)
Parrilla de calentamiento con agitación Agua destilada
magnética Aceite vegetal (10 mL)
Gafas protectoras
Embudo de separación
PROCEDIMIENTO EXPERIMENTAL
Experimento 1 (Decoloración de azul de metileno por descomposición catalítica de H 2O2):
Preparar una solución stock de 10 ml (65 mg/L) de azul de metileno. En 5 vasos de precipitados de 10
mL, agregar 1.0 ml de la solución anterior medidos con la microgeringa (insulina). Posteriormente
agregar 1.0 ml de la solución de NaOH y enseguida 0.3, 0.6, 0.8, 1.0 y 1.2 mL de la solución de ácido
ascórbico respectivamente. Dejar que se lleve a cabo la degradación del color y medir el tiempo
requerido (hasta que la solución se torne transparente). Colocar como fondo de las muestras una hoja
de papel blanco.
Experimento 2 (Reacción de transesterificación catalizada por NaOH):
Se añade el hidróxido de sodio a un Erlenmeyer de 25 ml que contiene 2 ml de metanol (> 99% de
pureza), y se agita vigorosamente hasta que se disuelva. Se calienta el aceite vegetal (10 mL) hasta
unos 40 ºC en un vaso de precipitados de 25 ml. Se agrega a la disolución metanólica de hidróxido
sódico, sin dejar de agitar. Al principio, la mezcla aparece turbia, pero pronto se aprecia que se separan
dos fases. Se sigue agitando durante 20 min. El contenido del Erlenmeyer se pasa a un embudo de
decantación de 50 ml, para separar la mezcla en dos fases. El glicerol se va al fondo, y el éster metílico
(bio-diésel) flota sobre él. Dejar en el embudo durante 1 hora. Separar las dos fases en dos vasos de
precipitados. Pesar las cantidades recogidas.
ANÁLISIS Y DISCUSIÓN DE RESULTADOS
Experimento 1:
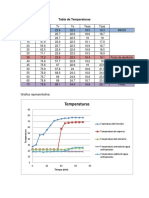
a) Llenar la tabla siguiente con la información correspondiente:
Azul de metileno NaOH Ácido ascórbico Tiempo
65 mg/L 0.5 M 0.5 M decoloración, s
1 mL 1 mL 0.10
1 mL 1 mL 0.15
1 mL 1 mL 0.20
1 mL 1 mL 0.25
1 mL 1 mL 0.30
a) Proponer el mecanismo de degradación de un colorante por descomposición de peróxido de
hidrógeno vía catálisis heterogénea.
b) Generar el gráfico de tiempo de degradación vs concentración de H 2O2 para ambos
colorantes.
c) Calcular la constante de velocidad de reacción en cada caso.
Experimento 2.
a) Proponer la reacción química de transesterificación entre un triglicérido (aceite vegetal) y
metanol, catalizados por hidróxido de sodio.
b) Determinar el porcentaje de rendimiento de la reacción
c) Para una conversión máxima en la reacción de transesterificación, ¿qué variable (s) deben
manipularse?
d) ¿En el caso particular de la síntesis realizada, qué efecto produciría un aumento o disminución
de la cantidad de catalizador utilizado?
e) Realizar un análisis por espectroscopía infrarroja del producto principal obtenido en el
experimento 1 (biodiesel).
f) Suponiendo el escalamiento del proceso de síntesis del biodiesel, explicar cuál sería el modo
de operación recomendable (reactor batch, CSTR, PFR o PBR)?
CONCLUSIONES
BIBLIOGRAFÍA
1. Smith, J. M., Ingeniería de la Cinética Química, 3ª. Edición, México, Compañía Editorial
Continental, 1991.
2. Levespiel, O., Chemical Reactor Engineering, 3ª. Edición, New York, Wiley, 1998.
3. H. Scott Fogler, Elements of Chemical Reaction Enginering, Fourth Edition, 2006, Prentice
Hall International Series
Das könnte Ihnen auch gefallen
- 008.cinética y Equilibrio QuímicoDokument9 Seiten008.cinética y Equilibrio QuímicoluisNoch keine Bewertungen
- Equipo 1 - Reporte Practica 1Dokument8 SeitenEquipo 1 - Reporte Practica 1Anayuri TrejoNoch keine Bewertungen
- 20-2019-Laboratorio 8Dokument3 Seiten20-2019-Laboratorio 8Camila ContrerasNoch keine Bewertungen
- Informe 4 - Cinética QuímicaDokument14 SeitenInforme 4 - Cinética QuímicaElizabeth HuamaniNoch keine Bewertungen
- 03 - Tablas Termodinamica - Van WylenDokument12 Seiten03 - Tablas Termodinamica - Van WylenDiego Medrano Hidalgo100% (1)
- Ejercicios Quimica UndécimoDokument8 SeitenEjercicios Quimica Undécimonaomy juanita vanegas garzonNoch keine Bewertungen
- FCQ3Dokument10 SeitenFCQ3Ana MuñozNoch keine Bewertungen
- Informe 7 FisicoquimicaDokument11 SeitenInforme 7 FisicoquimicaMichael Alexander Baltazar CondorNoch keine Bewertungen
- Práctica 2. Constante de Equilibrio KCDokument16 SeitenPráctica 2. Constante de Equilibrio KCKaren AyalaNoch keine Bewertungen
- EstequiDokument11 SeitenEstequiBriggitte RodríguezNoch keine Bewertungen
- Práctica 4. Velocidad de Una Reacción QuímicaDokument6 SeitenPráctica 4. Velocidad de Una Reacción QuímicaBrayan GuttierrezNoch keine Bewertungen
- CyR - P4 - Velocidad de Reacción - A - MISCDokument10 SeitenCyR - P4 - Velocidad de Reacción - A - MISCMaria Isabel SanchezNoch keine Bewertungen
- Prereporte Cinetica QuimicaDokument6 SeitenPrereporte Cinetica QuimicaGabriel MoralesNoch keine Bewertungen
- Correccion. - Laboratorio Integral 2. - Práctica 14. - Reacción IónicaDokument17 SeitenCorreccion. - Laboratorio Integral 2. - Práctica 14. - Reacción IónicaDavidHerreraNoch keine Bewertungen
- G8 - Cinética QuímicaDokument9 SeitenG8 - Cinética QuímicaNeeiVidarteEspinoNoch keine Bewertungen
- Modulo 6 - 2020Dokument18 SeitenModulo 6 - 2020Gisex Von LouzerNoch keine Bewertungen
- Trabajo Práctico #08, Velocidad de ReacciónDokument9 SeitenTrabajo Práctico #08, Velocidad de ReacciónMauro GardinettiNoch keine Bewertungen
- Balance de Materia Con Reaccion Quimica Hidratacion de Anhidrido AceticoDokument9 SeitenBalance de Materia Con Reaccion Quimica Hidratacion de Anhidrido AceticoANAHI ALVARADO TOLENETINONoch keine Bewertungen
- Balance de Materia Con Reacción Química: Hidratación de Anhídrido AcéticoDokument9 SeitenBalance de Materia Con Reacción Química: Hidratación de Anhídrido AcéticoFernando0% (1)
- Muñoz Ramírez S - Orta Pérez O - Ortíz Marín DM - PL1Dokument20 SeitenMuñoz Ramírez S - Orta Pérez O - Ortíz Marín DM - PL1Osmyy OrtaNoch keine Bewertungen
- Practica 3 LIQDokument10 SeitenPractica 3 LIQLuis Fernando Gomez GuzmanNoch keine Bewertungen
- Practica 6 LabDokument7 SeitenPractica 6 LabHnzNoch keine Bewertungen
- Reporte Práctica 7Dokument3 SeitenReporte Práctica 7cristo JiménezNoch keine Bewertungen
- Labs3 - Cinética QuímicaDokument4 SeitenLabs3 - Cinética QuímicaCamila Helena Arevalo PeraltaNoch keine Bewertungen
- Metodo TitrimétricoDokument12 SeitenMetodo Titrimétricoangelkgm2475% (4)
- Constante de EquilibrioDokument8 SeitenConstante de EquilibrioMaggyBalcazarNoch keine Bewertungen
- Subtema 2.3 Practica de Metodos de Velocidad de Reaccion 2Dokument9 SeitenSubtema 2.3 Practica de Metodos de Velocidad de Reaccion 2Adán Fonseca HernandezNoch keine Bewertungen
- Estequiometria de Las ReaccionesDokument3 SeitenEstequiometria de Las ReaccionesLuis ZárateNoch keine Bewertungen
- Laboratorio de Equilibrio Quimico-2021-1Dokument12 SeitenLaboratorio de Equilibrio Quimico-2021-1VICTOR ENRIQUE QUISPE SAMANEZNoch keine Bewertungen
- PRACTICA 11.2 CatalizadoresDokument6 SeitenPRACTICA 11.2 CatalizadoresCari CarinaNoch keine Bewertungen
- 2da Guia de PreguntasDokument3 Seiten2da Guia de PreguntasAna Sofía Molina OrtegaNoch keine Bewertungen
- Manual de FisicoquimicaDokument37 SeitenManual de FisicoquimicaAriza CarmenNoch keine Bewertungen
- CINETICA QUIMICA MG - HCLDokument6 SeitenCINETICA QUIMICA MG - HCLMinerosAguilarNoch keine Bewertungen
- ALIS Práctica de EstandarizaciónDokument11 SeitenALIS Práctica de EstandarizaciónVivi Mar CSiNoch keine Bewertungen
- Equipo 6 - Práctica 5Dokument5 SeitenEquipo 6 - Práctica 5Nazza ReyezNoch keine Bewertungen
- Orden de Reacción LaboratorioDokument12 SeitenOrden de Reacción LaboratorioLuciaNoch keine Bewertungen
- Guia de Trabajo PracticoQUIMICADokument13 SeitenGuia de Trabajo PracticoQUIMICAmarlon aliaga felipeNoch keine Bewertungen
- Informe 9-Cinetica QuímicaDokument6 SeitenInforme 9-Cinetica QuímicaMari NarvaezNoch keine Bewertungen
- TERBUTILODokument5 SeitenTERBUTILOjuanka0426Noch keine Bewertungen
- Practica No. 2 Principio de Le ChatelierDokument4 SeitenPractica No. 2 Principio de Le ChatelierAlfredo GarcíaNoch keine Bewertungen
- P-10 Calculos EstequiometricosDokument7 SeitenP-10 Calculos Estequiometricosjose david de arco de avilaNoch keine Bewertungen
- Manual de Laboratorio de Quimica AnaliticaDokument7 SeitenManual de Laboratorio de Quimica AnaliticaJESUS FRANCISCO DUARTENoch keine Bewertungen
- Laboratorio de Quimica GeneralDokument8 SeitenLaboratorio de Quimica GeneralGiovani Periche PachecoNoch keine Bewertungen
- Practica # 6. Degradación de Una Solución de MetilenoDokument5 SeitenPractica # 6. Degradación de Una Solución de MetilenoPaula PechenéNoch keine Bewertungen
- 008.cinética y Equilibrio QuímicoDokument5 Seiten008.cinética y Equilibrio QuímicoBoris Fabian Agaon BurbanoNoch keine Bewertungen
- Lab. Quimica2Dokument6 SeitenLab. Quimica2Wilmer Castro RoblesNoch keine Bewertungen
- Quimica IIDokument24 SeitenQuimica IIatila117Noch keine Bewertungen
- Manual de Prácticas de Reactores QuímcosDokument35 SeitenManual de Prácticas de Reactores QuímcosHéctor Alejandro Serrano Ortiz0% (1)
- Practica 4 CINETICADokument3 SeitenPractica 4 CINETICALulú Olvera SalgadoNoch keine Bewertungen
- Manual de Prácticas. CqybDokument32 SeitenManual de Prácticas. CqybjuansalvadorgarciaheNoch keine Bewertungen
- Practica N 7 Informe de LaboratorioDokument20 SeitenPractica N 7 Informe de LaboratorioElizabethVargasNoch keine Bewertungen
- Practica 11Dokument20 SeitenPractica 11Thania GarciaNoch keine Bewertungen
- p1 Ricardez Roman YazminDokument6 Seitenp1 Ricardez Roman YazminRicardez Román YazmínNoch keine Bewertungen
- Formato de Informe QADokument9 SeitenFormato de Informe QAJuan Jurado CoboNoch keine Bewertungen
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadVon EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadNoch keine Bewertungen
- El cianuro en la minería. Efectos sobre las plantas acuaticasVon EverandEl cianuro en la minería. Efectos sobre las plantas acuaticasNoch keine Bewertungen
- CALCULOSDokument2 SeitenCALCULOSJesus Chavez RodriguezNoch keine Bewertungen
- Tecnológico de Estudios Superiores de JocotitlánDokument6 SeitenTecnológico de Estudios Superiores de JocotitlánJesus Chavez RodriguezNoch keine Bewertungen
- Gas NaturalDokument4 SeitenGas NaturalJesus Chavez RodriguezNoch keine Bewertungen
- Practica de Naranja.Dokument8 SeitenPractica de Naranja.Jesus Chavez RodriguezNoch keine Bewertungen
- Describir El Siguiente Diagrama de ProcesoDokument1 SeiteDescribir El Siguiente Diagrama de ProcesoJesus Chavez RodriguezNoch keine Bewertungen
- Introducción Liquido LiquidoDokument1 SeiteIntroducción Liquido LiquidoJesus Chavez RodriguezNoch keine Bewertungen
- Ejercicios TraducidosDokument14 SeitenEjercicios TraducidosJesus Chavez RodriguezNoch keine Bewertungen
- Muc ImexDokument4 SeitenMuc ImexJesus Chavez RodriguezNoch keine Bewertungen
- Práctica No. 3 ReactoresDokument4 SeitenPráctica No. 3 ReactoresJesus Chavez RodriguezNoch keine Bewertungen
- Ejercicio de Tarea de Ractores PFRDokument3 SeitenEjercicio de Tarea de Ractores PFRJesus Chavez RodriguezNoch keine Bewertungen
- Unidad III - No Idealidad en Reactores QuímicosDokument21 SeitenUnidad III - No Idealidad en Reactores QuímicosJesus Chavez Rodriguez100% (3)
- Práctica No. 3 ReactoresDokument4 SeitenPráctica No. 3 ReactoresJesus Chavez RodriguezNoch keine Bewertungen
- Torre Absorcion Pag 15 PDFDokument56 SeitenTorre Absorcion Pag 15 PDFomarlibardoNoch keine Bewertungen
- Columna de AbsorcionDokument4 SeitenColumna de AbsorcionJesus Chavez RodriguezNoch keine Bewertungen
- Destilación Diferencial FLASHEOODokument4 SeitenDestilación Diferencial FLASHEOOJulian Solo JulainNoch keine Bewertungen
- EjerciciosDokument7 SeitenEjerciciosJesus Chavez RodriguezNoch keine Bewertungen
- 1646488710.destilación DiferencialDokument1 Seite1646488710.destilación DiferencialJesus Chavez RodriguezNoch keine Bewertungen
- Encuesta de OpinionDokument3 SeitenEncuesta de OpinionJesus Chavez RodriguezNoch keine Bewertungen
- Ejercicio 5 TareaDokument2 SeitenEjercicio 5 TareaJesus Chavez RodriguezNoch keine Bewertungen
- 1646488710.destilación DiferencialDokument1 Seite1646488710.destilación DiferencialJesus Chavez RodriguezNoch keine Bewertungen
- 13 SepDokument9 Seiten13 SepJesus Chavez RodriguezNoch keine Bewertungen
- Ejercicio 3Dokument2 SeitenEjercicio 3Jesus Chavez RodriguezNoch keine Bewertungen
- Planteamiento Del ProblemaDokument1 SeitePlanteamiento Del ProblemaJesus Chavez RodriguezNoch keine Bewertungen
- Documento CompletoDokument263 SeitenDocumento CompletoAngie AyusawaNoch keine Bewertungen
- Conclusion EsDokument1 SeiteConclusion EsJesus Chavez RodriguezNoch keine Bewertungen
- Destilación Diferencial FLASHEOODokument4 SeitenDestilación Diferencial FLASHEOOJulian Solo JulainNoch keine Bewertungen
- Reacciones DetergenteDokument6 SeitenReacciones DetergenteJesus Chavez RodriguezNoch keine Bewertungen
- Procesos de La Fabricacion de CerealDokument1 SeiteProcesos de La Fabricacion de CerealJesus Chavez RodriguezNoch keine Bewertungen
- De PriesterDokument4 SeitenDe PriesterJesus Chavez RodriguezNoch keine Bewertungen
- Practica 1 PeroxiboratoDokument3 SeitenPractica 1 PeroxiboratoDavis BernardoNoch keine Bewertungen
- Rio SurcoDokument12 SeitenRio SurcoEdson Falcon VilelaNoch keine Bewertungen
- Ficha Técnica Ultra 90Dokument1 SeiteFicha Técnica Ultra 90jose rodriguezNoch keine Bewertungen
- Ensayo de TermodinámicaDokument5 SeitenEnsayo de TermodinámicaLEIDY VANESSA VELASQUEZ CORRALESNoch keine Bewertungen
- Sintesis de AnilinaDokument8 SeitenSintesis de AnilinaCristian David Hurtado PeñaNoch keine Bewertungen
- Grado Practicas 2 Q InorganicaDokument82 SeitenGrado Practicas 2 Q InorganicaCesarNoch keine Bewertungen
- Apuntes Termodinámica MEC315 PDFDokument109 SeitenApuntes Termodinámica MEC315 PDFCristianNoch keine Bewertungen
- La Unidad Hace La Fuerza Leonel TuchezDokument3 SeitenLa Unidad Hace La Fuerza Leonel TuchezKaren Lucrecia Ardon RomeroNoch keine Bewertungen
- Guia 5 Grado 10 - Fisica - Coefciciente de FriccionDokument5 SeitenGuia 5 Grado 10 - Fisica - Coefciciente de FriccionLcb BlomNoch keine Bewertungen
- Ejercicios Con Respuestas de Leyes de Gases IdealesDokument1 SeiteEjercicios Con Respuestas de Leyes de Gases IdealesJosé Chávez50% (2)
- Tronadura ControladaDokument24 SeitenTronadura ControladaRodo ACNoch keine Bewertungen
- Física Avanzada.U1 y U2 EJERCICIOS DE CLASEDokument6 SeitenFísica Avanzada.U1 y U2 EJERCICIOS DE CLASEDaniel Mu�oz JuarezNoch keine Bewertungen
- Fenoles Eteres TiolesDokument24 SeitenFenoles Eteres TiolesCLAUDIA MARIBELLNoch keine Bewertungen
- 2 Potencial ElectricoDokument16 Seiten2 Potencial ElectricoDavid ToncelNoch keine Bewertungen
- El Clima G-H-CDokument13 SeitenEl Clima G-H-CJosé Miguel Salazar MalaveNoch keine Bewertungen
- Practica 4 Identif Aminoacidos Con CuestionarioDokument8 SeitenPractica 4 Identif Aminoacidos Con CuestionarioOsmara Cabello RoldanNoch keine Bewertungen
- FORJADokument4 SeitenFORJAfamd mdNoch keine Bewertungen
- Articulo Infrarrojo Con Ejemplo Ir Aceite Soja UsadoDokument10 SeitenArticulo Infrarrojo Con Ejemplo Ir Aceite Soja UsadoJorge EsquerreNoch keine Bewertungen
- 2023 Turbomáqinas Rev01Dokument329 Seiten2023 Turbomáqinas Rev01Clemente FigueroaNoch keine Bewertungen
- Tareas Teoria Cuantica Tema 1 - TAREA1Dokument7 SeitenTareas Teoria Cuantica Tema 1 - TAREA1PedtroNoch keine Bewertungen
- Challenger Noticia LecturónDokument2 SeitenChallenger Noticia Lecturóngrisgando0% (1)
- 7 M.A. Modelos AtomicosDokument1 Seite7 M.A. Modelos AtomicosMaria M oraNoch keine Bewertungen
- Envasado de Formas Farmaceuticas LiquidasDokument14 SeitenEnvasado de Formas Farmaceuticas LiquidasQF TeranNoch keine Bewertungen
- Quiz Riesgo Tecnologico PlataformaDokument2 SeitenQuiz Riesgo Tecnologico PlataformaBrigitt100% (1)
- Enlaces PeptídicosDokument9 SeitenEnlaces PeptídicosJosue DavilaNoch keine Bewertungen
- Hidrostatica 1 2021Dokument22 SeitenHidrostatica 1 2021asdfghjk asdfghjkNoch keine Bewertungen
- CAPITULO 4 Fenomenos Electricos de InterfaseDokument50 SeitenCAPITULO 4 Fenomenos Electricos de InterfaseDiego Ignacio Cabrera Alvarez100% (1)
- Diagrama de Flujo-GlucosaDokument1 SeiteDiagrama de Flujo-GlucosaLivier Alejandra Torres Rueda100% (2)
- Practica 5 FotocatalisisDokument11 SeitenPractica 5 FotocatalisisPaola RamirezNoch keine Bewertungen