Beruflich Dokumente
Kultur Dokumente
Labo Final 5 Fiqui 2
Hochgeladen von
Kevin Dominguez ValenciaOriginalbeschreibung:
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Labo Final 5 Fiqui 2
Hochgeladen von
Kevin Dominguez ValenciaCopyright:
Verfügbare Formate
UNIVERSIDAD NACIONAL DE INGENIERIA
FACULTAD DE INGENIERIA QUIMICA Y TEXTIL
LABORATORIO DE FISICOQUÍMICA II
INFORME Nº 5
TITULACIONES CONDUCTIMÉTRICAS
Estudiantes:
Domínguez Valencia Kevin
Escudero Cajavilca Alfonso
Lazo Camargo Geraldine V.
Profesora encargada:
Dra. Ing. Paucar Cuba, Karin
Periodo Académico: 2016-1
Fecha de presentación del informe: 18/05/16
LIMA – PERÚ
Laboratorio de Fisicoquímica II Página 1
ÍNDICE
1. Objetivo…………………………………………………………………………....3
2. Fundamento Teórico………………………………………………………..3-4
3. Datos…………………………………………………………………………….…5-16
4. Discusión de resultados……………………………………………………16
5. Conclusiones……………………………………………………………………16
6. Anexo…………………………………………………………………..………….17
7. Bibliografía…………………………………………………………………..…….18
Laboratorio de Fisicoquímica II Página 2
TITULACIONES CONDUCTIMÉTRICAS
1. OBJETIVO:
Estudiar el comportamiento de los electrolitos débiles y fuertes y sus
conductividades en la detección de los puntos finales de la titulación.
2. FUNDAMENTO TEÓRICO:
Titulaciones Conductimétricas:
El agregado de un electrolito a una solución de otro electrolito bajo condiciones
que no producen un cambio apreciable en el volumen, afectar a la conductancia de
la solución dependiendo de si ocurren o no reacciones químicas. Si no ocurre una
reacción iónica, tal como en el agregado de una sal simple a otra (por ejemplo,
agregado de cloruro de potasio a una solución de nitrato de sodio), la conductancia
simplemente aumentará. Si ocurre una reacción iónica, la conductancia puede
aumentar o disminuir; en efecto, con el agregado de una base a un ácido fuerte, la
conductancia decrece debido al reemplazo del ion hidrógeno de alta conductividad
por otro catión de conductividad más baja. Este es el principio subyacente en las
titulaciones conductimétricas, es decir, la sustitución de iones con cierta
conductividad por iones con diferente conductividad.
Consideremos cómo cambiará la conductancia de una solución de un electrolito
fuerte A+B luego del agregado de un reactivo C+D-, suponiendo que A+ (que es el
analito) reacciona con D- del reactivo titulante. Si el producto de la reacción AD es
escasamente soluble o escasamente ionizado, la reacción se puede escribir:
A+B− + C+D− ←→ AD + C+B−
En la reacción entre A+ y D -, los iones A+ son reemplazados por C+ durante la
titulación. A medida que avanza la titulación, la conductancia aumenta o disminuye
dependiendo de si la conductancia de C+ es mayor o menor que la de A+.
Durante el progreso de la neutralización, precipitación, etc., se pueden esperar, en
general, cambios en la conductividad y ello se puede emplear para determinar el
punto final. Una titulación conductimétrica implica la medición de la conductancia
de la muestra luego de sucesivos agregados de reactivo titulante. Se determina el
punto final en un gráfico de conductancia o conductancia específica en función del
volumen de titulante agregado. Estas curvas de titulación tienen una variedad de
formas dependiendo del sistema químico en investigación. En general, sin
Laboratorio de Fisicoquímica II Página 3
embargo, están caracterizadas por porciones de líneas rectas con pendientes
diferentes a cada lado del punto de equivalencia
3. Datos y resultados
3.1. Datos bibliográficos:
Curva de titulación conductimétrica de HCl 0.001 M con NaOH
Laboratorio de Fisicoquímica II Página 4
Curva de titulación conductimétrica de HAc 0.001 M con NaOH
Curva de titulación conductimétrica de HCl 0.001 M y HAc 0.001 M con NaOH
3.2 DATOS EXPERIMENTALES:
1. Cálculos y resultados
Determinando la concentración del NaOH para cada experiencia.
El primer paso, es estandarizar la solución de hidróxido de sodio; que se hará con el ftalato
ácido de potasio, al cual se le añadió 50 mL de agua y 3 gotas de fenolftaleína para luego pasar
a titularlo con NaOH.
#Eq. Acido=#Eq. Base
𝑾𝒔𝒂𝒍
𝑷.𝑴 = [NaOH] xVNaOH
( )
𝜽
* P.M=204.23 g/mol
*ϴ=1
*VNaOH= 12.9 mL
* Masa de ftalato=0.25 g.
Laboratorio de Fisicoquímica II Página 5
𝟎.𝟐𝟓 𝒈
𝟐𝟎𝟒.𝟐𝟑𝒈/𝒎𝒐𝒍 = [NaOH] x12.9 mL
( 𝟏
)
[NaOH]=0.095 M
Y es así como obtenemos la concentración de nuestra experiencia, de igual manera,
empleando la misma operación, obtendremos la concentración para cada muestra
respectivamente:
1. [NaOH]1 =0.095 M
2. [NaOH]2 =0.09067 M
3. [NaOH]3 =0.095 M
4. [NaOH]4 =0.0979 M
5. [NaOH]5 =0.095 M
Para hallar el [NaOH] prom. , consideraremos todos los datos a excepción del segundo
dato, que se encuentra lejos de nuestro [NaOH] teórico= 0.1 M:
[𝐍𝐚𝐎𝐇]𝟏+[𝐍𝐚𝐎𝐇]𝟑+[𝐍𝐚𝐎𝐇]𝟒+[𝐍𝐚𝐎𝐇]𝟓
[NaOH] prom.=
𝟒
[NaOH] prom.=0.0957 M
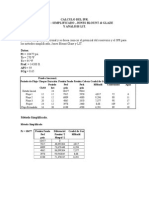
1er Experimento: Grupo N° 1 (KAGUA (µS/cm)=10.49)
Se trabaja con HCl (ac) y NaOH (ac), el primer paso es estandarizar la solución de hidróxido de
sodio esto se hará con el ftalato ácido de potasio.
Se pesa el ftalato y se iguala el número de moles:
#Eq. Acido=#Eq. Base
𝑾𝒔𝒂𝒍
𝑷.𝑴 = [NaOH] xVNaOH
( 𝜽 )
[NaOH]=0.095 M
Ahora procederemos a titular el ácido clorhídrico con el NaOH y medir la conductancia
simultáneamente para diferentes volúmenes, a continuación se grafican los puntos para cada
1mL de NaOH titulado:
Laboratorio de Fisicoquímica II Página 6
VNaOH (Km-Kagua)
(ml) (mS/cm)
0 5.66
1 5.34
2 4.98
3 4.60
4 4.26
5 3.94
6 3.61
7 3.28
6
8 2.96
9 2.66
5
10 2.34
11 2.07
4
Conductancia
12 1.77
13 1.49
3
14 1.48
15 1.62
2
16 1.80
17 1.98
18 2.17 1
19 2.34
20 2.51 0
0 5 10 15 20 25 30 35
21 2.68
22 2.84 Vomunen de NaOH
23 3.00
24 3.18
25 3.35
26 3.50
27 3.66
28 3.81
29 3.95
Se procede a hacer un ajuste de las dos rectas y se halla la intersección:
Ecuación 1:
K = -0.3089* VNaOH + 5.5152 ; R² = 0.9935
Ecuación 2:
K = 0.1673*VNaOH - 0.8546 ; R² = 0.9993
Igualando las ecuaciones:
-0.3089* VNaOH + 5.5152=0.1673*VNaOH - 0.8546
6.3698=0.4762* VNaOH
VNaOH= 13.3763 mL
Laboratorio de Fisicoquímica II Página 7
Hallando la concentración del ácido clorhídrico HCl(ac):
[NaOH]*VNaOH=[HCl]*VHCl
0.095*13.3763mL= [HCl]*15mL
[HCl]=0.0847 M
2do Experimento: Grupo N° 2 (KAGUA (µS/cm)= 8.31)
Se trabaja con CH3COOH (ac) y NaOH (ac), el primer paso es estandarizar la solución de hidróxido
de sodio esto se hará con el ftalato ácido de potasio. Se pesa el ftalato y se iguala el número de
moles:
#Eq. Acido=#Eq. Base
𝑾𝒔𝒂𝒍
𝑷.𝑴 = [NaOH] xVNaOH
( )
𝜽
[NaOH]=0.095 M
Ahora procederemos a titular el ácido clorhídrico con el NaOH y medir la conductancia
simultáneamente para diferentes volúmenes, a continuación se grafican los puntos para cada
1mL de NaOH titulado:
Laboratorio de Fisicoquímica II Página 8
VNaOH (Km-Kagua)
(ml) (µS/cm)
0.00 216.69
0.2 200.69
0.4 191.69
0.6 186.49
0.8 184.89 5000
1 187.42
4500
2 231.69
3 292.69 4000
4 366.69 3500
5 443.69
Conductancia
6 513.69 3000
7 589.69 2500
8 659.69
2000
9 725.69
10 794.69 1500
11 865.69 1000
12 930.69
13 994.69 500
14 1062.69 0
15 1121.69 0 10 20 30 40 50
16 1184.69 Volumen de NaOH
17 1244.69
18 1336.69
19 1499.69
20 1677.69
21 1847.69
22 2021.69
23 2191.69
24 2361.69
25 2531.69
26 2691.69
27 2851.69
28 3001.69
29 3161.69
30 3321.69
31 3461.69
32 3611.69
33 3761.69
34 3901.69
35 4041.69
36 4181.69
37 4321.69
38 4461.69
39 4601.69
40 4731.69
Laboratorio de Fisicoquímica II Página 9
-Se procede a hacer un ajuste de las dos rectas y se halla la intersección:
Ecuación 1:
K = -0.1685*V2NaOH + 71.275*VNaOH+ 95.246 ; R2=0.9994
Ecuación 2:
K = 154.5*VNaOH - 1368.6 ; R2= 0.9982
Igualando las ecuaciones:
K = -0.1685*V2NaOH + 71.275*VNaOH+ 95.246=154.5*VNaOH - 1368.6
-0.1685*V2NaOH-83.225*VNaO +1463.846=0
VNaOH= 17.0036 mL
Hallando la concentración del ácido clorhídrico CH3COOH(ac):
[NaOH]*VNaOH= [CH3COOH]*VCH3COOH
0.095*17.0036= [CH3COOH]*15mL
[CH3COOH]=0.1077 M
3er Experimento: Grupo N° 3 (KAGUA (µS/cm)= 9.08)
Se trabaja con CH3COOH (ac) , HCl(ac) y NaOH (ac), el primer paso es estandarizar la solución de
hidróxido de sodio esto se hará con el ftalato ácido de potasio. Se pesa el ftalato y se iguala el
número de moles:
#Eq. Acido=#Eq. Base
𝑾𝒔𝒂𝒍
𝑷.𝑴 = [NaOH] xVNaOH
( 𝜽 )
[NaOH]=0.095 M
Ahora procederemos a titular el ácido clorhídrico mezclado con el ácido acético, con el NaOH y
medir la conductancia simultáneamente para diferentes volúmenes, a continuación se
grafican los puntos para cada 1mL de NaOH titulado:
Laboratorio de Fisicoquímica II Página 10
VNaOH (Km-Kagua)
(ml) (µS/cm)
0 5690.92
1 5340.92
2 4970.92
3 4640.92
4 4270.92
5 3950.92
6 3620.92
7 3300.92
8 2980.92 6000
9 2680.92
10 2350.92 5000
11 2100.92
12 1822.92 4000
Conductancia
13 1596.92
14 1516.92 3000
Series1
15 1544.92
16 1591.92 2000
17 1646.92
18 1692.92 1000
19 1742.92
20 1794.92 0
0 10 20 30 40 50
21 1924.92
Volumen de NaOH
22 2090.92
23 2260.92
24 2430.92
25 2590.92
26 2750.92
27 2910.92
28 3070.92
29 3220.92
30 3370.92
31 3530.92
32 3670.92
33 3820.92
34 3970.92
35 4110.92
36 4240.92
37 4370.92
38 4510.92
39 4630.92
40 4760.92
Laboratorio de Fisicoquímica II Página 11
-Se procede a hacer un ajuste de las dos rectas y se halla la intersección:
Ecuación 1:
K = -309.01*VNaOH + 5552.2 R² = 0.9936
Ecuación 2:
K = 1.3929*VNaOH 2 + 0.1786*VNaOH + 1236.2 R² = 0.9979
Ecuación 3:
K = 150.29*VNaOH - 1173.6 R² = 0.9984
Igualando las ecuaciones 1 y 2:
-309.01*VNaOH + 5552.2 = 1.3929*VNaOH 2 + 0.1786*VNaOH + 1236.2
VNaOH =13.18 mL
Hallando la concentración del ácido clorhídrico HCl (ac):
[NaOH]*VNaOH=[HCl]*VHCl
0.095*13.18mL = [HCl]*15mL
[HCl] = 0.0834 M
Igualando las ecuaciones 2 y 3:
1.3929*VNaOH 2 + 0.1786*VNaOH + 1236.2 = 150.29*VNaOH - 1173.6
VNaOH =19.68mL
Hallando la concentración del ácido acético (ac):
[NaOH]*VNaOH= [CH3COOH]*VCH3COOH
0.095*19.68mL = [CH3COOH]*5mL
[CH3COOH]= 0.374 M
4to Experimento: Grupo N° 4 (KAGUA (µS/cm)= 26.8)
Se trabaja con CH3COOH (ac) , HCl(ac) y NaOH (ac), el primer paso es estandarizar la solución de
hidróxido de sodio esto se hará con el ftalato ácido de potasio. Se pesa el ftalato y se iguala el
número de moles:
#Eq. Acido=#Eq. Base
𝑾𝒔𝒂𝒍
𝑷.𝑴 = [NaOH] xVNaOH
( 𝜽 )
Laboratorio de Fisicoquímica II Página 12
[NaOH]=0.095 M
Ahora procederemos a titular el ácido clorhídrico mezclado con el ácido acético, con el NaOH y
medir la conductancia simultáneamente para diferentes volúmenes, a continuación se
grafican los puntos para cada 1mL de NaOH titulado:
VNaOH (Km-Kagua)
(ml) (µS/cm)
2000
0 1885.2
1 1581.2 1800
2 1269.2 1600
3 1000.2
1400
4 768.2
Conductancia
5 681.2 1200
6 690.2 1000
7 736.2
800
8 795.2
9 857.2 600
10 916.2 400
11 976.2
200
12 1041.2
13 1101.2 0
14 1160.2 0 5 10 15 20 25
15 1220.2 Volumen de NaOH
16 1274.2
17 1330.2
18 1384.2
19 1441.2
20 1498.2
-Se procede a hacer un ajuste de las dos rectas y se halla la intersección:
Ecuación 1:
K = -249.37*VNaOH + 1821 ; R² = 0.9759
Ecuación 2:
K = 1.119 V2NaOH + 38.929*VNaOH + 413.44 ; R² = 0.9996
Ecuación 3:
K = 56.767*VNaOH + 364.04 ; R² = 0.9997
Igualando las ecuaciones 1 y 2:
-249.37*VNaOH + 1821 = 1.119 V2NaOH + 38.929*VNaOH + 413.44
-VNaOH = 4.792mL
Laboratorio de Fisicoquímica II Página 13
Hallando la concentración del ácido clorhídrico HCl (ac):
[NaOH]*VNaOH=[HCl]*VHCl
0.095* 4.792mL = [HCl]*5mL
[HCl] = 0.091 M
Igualando las ecuaciones 2 y 3:
= 1.119 V2NaOH + 38.929*VNaOH + 413.44 = 56.767*VNaOH + 364.04
VNaOH =12.347 mL
Hallando la concentración del ácido acético (ac):
[NaOH]*VNaOH= [CH3COOH]*VCH3COOH
0.095*12.347mL = [CH3COOH]*15mL
[CH3COOH]= 0.0782 M
5to Experimento: Grupo N° 5 (KAGUA (µS/cm)= 8.38)
Se trabaja con HCl (ac) y NaOH (ac), el primer paso es estandarizar la solución de hidróxido de
sodio esto se hará con el ftalato ácido de potasio. Se pesa el ftalato y se iguala el número de
moles:
#Eq. Acido=#Eq. Base
𝑾𝒔𝒂𝒍
𝑷.𝑴 = [NaOH] xVNaOH
( 𝜽 )
[NaOH]=0.095 M
Ahora procederemos a titular el ácido clorhídrico mezclado con el ácido acético, con el NaOH y
medir la conductancia simultáneamente para diferentes volúmenes, a continuación se
grafican los puntos para cada 1mL de NaOH titulado:
Laboratorio de Fisicoquímica II Página 14
VNaOH (Km-Kagua)
(ml) (µS/cm)
0 1861.62
1 1531.62
2 1244.62
3 945.62
4 666.62
5 554.62
6 746.62 7000
7 925.62
8 1112.62 6000
9 1318.62
10 1507.62 5000
11 1684.62
Conductancia
12 1868.62 4000
13 2041.62
14 2211.62 3000
15 2381.62
16 2531.62 2000
17 2701.62
18 2861.62 1000
19 3011.62
20 3161.62 0
21 3331.62 0 10 20 30 40 50
Volumen de NaOH
22 3471.62
23 3611.62
24 3751.62
25 3891.62
26 4041.62
27 4171.62
28 4311.62
29 4441.62
30 4571.62
31 4691.62
32 4811.62
33 4941.62
34 5061.62
35 5171.62
36 5291.62
37 5411.62
38 5531.62
39 5641.62
40 5751.62
Laboratorio de Fisicoquímica II Página 15
Se procede a hacer un ajuste de las dos rectas y se halla la intersección:
Ecuación 1:
K = -269.4x + 1807.6 R² = 0.985
Ecuación 2:
K = 147.52*VNaOH + 84.365 R² = 0.9934
Igualando las ecuaciones:
-269.4x + 1807.6 = 147.52x + 84.365
VNaOH= 4.126 mL
Hallando la concentración del ácido clorhídrico HCl(ac):
[NaOH]*VNaOH=[HCl]*VHCl
0.095*4.126mL= [HCl]*5mL
[HCl]=0.0784 M
4. DISCUSIÓN DE RESULTADOS:
En el primer experimento con ácido Clorhídrico e hidróxido de sodio al inicio la
conductancia baja hasta un punto en el que comienza a subir, en este punto se logra
la titulación. Esto se produce debido a que se trata de reacción entre un ácido fuerte
con una base fuerte.
En el segundo experimento con ácido acético e hidróxido de sodio la conductancia solo
sube pero tiene dos comportamientos uno con una tendencia a una recta y otra con
una tendencia cuadrática, esto se debe a que se trata de un ácido débil y una base
fuerte.
En el tercer experimento con una mezcla de ácido clorhídrico de 15 mL y ácido acético
en 5 mL, y en el cuarto experimento con una mezcla de ácido clorhídrico 5 mL y el
ácido acético 15 mL, podemos notar que al calcular el volumen de NaOH empleado,
nos sirve de mucho debido a que inicialmente tenemos un ácido fuerte y
hallaremos su concentración para luego hallar la concentración del ácido débil.
5. CONCLUSIONES:
Las gráficas de cada titulación ácido y base tienen sus comportamientos respectivos al
modelo teórico de cada grafica por lo que podemos concluir que este experimento se
logró obtener el análisis y el manejo adecuado en este importante método.
Laboratorio de Fisicoquímica II Página 16
6. ANEXO:
Aplicaciones de las medidas conductimétricas:
Como se comentó previamente, las medidas conductimétricas rara vez se utilizan
para medir la concentración de un determinado electrolito. Por el contrario,
resultan útiles para medir la concentración total de electrolitos.
6.1. Determinación de la salinidad del agua de mar
La salinidad total es una medida del contenido total de sales disueltas en
una disolución y es de particular importancia su determinación en el
aguade mar. La salinidad del agua de mar es debida, entre otros electrolitos
el NaCl, KCl y MgCl2 y su contenido total es determinante de procesos
biológicos tan diversos como el desove y la migración de los peces. La
medida de salinidad se realiza en una escala basada en una disolución de
KCl. Así, un valor de salinidad de 35 ‰ a 15 °C es equivalente a la
conductividad de una disolución de KCl conteniendo 32.4356 g de KCl en
1kg de disolución.
6.2. Control de la pureza del agua:
El agua corriente suministrada por las cañerías posee un contenido de
electrolitos que no es adecuado para su uso en los laboratorios. Esta agua
puede ser purificada por destilación, intercambio iónico o por métodos
combinados de intercambiadores y membranas para ósmosis inversa. Se
puede medir el grado de purificación alcanzado midiendo la conductividad
total del agua producida. Los equipos que purifican el agua a un nivel de
10-9M M tienen incorporado un sistema de medición continua de la
conductividad. El agua comúnmente utilizada en Electroquímica es de
calidad ultra-pura, en la que la resistividad debe de alcanzar un valor
mayor que 18 MΩcm-1
La misma se consigue luego de realizar una triple destilación, seguida de
intercambiadores catiónico y aniónico y ósmosis inversa. La resultante
debe fluir por filtros de carbón activado y de membrana de acetato de
celulosa de0,33 µm de diámetro.
Laboratorio de Fisicoquímica II Página 17
7. BIBLIOGRAFÍA:
Fisicoquímica con aplicaciones a sistemas biológicos, R. Chang, Cap. 9,
pp.245-288 3ª Edición, CECSA (1986)
Amaron Prutton, “Fisicoquimica”, 2da edición, Ed. Limusa, Mexico 1984.
Pag.462-465.
Castellan W.,”Fisicoquimica”, 2da edición, fondo interamericano S.A., Mexico
1978. Pag.462-465
Laboratorio de Fisicoquímica II Página 18
Das könnte Ihnen auch gefallen
- Problemas resueltos de Hidráulica de CanalesVon EverandProblemas resueltos de Hidráulica de CanalesBewertung: 4.5 von 5 Sternen4.5/5 (7)
- Practica 6 de Quimica AnalíticaDokument7 SeitenPractica 6 de Quimica AnalíticaItzel Renata Montalvo AvendañoNoch keine Bewertungen
- 1468 Sales Solubles Metodo Bresle ISO 8509Dokument2 Seiten1468 Sales Solubles Metodo Bresle ISO 8509IQCALLAN100% (1)
- Reporte #7Dokument10 SeitenReporte #7ALDO CLEOCEL CURASMA LUCASNoch keine Bewertungen
- Equilibrio-Químico MejoradoDokument8 SeitenEquilibrio-Químico MejoradoJhoel Ivan Diaz PaucarNoch keine Bewertungen
- Informe 5Dokument12 SeitenInforme 5Brandon RodriguezNoch keine Bewertungen
- Mezcla de ÁcidosDokument6 SeitenMezcla de ÁcidosPRAYME SACNoch keine Bewertungen
- Informe N°8 Grupo 4 Del Laboratorio de Fisicoquímica 2Dokument12 SeitenInforme N°8 Grupo 4 Del Laboratorio de Fisicoquímica 2Erick CajasNoch keine Bewertungen
- Villagomez CQC Rep 5Dokument12 SeitenVillagomez CQC Rep 5Adrián León PachecoNoch keine Bewertungen
- Post 9Dokument8 SeitenPost 9MELANY ELIZABETH MONROY CRUZNoch keine Bewertungen
- Universidad de Antioquia Facultad de IngDokument10 SeitenUniversidad de Antioquia Facultad de IngNICOLAS GUERRERO ARANGONoch keine Bewertungen
- Práctica 2 CinéticaDokument12 SeitenPráctica 2 CinéticaXanath PotNoch keine Bewertungen
- Reporte 1.1 Cinética Acetato de EtiloDokument14 SeitenReporte 1.1 Cinética Acetato de EtilohitomitsukiNoch keine Bewertungen
- Reporte 8-Estandarización de Soluciones A Usar en Procesos RedoxDokument13 SeitenReporte 8-Estandarización de Soluciones A Usar en Procesos RedoxJunior VasquezNoch keine Bewertungen
- Hidrolisis Del AcetatoDokument22 SeitenHidrolisis Del Acetatokañamongui EsparciaNoch keine Bewertungen
- Informe. Práctica 6Dokument14 SeitenInforme. Práctica 6Melina HernándezNoch keine Bewertungen
- Informe 5Dokument12 SeitenInforme 5KamilaNoch keine Bewertungen
- Informe Practica de AdsorciónDokument7 SeitenInforme Practica de AdsorciónYasmin Arteaga VelasquezNoch keine Bewertungen
- Sonia ProyDokument17 SeitenSonia ProyGary RamosNoch keine Bewertungen
- Reporte de Práctica Lab 1Dokument10 SeitenReporte de Práctica Lab 1Montse CapuchinoNoch keine Bewertungen
- CSTR VirtualDokument9 SeitenCSTR VirtualCynthia RamírezNoch keine Bewertungen
- Practica 2 Reactores QuimicosDokument21 SeitenPractica 2 Reactores QuimicosAllan HernandezNoch keine Bewertungen
- EQUIPO2 R1 2-FlattenedDokument10 SeitenEQUIPO2 R1 2-FlattenedSalvador Zúñiga IbarraNoch keine Bewertungen
- Titulacion Potenciometrica de Acido ClorhidricoDokument6 SeitenTitulacion Potenciometrica de Acido ClorhidricoYUBER SANTOS INQUILLANoch keine Bewertungen
- Informe de Extraccion Liq LiqDokument22 SeitenInforme de Extraccion Liq LiqJosé Carlos Torres VarillasNoch keine Bewertungen
- CONDUCTIMETRÍADokument7 SeitenCONDUCTIMETRÍATita ValoisNoch keine Bewertungen
- Reporte de Lab7Dokument8 SeitenReporte de Lab7Michel CristianNoch keine Bewertungen
- Informe de Laboratorio - P6. Método de JobDokument9 SeitenInforme de Laboratorio - P6. Método de JobLuisa FernandaNoch keine Bewertungen
- ADSOPDokument6 SeitenADSOPLaura Bustamante CalleNoch keine Bewertungen
- Isotermas de AdsorciónDokument7 SeitenIsotermas de AdsorciónCristian DiazNoch keine Bewertungen
- LAB10 Cinetica QuimicaDokument12 SeitenLAB10 Cinetica Quimicaambaargab22Noch keine Bewertungen
- Acidez en VinosDokument4 SeitenAcidez en VinosJorge RamonNoch keine Bewertungen
- LabFIQUI-I-"EQUILIBRIO QUÍMICO HOMOGÉNEO EN LA FASE LIQUIDA"BDokument12 SeitenLabFIQUI-I-"EQUILIBRIO QUÍMICO HOMOGÉNEO EN LA FASE LIQUIDA"BcefiqtNoch keine Bewertungen
- Ingeniería Quimica: Química AnalíticaDokument12 SeitenIngeniería Quimica: Química Analíticaangel gabrielNoch keine Bewertungen
- Informe Titulaciones ConductimetricasDokument13 SeitenInforme Titulaciones ConductimetricasAxelAngelloChristianNoch keine Bewertungen
- PRACTICA 1. Blanca Martinez CollDokument16 SeitenPRACTICA 1. Blanca Martinez CollAitor PastorNoch keine Bewertungen
- Valoración Potenciométrica de Una Muestra de Carbonato de SodioDokument9 SeitenValoración Potenciométrica de Una Muestra de Carbonato de SodioPRAYME SACNoch keine Bewertungen
- Informe 5Dokument6 SeitenInforme 5Nahomi Mina RomeroNoch keine Bewertungen
- Oxidacion Del Yoduro Con Peroxido de Hidrogeno PDFDokument8 SeitenOxidacion Del Yoduro Con Peroxido de Hidrogeno PDFAndrew SilvaNoch keine Bewertungen
- g2 Practica 01 A.Q.IDokument7 Seiteng2 Practica 01 A.Q.IaldairNoch keine Bewertungen
- E1P4L1013Dokument21 SeitenE1P4L1013Monserrat HernandezNoch keine Bewertungen
- Informe de Laboratorio Análisis Instrumental 7Dokument11 SeitenInforme de Laboratorio Análisis Instrumental 7joshua silvaNoch keine Bewertungen
- Practica No 2 Cinetica y ReactoresDokument9 SeitenPractica No 2 Cinetica y Reactoresvaleria martinezNoch keine Bewertungen
- Taller N°2 Conductimetría y Culombiometría.Dokument12 SeitenTaller N°2 Conductimetría y Culombiometría.joseNoch keine Bewertungen
- Informe #2 AnaliticaDokument10 SeitenInforme #2 AnaliticaOver CoreNoch keine Bewertungen
- Fiqui 2Dokument14 SeitenFiqui 2ToteB.P-hNoch keine Bewertungen
- Problema 1. Estimación de La Fiabilidad de Un Análisis de Agua. Modelización HidrogeoquímicaDokument9 SeitenProblema 1. Estimación de La Fiabilidad de Un Análisis de Agua. Modelización HidrogeoquímicaTamara VejarNoch keine Bewertungen
- Calor NeutDokument10 SeitenCalor NeutLaura Bustamante CalleNoch keine Bewertungen
- NiqueladoDokument16 SeitenNiqueladoTatiana Pila FonsecaNoch keine Bewertungen
- Laboratorio de Titulacion Conductimetrica-2021-2Dokument8 SeitenLaboratorio de Titulacion Conductimetrica-2021-2VICTOR ENRIQUE QUISPE SAMANEZNoch keine Bewertungen
- Equilibrio Liquido LiquidoDokument17 SeitenEquilibrio Liquido LiquidoDisco17Noch keine Bewertungen
- Informe-Vi Titulacion Conductrimetrica de Una Mezzcla de AcidosDokument10 SeitenInforme-Vi Titulacion Conductrimetrica de Una Mezzcla de AcidosDeyvi Heredia VillalobosNoch keine Bewertungen
- Practica 7 Reactor BatchDokument12 SeitenPractica 7 Reactor BatchMaria VivancoNoch keine Bewertungen
- Informe 4Dokument6 SeitenInforme 4Paola ChungaraNoch keine Bewertungen
- Potenciometria y Valoracion de SulfatosDokument8 SeitenPotenciometria y Valoracion de SulfatosFabiola Del Pilar CuroNoch keine Bewertungen
- Cálculos de Titulación ConductimétricaDokument8 SeitenCálculos de Titulación ConductimétricaKevin Dominguez ValenciaNoch keine Bewertungen
- Informe Practica 7 Lab de Reactores - Rtac No EstacionarioDokument11 SeitenInforme Practica 7 Lab de Reactores - Rtac No EstacionariocristianNoch keine Bewertungen
- TITULACIONES-CONDUCTIMETRICAS PlanchaDokument12 SeitenTITULACIONES-CONDUCTIMETRICAS PlanchaCristhian GilioNoch keine Bewertungen
- Práctica 3Dokument10 SeitenPráctica 3PedroLagarNoch keine Bewertungen
- Curso Práctico de Química GeneralVon EverandCurso Práctico de Química GeneralBewertung: 4 von 5 Sternen4/5 (4)
- Ingeniería química. Soluciones a los problemas del tomo IVon EverandIngeniería química. Soluciones a los problemas del tomo INoch keine Bewertungen
- Funciones de Busqueda y ReferenciaDokument6 SeitenFunciones de Busqueda y ReferenciaKevin Dominguez ValenciaNoch keine Bewertungen
- 1468 Determinacion de Sales Solubles en Agua Metodo BresleDokument4 Seiten1468 Determinacion de Sales Solubles en Agua Metodo BresleKevin Dominguez ValenciaNoch keine Bewertungen
- INF. TEC. DT #17053PCS171128LSDV - Prueba de Conductividad en La Superficie - GASOLINA - JCDokument4 SeitenINF. TEC. DT #17053PCS171128LSDV - Prueba de Conductividad en La Superficie - GASOLINA - JCKevin Dominguez ValenciaNoch keine Bewertungen
- 1491 Especificación de Minerales Abrasivos - ISO 11127-6 PDFDokument2 Seiten1491 Especificación de Minerales Abrasivos - ISO 11127-6 PDFKevin Dominguez ValenciaNoch keine Bewertungen
- Procesamiento Del Litio en RocasDokument14 SeitenProcesamiento Del Litio en RocasKevin Dominguez ValenciaNoch keine Bewertungen
- Informe Ped Comunica 4Dokument3 SeitenInforme Ped Comunica 4robertoNoch keine Bewertungen
- Proceso de ResiduosDokument8 SeitenProceso de ResiduosdanielNoch keine Bewertungen
- Contenido de Las Isos (Parte 3)Dokument12 SeitenContenido de Las Isos (Parte 3)Kevin Dominguez ValenciaNoch keine Bewertungen
- Informe Ped Comunica 4Dokument3 SeitenInforme Ped Comunica 4robertoNoch keine Bewertungen
- Informe Ped Comunica 4Dokument3 SeitenInforme Ped Comunica 4robertoNoch keine Bewertungen
- Labo 3 FiquiDokument13 SeitenLabo 3 FiquiKevin Dominguez ValenciaNoch keine Bewertungen
- Chorro de Agua A Ultra Alta PresionDokument22 SeitenChorro de Agua A Ultra Alta PresionKevin Dominguez ValenciaNoch keine Bewertungen
- Informe Tecnico PedagogicoDokument1 SeiteInforme Tecnico PedagogicoPercy PérezNoch keine Bewertungen
- Cálculos de Titulación ConductimétricaDokument8 SeitenCálculos de Titulación ConductimétricaKevin Dominguez ValenciaNoch keine Bewertungen
- Principio de HomogeneidadDokument2 SeitenPrincipio de HomogeneidadKevin Dominguez ValenciaNoch keine Bewertungen
- Labo de Orga Info 1Dokument14 SeitenLabo de Orga Info 1Kevin Dominguez ValenciaNoch keine Bewertungen
- Acido SalicilicoDokument2 SeitenAcido SalicilicoKevin Dominguez ValenciaNoch keine Bewertungen
- 4ta FenomenosDokument14 Seiten4ta FenomenosKevin Dominguez ValenciaNoch keine Bewertungen
- Manual GCT U02 2 PDFDokument69 SeitenManual GCT U02 2 PDFdelmithNoch keine Bewertungen
- Química Del Gas NaturalDokument5 SeitenQuímica Del Gas NaturalKevin Dominguez ValenciaNoch keine Bewertungen
- Cloro FluorocarbonosDokument7 SeitenCloro FluorocarbonosKevin Dominguez Valencia100% (1)
- Aplicaciones de HidroacidosDokument5 SeitenAplicaciones de HidroacidosKevin Dominguez ValenciaNoch keine Bewertungen
- AceitesDokument1 SeiteAceitesKevin Dominguez ValenciaNoch keine Bewertungen
- Lab 1 Purificación de Sustancias Solidas y Criterios de PurezaDokument9 SeitenLab 1 Purificación de Sustancias Solidas y Criterios de PurezaKevin Dominguez ValenciaNoch keine Bewertungen
- Lab 1 Purificación de Sustancias Solidas y Criterios de PurezaDokument9 SeitenLab 1 Purificación de Sustancias Solidas y Criterios de PurezaKevin Dominguez ValenciaNoch keine Bewertungen
- Lab 1 Purificación de Sustancias Solidas y Criterios de PurezaDokument9 SeitenLab 1 Purificación de Sustancias Solidas y Criterios de PurezaKevin Dominguez ValenciaNoch keine Bewertungen
- Fisica 2 Introductorio 1Dokument4 SeitenFisica 2 Introductorio 1Kevin Dominguez ValenciaNoch keine Bewertungen
- Fisica 2 Introductorio 1Dokument4 SeitenFisica 2 Introductorio 1Kevin Dominguez ValenciaNoch keine Bewertungen
- Guia 01 QuimicaDokument9 SeitenGuia 01 QuimicaLesmes Hidalgo CamposNoch keine Bewertungen
- Sensor Ultrasonico MURATA TRADUCIDODokument17 SeitenSensor Ultrasonico MURATA TRADUCIDODante LeivaNoch keine Bewertungen
- Proyecto de IluminacionDokument18 SeitenProyecto de IluminacionJorge RoblesNoch keine Bewertungen
- CianicidasDokument9 SeitenCianicidasRogger Jefferson Miranda HerreraNoch keine Bewertungen
- Abc PDFDokument6 SeitenAbc PDFCLAUDIA BENITEZNoch keine Bewertungen
- Estabilidad Del AzudDokument8 SeitenEstabilidad Del AzudYonatan Pool100% (1)
- Líneas EquipotencialesDokument18 SeitenLíneas EquipotencialesAnita del AngelNoch keine Bewertungen
- Formulación CompBinariosDokument5 SeitenFormulación CompBinariosMarcos Hernández GonzálezNoch keine Bewertungen
- Curso Perforadoras MineriaDokument42 SeitenCurso Perforadoras MineriabetroozNoch keine Bewertungen
- Guía de Termodinámica 1. Sequier y ColinaDokument156 SeitenGuía de Termodinámica 1. Sequier y ColinaLuisNoch keine Bewertungen
- Medicion de Voltajes Del VochoDokument10 SeitenMedicion de Voltajes Del VochokrustigrusNoch keine Bewertungen
- Calculo Del IprDokument10 SeitenCalculo Del IprRuben Waldir Segarra Morales100% (1)
- Curso Sistema Suspension Neumatica Audi Allroad Quattro Mecanismo Estructura Componentes Funciones ArquitecturaDokument47 SeitenCurso Sistema Suspension Neumatica Audi Allroad Quattro Mecanismo Estructura Componentes Funciones ArquitecturaAbel Maldonado DiazNoch keine Bewertungen
- Calculo 2Dokument11 SeitenCalculo 2alexaNoch keine Bewertungen
- Cinética de Disolución de Minerales de Cobre deDokument11 SeitenCinética de Disolución de Minerales de Cobre deTacachiri Chocamani JaimeNoch keine Bewertungen
- Medidas de DispersiónDokument14 SeitenMedidas de DispersiónRicki HuevosNoch keine Bewertungen
- Tema 3 Enlace Químico y Propiedades de La Materia 17Dokument25 SeitenTema 3 Enlace Químico y Propiedades de La Materia 17supermamenNoch keine Bewertungen
- Experiencia 7 Pre InformeDokument5 SeitenExperiencia 7 Pre Informelinda locarno noriega0% (1)
- Taller LeyGauss01Dokument3 SeitenTaller LeyGauss01Daniel DiazNoch keine Bewertungen
- Manometros MetalicosDokument6 SeitenManometros MetalicosCarla PerezNoch keine Bewertungen
- 1taller Sobre Clarificacion de JugoDokument68 Seiten1taller Sobre Clarificacion de Jugojulio127782343100% (2)
- Funciones TrigonometricasDokument36 SeitenFunciones TrigonometricasMaickol Pierre Cardenas VicenteNoch keine Bewertungen
- Problemas de ProbabilidadDokument160 SeitenProblemas de ProbabilidadFiorella PortalesNoch keine Bewertungen
- Unidad 6 Soluciones QuimicasDokument8 SeitenUnidad 6 Soluciones QuimicasDeyvi ChavezNoch keine Bewertungen
- Tema # 3 Resistencia Trabajo #23Dokument51 SeitenTema # 3 Resistencia Trabajo #23JoseDavidSosaNoch keine Bewertungen
- Medida de La Potencia - Metodo de Los Tres AmperimetrosDokument9 SeitenMedida de La Potencia - Metodo de Los Tres AmperimetrosRonald AcNoch keine Bewertungen
- Clase 14 Y15 Cal2 2018-2Dokument14 SeitenClase 14 Y15 Cal2 2018-2OrlandoPerezValenciaNoch keine Bewertungen
- T7 SE 01 Estructuras Altura ActivaDokument33 SeitenT7 SE 01 Estructuras Altura ActivaMatias StoesselNoch keine Bewertungen
- Formulario de TrigonometriaDokument1 SeiteFormulario de TrigonometriaignacioNoch keine Bewertungen
- Hidrómetro EléctricoDokument13 SeitenHidrómetro EléctricoKevin Eduardo0% (1)