Beruflich Dokumente
Kultur Dokumente
TOSTACIÓN
Hochgeladen von
CarolinaRodriguezSotoCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
TOSTACIÓN
Hochgeladen von
CarolinaRodriguezSotoCopyright:
Verfügbare Formate
INGENIERÍA METALÚRGICA - UPTC
PRÁCTICA DE HIDROMETALURGIA No. 2
TOSTACIÓN DE LATERITAS DE NÍQUEL
1. OBJETIVO GENERAL:
Realizar una tostación sulfatante a lateritas de Níquel.
1.2 OBJETIVOS ESPECÍFICOS:
1.2.1. Realizar el diagrama de Kellogg para identificar las condiciones óptimas de la tostación
del mineral de Níquel.
1.2.2. Realizar una tostación sulfatante homogénea, de acuerdo a los resultados obtenidos en el
diagrama de Kellogg.
2. IMPLEMENTOS DE SEGURIDAD:
Overol o bata.
Guantes resistentes al calor.
Peto.
Tapabocas.
Careta.
Zapatos de seguridad.
3. MATERIALES Y/O EQUIPOS:
Mufla.
Mineral de Níquel (concentrado de la flotación).
Recipiente (tiesto resistente a altas temperaturas) de capacidad suficiente para colocar el
concentrado y de base plana (LO DEBE TRAER EL ESTUDIANTE).
4. MARCO TEÓRICO:
4.1 TOSTACIÓN
La tostación es una preparación aplicable tanto a la extracción pirometalúrgica como
hidrometalúrgica, que debe tener una atmósfera controlada. Esta operación es
heterogénea, ya que se tiene una fase sólida en contacto con una fase gaseosa, y el
contacto entre estas fases es muy importante. Además, se evita llegar a temperaturas
elevadas, a fin de impedir la fusión de la fase sólida.
4.1.1 Las variables termodinámicas que intervienen en la tostación son:
La temperatura
La composición de los gases, para tener una atmósfera controlada
4.1.2 Las variables cinéticas son:
Granulometría: tamaño y forma de las partículas.
Composición química, sobre todo para conocer qué tan pura es la alimentación.
Porosidad inicial, que ofrece una mayor o menor área de contacto, sólido – gas en este
caso.
Transferencia de calor, muy ligada al tamaño de partícula.
Ing. CLAUDIA MOLINA
INGENIERÍA METALÚRGICA - UPTC
Tipo de horno utilizado.
4.1.3 Hay varios tipos de tostación. Estos son:
Sulfatante → A partir de la cual se obtienen sulfatos
Oxidante a muerte → A partir de la cual se obtienen óxidos
Reductora
Atmósferas especiales
Aglomerante
4.2 TOSTACIÓN OXIDANTE PARCIAL – SULFATANTE
Se aplica a sulfuros, y es como un pretratamiento para la extracción de los metales.
Como reactivo utiliza oxígeno, mientras que como productos se obtiene el óxido del
metal y dióxido de carbono ( ). Además, hay la generación de dióxido de azufre (
), que es una sustancia altamente contaminante. La composición de la fase gaseosa
define la termodinámica de la tostación.
Según Ellingham, para temperaturas entre y esta reacción es casi
irreversible. A pesar de que un aumento en la temperatura favorece el proceso, no se
supera los pues se pretende evitar que se lleven a cabo procesos de fusión.
La reacción de tostación es una reacción exotérmica, por lo que no es necesario entregar
energía al sistema, sino más bien conviene aprovechar la energía generada.
Como se tiene una atmósfera oxidante y se genera dióxido de azufre ( ), se desarrolla
la reacción de formación de trióxido de azufre ( ). Esta reacción se favorece a
temperaturas bajas, de modo que a temperaturas altas ya no se tiene este proceso
químico.
La generación de dióxido de azufre en una atmósfera oxidante da lugar a que se
produzcan otras reacciones, como por ejemplo que el óxido del metal interactúe
químicamente con el formando el sulfato del metal, o aquella en la que el óxido del
metal se une químicamente al sulfato respectivo (oxisulfato), teniéndose finalmente el
sulfato del metal.
Estos procesos deben ser controlados, ya que, si bien algunas veces conviene la
formación de óxidos, otras veces conviene tener sulfatos en el sistema. Una vez
identificado qué es lo que se quiere, se fija y se controla la atmósfera en la que se
desarrolla la reacción.
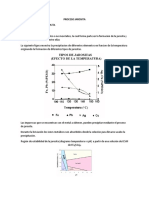
4.3 DIAGRAMAS DE KELLOGG
Ing. CLAUDIA MOLINA
INGENIERÍA METALÚRGICA - UPTC
Debido a la importancia de la composición de la fase gaseosa, estos procesos se han
estudiado y se han construido diagramas, como los diagramas isotérmicos de Kellogg,
que son representaciones gráficas en las que se indica cómo varía el logaritmo de la
presión parcial del dióxido de azufre en función del logaritmo de la presión parcial del
oxígeno. En éstos se observa que es posible, bajo condiciones muy controladas y para
sustancias específicas (para el zinc, por ejemplo), obtener el metal directamente a partir
del sulfuro. Se observa además que cuando se modifican las condiciones, se cambian los
productos que se pueden obtener.
También existen diagramas de Kellogg tridimensionales, en los que se incluye la
influencia de la temperatura en el proceso tostación oxidante. Sin embargo, es más usual
que éstos se desarrollen para una misma temperatura.
Se dispone de diagramas de Kellogg de distintos metales a distintas temperaturas,
cuando éstos son de temperatura constante. Muchas veces son útiles las superposiciones
de estos diagramas para diferentes metales, pero a una misma temperatura.
Los diagramas de Kellogg pueden aplicarse para más de una reacción, lo cual es
bastante útil para sustancias como la calcopirita (sulfuro de cobre y hierro) para las
cuales se requiere tener al cobre en forma de sulfato y al hierro en forma de óxido,
juntos en un mismo sistema. Las condiciones especiales bajo las cuales esto sucede
resultan de la intersección de las condiciones necesarias para obtenerse el sulfato de
cobre y de las condiciones necesarias para obtener el óxido de hierro.
Dependiendo de la zona en la que las condiciones ubican al sistema dentro del diagrama
de Kellogg, se tiene la predominancia del óxido o del sulfato. En general, sucede que a
una temperatura superior a los 750 los productos de la reacción son en su mayoría
óxidos, mientras que para temperaturas menores a 750 , hay más presencia de sulfatos.
En la industria, la tostación también se emplea para obtener plomo y zinc, sustancias
que generalmente se hallan en forma de sulfuro. Por eso, entra el sulfuro al proceso de
tostación para llegar hasta óxido, y posteriormente se lo reduce hasta el metal.
Según Ellingham la reacción que se desarrolla primero (antes de la oxidación del
sulfuro) es la sulfatante, pues en sus diagramas se observa que la energía libre de Gibbs
estándar de esta reacción es más negativa y, por tanto, más espontánea. Pero en la
realidad no sucede esto, ya que Ellingham analiza reacción por reacción sin considerar a
las reacciones paralelas que también se desarrollan. Es decir, cómo puede generarse el
sulfato sin el trióxido de azufre que se requiere para ello, y el trióxido de azufre se
obtiene a partir del dióxido de azufre que es producto de la reacción de oxidación del
sulfuro. Esto se resume en lo siguiente: primero se da la oxidación y luego la
sulfatación.
En los termogramas se ve lo que realmente sucede: el mineral primero se oxida y luego
se sulfata, pues la curva baja continuamente hasta que, en cierto punto, comienza a subir
indicando que el trióxido de azufre está reaccionando. Así, durante el proceso de
tostación, a medida que aumenta la presión parcial del oxígeno, el sulfuro se convierte
en óxido y luego en sulfato.
Ing. CLAUDIA MOLINA
INGENIERÍA METALÚRGICA - UPTC
En cuanto a los diagramas de Kellogg, estos se analizan considerando que el sulfuro de
cobre está separado del sulfuro de hierro, por ejemplo. Sin embargo, esto no sucede en
la realidad. Kellogg tampoco considera que luego de la reacción se tendrán compuestos
complejos que involucran mezclas de sólidos. Pese a estas consideraciones, los
diagramas dan una buena idea de las condiciones a las que se debe trabajar para que
predomine uno u otro producto.
4.3.1 Construcción de Diagramas de Kellogg
Los diagramas de Kellogg son gráficas en las que se representa el logaritmo de la
presión parcial del dióxido de azufre en función de la presión parcial del oxígeno. Por
tanto, el objetivo es encontrar la ecuación que relaciona estas variables.
En el equilibrio:
Las siguientes reacciones químicas son las posibles reacciones que se pueden formar al momento de
realizar la tostación del NiS. Es necesario balancear las reacciones, agregando oxigeno (O2) o dióxido
de azufre ( SO2) dependiendo del caso.
Las reacciones a representar son las siguientes:
4.4 MECANISMO DE LA TOSTACIÓN
4.4.1 El óxido se difunde, teniéndose una capa límite.
4.4.2 El sulfuro está en el interior y por el exterior está el óxido, de modo que los gases
también deben difundirse a través del sulfuro.
4.4.3 El dióxido de azufre ( ) que también se genera en la reacción debe atravesar
todas las capas para difundirse hacia afuera.
Como se genera dióxido de azufre como producto de la reacción, éste debe difundirse
hacia la salida, lo que supone un problema ya que el sulfato es muy denso, y se opone a
la salida de este gas. Esto disminuye la velocidad de reacción, de modo que la difusión
del dióxido de azufre es la etapa controlante de este mecanismo de reacción.
Por otro lado, se ve que a 700 la reacción de sulfatación ya no se desarrolla, de modo
que se debe trabajar a temperaturas menores para favorecer la formación del sulfato.
Ing. CLAUDIA MOLINA
INGENIERÍA METALÚRGICA - UPTC
5. DESARROLLO EXPERIMENTAL:
5.1 Depositar el mineral concentrado de calcopirita en el recipiente resistente a alta temperatura
y colocarlo dentro de la mufla.
5.2. Encender la mufla y realizar tostación sulfatante, controlando la temperatura para no
exceder la necesaria.
5.3 Revolver alrededor de cada media hora el mineral, para que la tostación sea homogénea,
esto durante 6 horas, (con las medidas de seguridad adecuadas).
5.4 Esperar que la mufla se enfríe y retirar el mineral tostado.
6. CUESTIONARIO:
6.1 Construir el diagrama de Kellogg para el sistema Ní – S – O, utilizando las reacciones
presentadas anteriormente en la guía.
6.2 Presentar la ecuación que se obtiene al tostar de manera sulfatante el mineral de Níquel.
6.3 ¿Cuál es el número máximo de fases que pueden coexistir en un punto en los diagramas
tridimensionales T – logPSO2 - logPO2?
6.4 Discutir y comentar los resultados.
Ing. CLAUDIA MOLINA
Das könnte Ihnen auch gefallen
- Curso Transporte y ApilamientoDokument29 SeitenCurso Transporte y ApilamientoFabian HurtadoNoch keine Bewertungen
- PIRO III A. Zenteno Horno de Lecho FDokument13 SeitenPIRO III A. Zenteno Horno de Lecho FAlvaro Arando GarciaNoch keine Bewertungen
- Practica N 10 - 13 Lixiviacion Con CianuracionDokument9 SeitenPractica N 10 - 13 Lixiviacion Con CianuracionOmar GomezNoch keine Bewertungen
- Apuntes Pirometalurgia-TostaciónDokument7 SeitenApuntes Pirometalurgia-Tostaciónjuan carlos espinoza agueroNoch keine Bewertungen
- Hidro Cu-Modulo 3 Antes RDokument1 SeiteHidro Cu-Modulo 3 Antes REduardo Sanchez AquinoNoch keine Bewertungen
- Laboratorio de Metalurgia Extractiva Informe NDokument13 SeitenLaboratorio de Metalurgia Extractiva Informe NVictoria Cordova De la PeñaNoch keine Bewertungen
- Proceso JarositaDokument2 SeitenProceso JarositaalbertNoch keine Bewertungen
- Reactor NorandaDokument1 SeiteReactor NorandaBart FrienderNoch keine Bewertungen
- Guia de TostaciónDokument6 SeitenGuia de TostaciónIsabela Campos SánchezNoch keine Bewertungen
- Diferencia Entre Piro e HidrometalurgiaDokument11 SeitenDiferencia Entre Piro e HidrometalurgiaRojas FelipeNoch keine Bewertungen
- Practica de Lixiviacion de CobreDokument8 SeitenPractica de Lixiviacion de CobreWalther ChaupiNoch keine Bewertungen
- Lab 4 Lixiviacion de CuDokument8 SeitenLab 4 Lixiviacion de CuAna Luisa Garnica SalgadoNoch keine Bewertungen
- Laboratorio 3 PrirometalurgiaDokument13 SeitenLaboratorio 3 PrirometalurgiaeduardoNoch keine Bewertungen
- Aglomerado y CuradoDokument3 SeitenAglomerado y CuradoAxel FuenzalidaNoch keine Bewertungen
- Informe Lixiviacion AgitadaDokument27 SeitenInforme Lixiviacion AgitadaRaúl Alejandro Pérez MoralesNoch keine Bewertungen
- DiagramasDokument3 SeitenDiagramasChristian HMNoch keine Bewertungen
- Lab 05 YacimientosDokument4 SeitenLab 05 YacimientosLuis ChaconNoch keine Bewertungen
- Flotacion de Minerales PDFDokument62 SeitenFlotacion de Minerales PDFBryan Anthony Yucra CayoNoch keine Bewertungen
- Lab 14 PLANTAS CONCENTRADORASDokument7 SeitenLab 14 PLANTAS CONCENTRADORASLuis ChaconNoch keine Bewertungen
- PRÁCTICA 4 Procesos MetalurgicosDokument12 SeitenPRÁCTICA 4 Procesos Metalurgicosfrancisco rodriguezNoch keine Bewertungen
- Procesos Pirometalurgicos - Tratamiento de EscoriasDokument15 SeitenProcesos Pirometalurgicos - Tratamiento de EscoriasBaruc Lopez TorresNoch keine Bewertungen
- Tostacion y Tipos de TostacionDokument7 SeitenTostacion y Tipos de TostacionEsparza Esquivel AntonyNoch keine Bewertungen
- PirometalurgiaDokument128 SeitenPirometalurgiaAngel Ortiz AtocsaNoch keine Bewertungen
- CuestionarioDokument5 SeitenCuestionarioMichael Alexander Baltazar CondorNoch keine Bewertungen
- MariaDokument21 SeitenMariaalexander tevesNoch keine Bewertungen
- Solubilidad de Los MineralesDokument4 SeitenSolubilidad de Los MineralesChristian Aliaga MejíaNoch keine Bewertungen
- Informe de LaboratorioDokument8 SeitenInforme de LaboratoriomichaelNoch keine Bewertungen
- Proceso de Flotacion de Plomo A Partir de La GalenaDokument3 SeitenProceso de Flotacion de Plomo A Partir de La GalenaJhoswan Enrique Carbajal EspinalNoch keine Bewertungen
- Lab 3 Piro 2Dokument8 SeitenLab 3 Piro 2Oscar Salazar MorenoNoch keine Bewertungen
- Unidad 1 - Minerales y Tratamientos TérmicosDokument20 SeitenUnidad 1 - Minerales y Tratamientos TérmicosCristian González Burzichelli100% (2)
- Imforme 5 JesseniaDokument15 SeitenImforme 5 JesseniaEduardo Mendoza SandovalNoch keine Bewertungen
- Hidrometalurgia de La CalcopiritaDokument25 SeitenHidrometalurgia de La CalcopiritaChristian Mendez UtcaniNoch keine Bewertungen
- TBRCDokument4 SeitenTBRCKevin Yordy Cornelio PradoNoch keine Bewertungen
- Laboratorio Tostación FINALDokument18 SeitenLaboratorio Tostación FINALDaniel BritoNoch keine Bewertungen
- La Amalgamación Como Técnica de ProcesamientoDokument11 SeitenLa Amalgamación Como Técnica de ProcesamientoVictorx A. QquenayaNoch keine Bewertungen
- Fabricacion de Aleaciones Binarias PB - SBDokument10 SeitenFabricacion de Aleaciones Binarias PB - SBMiguel Arguz100% (1)
- Fundición Del SN, Tarea #2Dokument10 SeitenFundición Del SN, Tarea #2Mariano Adolfo Pacheco TorresNoch keine Bewertungen
- Pirometalurgia 1Dokument4 SeitenPirometalurgia 1Alejandra FloresNoch keine Bewertungen
- Laboratorio de Pirometalurgia Tostación SulfatanteDokument14 SeitenLaboratorio de Pirometalurgia Tostación SulfatanteJulian MësäNoch keine Bewertungen
- Introducción A La HidrometalurgiaDokument10 SeitenIntroducción A La HidrometalurgiaMiguel ZsNoch keine Bewertungen
- Laboratorio - (1 - DPI) Segurity Drone ENTREGARDokument7 SeitenLaboratorio - (1 - DPI) Segurity Drone ENTREGARWilder MamaniNoch keine Bewertungen
- Deteminacion Volumetrica de Hierro en MineralesDokument2 SeitenDeteminacion Volumetrica de Hierro en MineralessebastianNoch keine Bewertungen
- Monoeteres PoliglicolicosDokument14 SeitenMonoeteres PoliglicolicosFabian Andre Maquera AlcahuamanNoch keine Bewertungen
- Producir Sulfato de Cobre A Partir de CEMENTO de COBREDokument5 SeitenProducir Sulfato de Cobre A Partir de CEMENTO de COBREPablo HurtubiaNoch keine Bewertungen
- Lixiviación de Minerales Oxidados en Presencia de Agentes OxidantesDokument11 SeitenLixiviación de Minerales Oxidados en Presencia de Agentes OxidantesCirculo de estudios INMETAMINAMNoch keine Bewertungen
- Cianuracion Por AgitacionDokument18 SeitenCianuracion Por AgitacionA Crispin AnibalNoch keine Bewertungen
- Lixiviacion de Zinc Sesion Vi PDFDokument14 SeitenLixiviacion de Zinc Sesion Vi PDFAntonio FernandezNoch keine Bewertungen
- DocumenttDokument22 SeitenDocumenttestefanyNoch keine Bewertungen
- Speiss El ChamirDokument1 SeiteSpeiss El ChamirBlanca Mariela Ccari CuentaNoch keine Bewertungen
- Clase 1 Introduccion A La PirometalurgiaDokument8 SeitenClase 1 Introduccion A La Pirometalurgiafrancisca gonzalezNoch keine Bewertungen
- Hornos Contop y KivcetDokument8 SeitenHornos Contop y KivcetJhalin GutierrezNoch keine Bewertungen
- Cinética de La Producción de Sulfato de Cobre Pentahidratado A Partir de Chatarra de CobreDokument13 SeitenCinética de La Producción de Sulfato de Cobre Pentahidratado A Partir de Chatarra de CobreROYAL CHEMICAL DEL PERU100% (1)
- Piro-3-2019 (Full)Dokument13 SeitenPiro-3-2019 (Full)Ivan Cerquera PerezNoch keine Bewertungen
- Construcción de La PilaDokument4 SeitenConstrucción de La PilaDiego Cáceres Barrios0% (1)
- Depresor de Sulfuros de FeDokument5 SeitenDepresor de Sulfuros de FeElmer QueaNoch keine Bewertungen
- Reactivos o ModificadoresDokument13 SeitenReactivos o ModificadoresDiegoEstares100% (1)
- Laboratorio 6 Procesos Metalúrgicos I (Autoguardado)Dokument10 SeitenLaboratorio 6 Procesos Metalúrgicos I (Autoguardado)Adrian Chacchi LuqueNoch keine Bewertungen
- LABORATORIO N.º6 AvanceDokument14 SeitenLABORATORIO N.º6 AvanceSoledad Mamani HinchoNoch keine Bewertungen
- 1 Tecsup Termodinamica de La Cianuracion 777777Dokument36 Seiten1 Tecsup Termodinamica de La Cianuracion 777777Gianfranco Ampuero VillavicencioNoch keine Bewertungen
- TOSTACIONDokument4 SeitenTOSTACIONjuan carlosNoch keine Bewertungen
- Programación Xxiii Jie 2019Dokument57 SeitenProgramación Xxiii Jie 2019CarolinaRodriguezSotoNoch keine Bewertungen
- Proceso DHDokument16 SeitenProceso DHCarolinaRodriguezSotoNoch keine Bewertungen
- Taller de Electrotecnia NDokument6 SeitenTaller de Electrotecnia NCarolinaRodriguezSotoNoch keine Bewertungen
- Proceso DHDokument9 SeitenProceso DHCarolinaRodriguezSoto0% (1)
- Constructor AsDokument4 SeitenConstructor AsCarolinaRodriguezSotoNoch keine Bewertungen
- Taller Clasificacion de Los Aceros 1Dokument3 SeitenTaller Clasificacion de Los Aceros 1CarolinaRodriguezSotoNoch keine Bewertungen
- BrandingDokument4 SeitenBrandingCarolinaRodriguezSotoNoch keine Bewertungen
- BrandingDokument4 SeitenBrandingCarolinaRodriguezSotoNoch keine Bewertungen
- Analisis 2.0Dokument3 SeitenAnalisis 2.0CarolinaRodriguezSotoNoch keine Bewertungen
- 4593-Texto Del Artículo-7767-1-10-20181210Dokument20 Seiten4593-Texto Del Artículo-7767-1-10-20181210Fernanda Manrique SuarezNoch keine Bewertungen
- BrandingDokument4 SeitenBrandingCarolinaRodriguezSotoNoch keine Bewertungen
- El Litio 2Dokument8 SeitenEl Litio 2CarolinaRodriguezSotoNoch keine Bewertungen
- BrandingDokument4 SeitenBrandingCarolinaRodriguezSotoNoch keine Bewertungen
- Suelos Licuables - Si PDFDokument278 SeitenSuelos Licuables - Si PDFCarolinaRodriguezSotoNoch keine Bewertungen
- Ensayo de Tracción Materiales ReforzadosDokument95 SeitenEnsayo de Tracción Materiales ReforzadosCarolinaRodriguezSotoNoch keine Bewertungen
- Pautas para Elaborar Un EnsayoDokument5 SeitenPautas para Elaborar Un EnsayoAaron CasanovaNoch keine Bewertungen
- Extraccion y Usos de Titanio y TungstenoDokument2 SeitenExtraccion y Usos de Titanio y TungstenoCarolinaRodriguezSotoNoch keine Bewertungen
- Informe Fisiologia Vegetal L CorrecionDokument6 SeitenInforme Fisiologia Vegetal L CorrecionCarolinaRodriguezSotoNoch keine Bewertungen
- Tablas ProbabilidadesDokument69 SeitenTablas ProbabilidadesManuel Buendia100% (1)
- ASTM G 59.en - EsDokument4 SeitenASTM G 59.en - EsyeisonNoch keine Bewertungen
- PELETIZACIÓNDokument8 SeitenPELETIZACIÓNCarolinaRodriguezSotoNoch keine Bewertungen
- LitioDokument7 SeitenLitioCarolinaRodriguezSotoNoch keine Bewertungen
- Composición Química A304Dokument9 SeitenComposición Química A304CarolinaRodriguezSotoNoch keine Bewertungen
- ASTM G 102.españolDokument7 SeitenASTM G 102.españolJeniffer TrianaNoch keine Bewertungen
- Informe Fisiologia Vegetal L CorrecionDokument6 SeitenInforme Fisiologia Vegetal L CorrecionCarolinaRodriguezSotoNoch keine Bewertungen
- Taller Electro 2Dokument2 SeitenTaller Electro 2CarolinaRodriguezSotoNoch keine Bewertungen
- LitioDokument4 SeitenLitioCarolinaRodriguezSotoNoch keine Bewertungen
- Lixiviación de NíquelDokument3 SeitenLixiviación de NíquelfabioNoch keine Bewertungen
- Polarización EléctricoDokument1 SeitePolarización EléctricoCarolinaRodriguezSotoNoch keine Bewertungen
- Forja InformeDokument24 SeitenForja InformeJhoseph Rafael Paucar PradoNoch keine Bewertungen
- La Ceramica Dorada en El Noreste de La Peníssula Ibérica. Las Taifas de Zaragoza y AlbarracínDokument44 SeitenLa Ceramica Dorada en El Noreste de La Peníssula Ibérica. Las Taifas de Zaragoza y AlbarracínFranciscoJavierGutiérrezGonzález100% (1)
- Autoevaluación Del Tema Nomenclatura y Formulación 2020Dokument9 SeitenAutoevaluación Del Tema Nomenclatura y Formulación 2020juan godoyNoch keine Bewertungen
- Rocas MetamorficasDokument7 SeitenRocas MetamorficasJose Adalberto Sarricolea ValenciaNoch keine Bewertungen
- El FardoDokument5 SeitenEl FardoManuel BrionesNoch keine Bewertungen
- Bandejas Portacables LF TECNADokument24 SeitenBandejas Portacables LF TECNAANDYAFANADORNoch keine Bewertungen
- 03 e Pipetube Es WebDokument18 Seiten03 e Pipetube Es WebelvagojpNoch keine Bewertungen
- Sales HaloideasDokument16 SeitenSales HaloideasMónica LaimeNoch keine Bewertungen
- Aceros y FundicionesDokument49 SeitenAceros y FundicionesDeiner diaz mirandaNoch keine Bewertungen
- Sal - Final de FinalesDokument26 SeitenSal - Final de FinalesMichael G. QuispeNoch keine Bewertungen
- Presentacion Del Estudio Tecnológico Del AceroDokument17 SeitenPresentacion Del Estudio Tecnológico Del AceroStalin RuizNoch keine Bewertungen
- Catalogo FondosDokument17 SeitenCatalogo FondosapiseyNoch keine Bewertungen
- Ensayos de Propiedades Mecanicas de TraccionDokument29 SeitenEnsayos de Propiedades Mecanicas de TraccionMati PeraltaNoch keine Bewertungen
- Informe de QuimicaDokument5 SeitenInforme de QuimicaCristian Tabares100% (1)
- Informe Yoduro de EstañoDokument6 SeitenInforme Yoduro de EstañoSebastianRomeroGilbert100% (1)
- KMN O4Dokument8 SeitenKMN O4Israel NarvastaNoch keine Bewertungen
- Tabla de Calculo GasDokument9 SeitenTabla de Calculo GasGonzaloMuñozDiParodiNoch keine Bewertungen
- Acido NítricoDokument7 SeitenAcido NítricoMario Ramiro Humerez DiazNoch keine Bewertungen
- Guía de Ejercicios de Calorimetría PDFDokument1 SeiteGuía de Ejercicios de Calorimetría PDFLeo BloiseNoch keine Bewertungen
- Trabajo Ejercicios Ceramica y RefractariosDokument11 SeitenTrabajo Ejercicios Ceramica y RefractariosMaria Consuelo Vega Guerra100% (1)
- Caracterización de Jugo de Uva PDFDokument18 SeitenCaracterización de Jugo de Uva PDFDiliamny HernandezNoch keine Bewertungen
- Alistamiento para Soldar Con Tig Acero InoxidableDokument2 SeitenAlistamiento para Soldar Con Tig Acero InoxidableAndres PinedaNoch keine Bewertungen
- Determinacion de Sodio, Potasio y Calcio en Alimentos Digestion Por Horno y Determinación Por AasDokument13 SeitenDeterminacion de Sodio, Potasio y Calcio en Alimentos Digestion Por Horno y Determinación Por Aaserasmo_arriola_v0% (1)
- Escrito de EmprendimientoDokument10 SeitenEscrito de EmprendimientoDennys SanaguanoNoch keine Bewertungen
- Folleto Seguridad Control Fosfuros MetalicosDokument5 SeitenFolleto Seguridad Control Fosfuros MetalicosAnticristh6666Noch keine Bewertungen
- Hoja Tecnica Aa3 PDFDokument3 SeitenHoja Tecnica Aa3 PDFgabriel_127971761Noch keine Bewertungen
- Proceso Constructivo de Un MuroDokument18 SeitenProceso Constructivo de Un MuroJuan Carlos Carranza Torres100% (1)
- SEMINARIOPigmentos 32679Dokument60 SeitenSEMINARIOPigmentos 32679NievesKarinaCNoch keine Bewertungen
- Cormyr 3 - La Muerte Del Dragon - Ed GreenwoodDokument253 SeitenCormyr 3 - La Muerte Del Dragon - Ed GreenwoodAngel Cares MarinNoch keine Bewertungen
- Lab 11Dokument11 SeitenLab 11DiegoNoch keine Bewertungen
- Presentacion Tuberia 06 Mayo 2015Dokument74 SeitenPresentacion Tuberia 06 Mayo 2015Alejandro Araya100% (1)