Beruflich Dokumente
Kultur Dokumente
Curvas de Titulación de Aminoácidos 2.0
Hochgeladen von
Edwin Cruz0%(1)0% fanden dieses Dokument nützlich (1 Abstimmung)
579 Ansichten3 SeitenCurvas de titulación de aminoácidos (titulaciones plenipotenciarias)
Copyright
© © All Rights Reserved
Verfügbare Formate
DOCX, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCurvas de titulación de aminoácidos (titulaciones plenipotenciarias)
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
0%(1)0% fanden dieses Dokument nützlich (1 Abstimmung)
579 Ansichten3 SeitenCurvas de Titulación de Aminoácidos 2.0
Hochgeladen von
Edwin CruzCurvas de titulación de aminoácidos (titulaciones plenipotenciarias)
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 3
Grupo: 4QM2 Sección: 4 Eq.
: 4 Fecha: 05/02/2019 Integrantes del equipo: Cruz Valencia Edwin Alexis
Zempoaltecatl Rodríguez Alejandra
INSTITUTO POLITÉCNICO NACIONAL
ESCUELA NACIONAL DE CIENCIAS BIOLÓGICAS
Laboratorio Bioquímica General
Reporte de práctica - Curvas de titulación de aminoácidos
(titulaciones potenciométricas)
INTRODUCCIÓN RESULTADOS
El comportamiento bioquímico de muchos Tabla no. 1 Datos de pH de distintas sustancias
compuestos importantes depende de sus al ser titulados con NaOH 0.1 N
propiedades ácido – base; éstas propiedades
Titulante (20 mL) - NaOH 0.1N
pueden ser estudiadas por medio del proceso de Sustancia titulada (20 mL)
titulación e ir siguiendo la variación de pH Glicina
acontecida con la ayuda de un dispositivo como Alícuota CH3CO 0.1N +
HCl Glicina
el potenciómetro. (mL) OH Formol
0.1N 0.1N
0.1N neutro
Cuando un aminoácido es disuelto en agua este 2 mL
existe en solución como un ion dipolar, o pH
zwitterion, el cuál puede actuar como un ácido 0 1.33 2.83 4.85 4.25
(donar de protones) o como una base (aceptor 2 1.28 3.58 8.57 5.15
3 1.31 4.17 9.03 5.6
de protones).
5 1.49 4.65 9.37 6.06
Las substancias que poseen esta propiedad son 5 1.79 5.14 9.45 6.48
1 1.89 5.28 9.66 6.56
llamadas anfóteras o anfolitos (por ser
1 2.01 5.43 9.7 6.65
electrolitos anfóteros). 1 2.19 5.66 9.74 6.73
Un α-aminoácido, tal como la Alanina, es 1 2.56 6.05 9.77 6.82
0.5 *2.82 6.47 9.78 6.87
realmente un ácido diprótico cuando el grupo
0.5 *3.43 9.28 9.8 6.91
carboxilo y el grupo amino se encuentran
completamente protonados. Resultados incorrectos pues en esta titulación el
último mL no debía adicionarse en dos partes de
0.5 sino en una de 0.2, 0.3 y 0.1 repetido cinco
veces para alcanzar la neutralidad.
OBJETIVOS
1. Entender el porqué del comportamiento
grafico de los electrolitos fuertes y Tabla no. 2 Datos de pH de Glicina y Glicina
débiles al ser titulados con una base más Formol al ser titulados con HCl 0.1N
fuerte.
Titulante (20 mL) - HCl 0.1N
2. Observar la propiedad anfótera de los
Sustancia titulada (20 mL)
aminoácidos por medio del método de Alícuota
Glicina 0.1N +
Sörensen. (mL) Glicina 0.1N
Formol neutro 2 mL
3. Demostrar que los aminoácidos en pH
solución se hayan como zwitteriones. 0 4.84 4.25
2 3.6 3.55
3 3.19 3.13
5 2.86 2.79
5 2.63 2.57
1 2.6 2.53
1 2.56 2.5 Luego se tituló con NaOH, teniendo un cambio
1 2.53 2.45 de más de 2 unidades de pH con 2 ml con
1 2.49 2.42 respecto al inicial. el pH obtenido a los 10ml
0.5 2.48 2.4
corresponde al pKa2 de 9.37.
0.5 2.46 2.39
Al realizar el mismo procedimiento de titulación,
pero con glicina + formol.
pH
Fig. 2 Reacción Formaldehído con Glicina
Al comparar la gráfica de la glicina y glicina +
formol tituladas con HCl, estas presentan una
variación mínima, mientras que, al ser tituladas
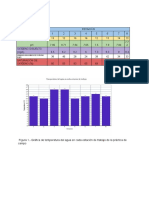
Fig. 1 Curvas de titulación, del lado izquierdo Glicina con NaOH, y compararlas se observa una gran
0.1N y Glicina con Formol, ambos titulados con HCl diferencia.
0.1N. Del lado derecho HCl 0.1N (ácido fuerte),
CH3COOH 0.1N (ácido débil), Glicina 0.1N y Glicina Analizando estos resultados nos permitió saber
con Formol, titulados con NaOH 0.1 N. que el estado inicial de la glicina era en forma de
zwitterion (fig. 2), haciendo que la carga neta de
DISCUSIÓN la molécula fuera 0, que es el punto medio de las
Partiendo del hecho de que la Glicina es un dos titulaciones, también llamado punto
aminoácido y por esto cuenta con un grupo isoeléctrico, el cual tuvo un valor experimental
amino y un grupo carboxilo, se intentó de 6.125.
corroborar su propiedad anfótera, por lo que se
tituló con NaOH 0.1 N y HCl 0.1 N, en ambas
titulaciones se midió el pH inicial (4.84 en ambas
ocasiones).
Fig. 3 Reacciones de ionización del proceso de
A continuación, se tituló con HCl provocando titulación con NaOH y HCl.
que el aminoácido se encontrará totalmente
CONCLUSIONES
protonado, esto provoco un cambio de +/- 2
unidades del pH con 5ml de HCl con respecto al Con los resultados obtenidos pudimos concluir
inicial, esto se observó hasta que se obtuvo la que el grupo amino y el grupo carboxilo, si le
curva de titulación. confieren las propiedades anfóteras a la glicina,
además de conocer que el grupo amino era
A la mitad de esta titulación se alcanzó el pH que
quien actuaba como el donador de protones y el
corresponde a un pKa1 de 2.86 cuando se
grupo carboxilo como el aceptor de protones.
añadieron 10 mL de HCI, correspondiente a la
mitad de los equivalentes de glicina en la Con las gráficas de CH3COOH y HCl se pudo
solución. observar que la glicina actúa como un ácido
débil, ya que el comportamiento de su curva es
más semejante a la del CH3COOH.
BIBLIOGRAFÍA
1.
Aminoacids.
http://www.bioinfo.org.cn/book/biochemistr
y/chapt05/bio2.htm. 03/02/2019.
2.
What is the titration curve of glycine?.
https://socratic.org/questions/what-is-the-
titration-curve-of-glycine. 03/02/2019
3.
Campbell Mary K., F. S. (2012). Biochemistry (7°
ed.). Belmont, Canadá : Cengage learning.
Das könnte Ihnen auch gefallen
- Terapia NeuralDokument22 SeitenTerapia NeuralJuan Fernando100% (5)
- Citricos CompletoDokument120 SeitenCitricos Completononoviejon100% (4)
- Caso Clinico Hernia DiscalDokument83 SeitenCaso Clinico Hernia DiscalJohn Romero CevallosNoch keine Bewertungen
- Introducción Teorías de La MotivaciónDokument27 SeitenIntroducción Teorías de La MotivaciónAna VásquezNoch keine Bewertungen
- Energia OrgonDokument17 SeitenEnergia Orgonmia novoa torres100% (1)
- Curvas de Titulación de AminoácidosDokument2 SeitenCurvas de Titulación de AminoácidosIvan Alain EspejelNoch keine Bewertungen
- Aislamiento y caracterización de DNA vegetal mediante espectrofotometría y cromatografíaDokument3 SeitenAislamiento y caracterización de DNA vegetal mediante espectrofotometría y cromatografíafcbarcelona-08hotmail.comNoch keine Bewertungen
- Carbohidratos y Acidos OrganicosDokument5 SeitenCarbohidratos y Acidos OrganicosLalo Tolentino100% (1)
- Eco Práctica 6 FinalDokument12 SeitenEco Práctica 6 Finalmartha100% (1)
- Separacion de FosfolipidosDokument2 SeitenSeparacion de Fosfolipidosfcbarcelona-08hotmail.comNoch keine Bewertungen
- Introduccion: ResultadosDokument3 SeitenIntroduccion: ResultadosLuis RojasNoch keine Bewertungen
- Práctica No. 13 Aislamiento Del DNA Plasmídico Lab. Bioquímica GeneralDokument4 SeitenPráctica No. 13 Aislamiento Del DNA Plasmídico Lab. Bioquímica GeneralPaola VianeyNoch keine Bewertungen
- Elaboración de Abono OrgánicoDokument23 SeitenElaboración de Abono OrgánicoDAYANoch keine Bewertungen
- Bioquìmica ENCB DNA VegetalDokument3 SeitenBioquìmica ENCB DNA VegetalDioney TellezNoch keine Bewertungen
- BiogeografiaDokument48 SeitenBiogeografiaComputo Biologia Unsa88% (8)
- Practica No.4 Elaboracion de Una EnsaldaDokument12 SeitenPractica No.4 Elaboracion de Una EnsaldaOz HdzNoch keine Bewertungen
- Bca y Bradford (20096) PDFDokument20 SeitenBca y Bradford (20096) PDFKenia VilchisNoch keine Bewertungen
- ADNDokument3 SeitenADNSamantha MTNoch keine Bewertungen
- Practica DNADokument2 SeitenPractica DNASyg Delgado100% (1)
- Banco de Preguntas IIDokument10 SeitenBanco de Preguntas IINadir al bu lah100% (1)
- 6 Práctica LisozimaDokument5 Seiten6 Práctica LisozimalinaNoch keine Bewertungen
- Curvas de Titulacion de AminoacidosDokument4 SeitenCurvas de Titulacion de Aminoacidos'Marisol' Cubides0% (1)
- ProteínasDokument5 SeitenProteínasKimberly TorresNoch keine Bewertungen
- Hidrolisis de Una ProteinaDokument6 SeitenHidrolisis de Una Proteinalalo_kndNoch keine Bewertungen
- Practica No. 3 "Análisis de La Calidad Del Agua II. Determinación Microbiológica"Dokument4 SeitenPractica No. 3 "Análisis de La Calidad Del Agua II. Determinación Microbiológica"Brenda M.Noch keine Bewertungen
- Microorganismos acuáticosDokument5 SeitenMicroorganismos acuáticosPanchoNoch keine Bewertungen
- Determinación Espectrofotométrica Del Pka de Un ColoranteDokument22 SeitenDeterminación Espectrofotométrica Del Pka de Un ColoranteAriadna GarcíaNoch keine Bewertungen
- Practica 12 y Ensayos para Proteinas y AminoacidosDokument2 SeitenPractica 12 y Ensayos para Proteinas y AminoacidosElCaballero Modesto0% (1)
- Curva Tipo Azucares ReductoresDokument2 SeitenCurva Tipo Azucares ReductoresJeeniffer CookieeNoch keine Bewertungen
- CUESTIONARIODokument1 SeiteCUESTIONARIOHector QNoch keine Bewertungen
- Curvas3 0Dokument2 SeitenCurvas3 0Tuistwer GoparNoch keine Bewertungen
- Práctica 1 Curvas de Titulación BQ FinalDokument2 SeitenPráctica 1 Curvas de Titulación BQ FinalKriizztii ShaadiiyNoch keine Bewertungen
- Practica 2. Punto IsoelectricoDokument2 SeitenPractica 2. Punto IsoelectricoPierdant O-oNoch keine Bewertungen
- Efecto Concentración Sustrato y Efecto Inhibidor 4QM1Dokument5 SeitenEfecto Concentración Sustrato y Efecto Inhibidor 4QM1Angel E. RockNoch keine Bewertungen
- Utilización de Carbohidratos y Ácidos Orgánicos ReporticusDokument8 SeitenUtilización de Carbohidratos y Ácidos Orgánicos ReporticusDenise RangelNoch keine Bewertungen
- Factores Afectan Metodo EspectrofotometricoDokument9 SeitenFactores Afectan Metodo EspectrofotometricoLuis RomeroNoch keine Bewertungen
- Exclusión MolecularDokument9 SeitenExclusión MolecularAndrea100% (2)
- Práctica 11 Química Analítica-Díaz Ruiz Luis Fernando 4FM1Dokument4 SeitenPráctica 11 Química Analítica-Díaz Ruiz Luis Fernando 4FM1Fernando diaz ruizNoch keine Bewertungen
- Bioquimica Reacciones de Aminoacidos y ProteinasDokument2 SeitenBioquimica Reacciones de Aminoacidos y ProteinasEvelyn Jim 3295Noch keine Bewertungen
- Reporte Práctica 1 - Método de SangerDokument3 SeitenReporte Práctica 1 - Método de SangerAndy AldamaNoch keine Bewertungen
- Oxido-Reductasas 2Dokument2 SeitenOxido-Reductasas 2luis3felipe3lara3ortNoch keine Bewertungen
- DNA Guayaba - Identificación Bases NitrogenadasDokument3 SeitenDNA Guayaba - Identificación Bases NitrogenadasRosalba Hernández100% (1)
- Bitacora 4. Curva Tipo Azucares ReductoresDokument3 SeitenBitacora 4. Curva Tipo Azucares ReductoresJavier AnguianoNoch keine Bewertungen
- Caracterizacion Quimica GlucogenoDokument2 SeitenCaracterizacion Quimica GlucogenoBertario Ríos GarcíaNoch keine Bewertungen
- Reacción de Transaminación y Su Reconocimiento Por Medio de Cromatogafía en Papel 1Dokument4 SeitenReacción de Transaminación y Su Reconocimiento Por Medio de Cromatogafía en Papel 1karla0% (1)
- Practica 2 Ecologia MicrobianaDokument5 SeitenPractica 2 Ecologia MicrobianaMiguel LunaNoch keine Bewertungen
- Curvas de Titulación de AminoácidosDokument3 SeitenCurvas de Titulación de AminoácidosPao FonsecaNoch keine Bewertungen
- Medicion de PH y Capacidad ReguladoraDokument5 SeitenMedicion de PH y Capacidad ReguladoraManuel SalinasNoch keine Bewertungen
- ColesteroldeyemaDokument3 SeitenColesteroldeyemaSarahid D'mNoch keine Bewertungen
- Síntesis Colorante Azoico Rojo ParaDokument2 SeitenSíntesis Colorante Azoico Rojo ParaMiguel Medina100% (1)
- Determinación de Ácido BóricoDokument5 SeitenDeterminación de Ácido BóricoKaren SalasNoch keine Bewertungen
- Determinación de Aminoácidos Terminales Con Grupo Alfa Amino Libre.Dokument1 SeiteDeterminación de Aminoácidos Terminales Con Grupo Alfa Amino Libre.Gonzalo UribeNoch keine Bewertungen
- Sucesión hongos estiércol vacaDokument5 SeitenSucesión hongos estiércol vacaHéctor ContrerasNoch keine Bewertungen
- Separación, Precipitación de Proteínas y Punto IsoeléctricoDokument3 SeitenSeparación, Precipitación de Proteínas y Punto IsoeléctricolibraNoch keine Bewertungen
- Práctica 2 Sintesis de BenzalacetofenonaDokument2 SeitenPráctica 2 Sintesis de BenzalacetofenonaDenise Rangel100% (1)
- Práctica 5Dokument5 SeitenPráctica 5Hector100% (1)
- Inhibición EnzimaticaDokument2 SeitenInhibición EnzimaticaJonathan R. EstradaNoch keine Bewertungen
- Reporte de Practica 4Dokument5 SeitenReporte de Practica 4GabrielVazquezOlveraNoch keine Bewertungen
- Efecto de La Concentración de Sustrato Sobre La Velocidad de La ReacciónDokument2 SeitenEfecto de La Concentración de Sustrato Sobre La Velocidad de La ReacciónMariela Pérez RodarteNoch keine Bewertungen
- Metodo de SangerDokument2 SeitenMetodo de SangerggggggNoch keine Bewertungen
- CUESTIONARIODokument3 SeitenCUESTIONARIOALEJANDRO ALVARADONoch keine Bewertungen
- Practica 2 Report eDokument10 SeitenPractica 2 Report eEdson GonzalezNoch keine Bewertungen
- Fisicoquimica Practica 1Dokument8 SeitenFisicoquimica Practica 1monicaNoch keine Bewertungen
- Bitácora-Efecto de La Concentración de Enzima Sobre La Velocidad de Reacción-Efecto Del PH Sobre La Velocidad de ReacciónDokument5 SeitenBitácora-Efecto de La Concentración de Enzima Sobre La Velocidad de Reacción-Efecto Del PH Sobre La Velocidad de ReacciónDynarko RuizNoch keine Bewertungen
- Cuestionario Practica 7Dokument3 SeitenCuestionario Practica 7Omar Popoca100% (1)
- PRACTICANITROGENODokument9 SeitenPRACTICANITROGENOBrenda M.Noch keine Bewertungen
- Titulación de AminoácidosDokument4 SeitenTitulación de AminoácidosLuis AlcocerNoch keine Bewertungen
- Reporte de Práctica No. 4 Curvas de Titulación de Aminoácidos Gpo 3FM1 Mata Cruz Pablo Israel Colin Oseguera Jorge RafaelDokument4 SeitenReporte de Práctica No. 4 Curvas de Titulación de Aminoácidos Gpo 3FM1 Mata Cruz Pablo Israel Colin Oseguera Jorge RafaelPablo Israel Mata CruzNoch keine Bewertungen
- Practica PLÁSMIDOSDokument11 SeitenPractica PLÁSMIDOSEdwin CruzNoch keine Bewertungen
- Estres Oxidativo y AntioxidantesDokument7 SeitenEstres Oxidativo y AntioxidantesOsiris GonzálezNoch keine Bewertungen
- Dermatofitosis PDFDokument7 SeitenDermatofitosis PDFFranky ClaviteaNoch keine Bewertungen
- Practica 8Dokument9 SeitenPractica 8Edwin CruzNoch keine Bewertungen
- Caracterizacion Del GlucogenoDokument3 SeitenCaracterizacion Del GlucogenoEdwin CruzNoch keine Bewertungen
- Colesterol JulioDokument2 SeitenColesterol JulioEdwin CruzNoch keine Bewertungen
- Colesterol JulioDokument2 SeitenColesterol JulioEdwin CruzNoch keine Bewertungen
- El Reino Animal IIIDokument27 SeitenEl Reino Animal IIIEdwin CruzNoch keine Bewertungen
- An - Lisis de La Calidad Del Agua I Determinaciones Fisicoqu - MicasDokument7 SeitenAn - Lisis de La Calidad Del Agua I Determinaciones Fisicoqu - MicasEdwin CruzNoch keine Bewertungen
- Ciclo Del AzufreDokument5 SeitenCiclo Del AzufreEdwin CruzNoch keine Bewertungen
- Practica 1 SCCDokument7 SeitenPractica 1 SCCEdwin CruzNoch keine Bewertungen
- Casos Problema 2-19Dokument11 SeitenCasos Problema 2-19Edwin CruzNoch keine Bewertungen
- Coliformes 2.0Dokument4 SeitenColiformes 2.0Edwin CruzNoch keine Bewertungen
- Microorganismos en la columna de WinogradskyDokument48 SeitenMicroorganismos en la columna de WinogradskyEdwin CruzNoch keine Bewertungen
- Ambiente AéreoDokument43 SeitenAmbiente AéreoEdwin CruzNoch keine Bewertungen
- GraficasDokument7 SeitenGraficasEdwin CruzNoch keine Bewertungen
- Intoxicación Por Plomo (Final)Dokument34 SeitenIntoxicación Por Plomo (Final)Edwin CruzNoch keine Bewertungen
- 4to. Autorrepaso 19Dokument7 Seiten4to. Autorrepaso 19Edwin CruzNoch keine Bewertungen
- Reporte de CandidasDokument4 SeitenReporte de CandidasEdwin CruzNoch keine Bewertungen
- AmígdalaDokument1 SeiteAmígdalaEdwin CruzNoch keine Bewertungen
- 4to. Autorrepaso 19Dokument1 Seite4to. Autorrepaso 19Edwin CruzNoch keine Bewertungen
- Grupo SanguineoDokument2 SeitenGrupo SanguineoEdwin CruzNoch keine Bewertungen
- P8 Interacciones Microbianas Aplicaciones en SueloDokument7 SeitenP8 Interacciones Microbianas Aplicaciones en SueloEdwin CruzNoch keine Bewertungen
- Curvas Tipo de Azucares ReductoresDokument2 SeitenCurvas Tipo de Azucares ReductoresEdwin CruzNoch keine Bewertungen
- An - Lisis de La Calidad Del Agua I Determinaciones Fisicoqu - MicasDokument7 SeitenAn - Lisis de La Calidad Del Agua I Determinaciones Fisicoqu - MicasEdwin CruzNoch keine Bewertungen
- CoccidioidomicosisDokument12 SeitenCoccidioidomicosisEdwin CruzNoch keine Bewertungen
- Valor Tipo PH 78 Error de CapturaDokument1 SeiteValor Tipo PH 78 Error de CapturaEdwin CruzNoch keine Bewertungen
- Autores:: Manual de Practica de Morf. Del Aparato Locomotor, Cabeza Y Cuello 2023-1Dokument219 SeitenAutores:: Manual de Practica de Morf. Del Aparato Locomotor, Cabeza Y Cuello 2023-1Jean ToledoNoch keine Bewertungen
- Cuadro Comparativo Procariotas y EucariotasDokument1 SeiteCuadro Comparativo Procariotas y EucariotasF C0% (1)
- Linea Del Tiempo - MicologiaDokument5 SeitenLinea Del Tiempo - MicologiaCarlos Ku MijangosNoch keine Bewertungen
- Caso Clinico - EsclerodermiaDokument10 SeitenCaso Clinico - EsclerodermiaCarlos Antonio Greenwich SandovalNoch keine Bewertungen
- Guia Ejercicio ConcentracionDokument16 SeitenGuia Ejercicio Concentraciondilmar86Noch keine Bewertungen
- Abc Holotranscobalamina PDFDokument6 SeitenAbc Holotranscobalamina PDFJuan GomezNoch keine Bewertungen
- TeratogénesisDokument25 SeitenTeratogénesisAngel MirandaNoch keine Bewertungen
- S12 Jmadalengoitia 2018 01 PDFDokument19 SeitenS12 Jmadalengoitia 2018 01 PDFedwin waldemar lopez vegaNoch keine Bewertungen
- Programas de mejora genética del conejo: Razas y líneas seleccionadasDokument112 SeitenProgramas de mejora genética del conejo: Razas y líneas seleccionadasAna Siles IncaNoch keine Bewertungen
- Biología 5to Año: Características de Los Compuestos OrgánicosDokument3 SeitenBiología 5to Año: Características de Los Compuestos OrgánicosMaria RamirezNoch keine Bewertungen
- ¿Cuáles Son Las Partes Del ADN?: InvertidaDokument9 Seiten¿Cuáles Son Las Partes Del ADN?: InvertidaLeonardo RuizNoch keine Bewertungen
- Evolución y ConductaDokument2 SeitenEvolución y ConductaLJKaren100% (1)
- Lab ESTABLECIMIENTO - PIÑADokument10 SeitenLab ESTABLECIMIENTO - PIÑADaniel CastillaNoch keine Bewertungen
- Desarrollo Emocional Según Jean PiagetDokument14 SeitenDesarrollo Emocional Según Jean PiagetLuis Lopez MartinezNoch keine Bewertungen
- Desarrollo Neurológico en El AdolescenteDokument7 SeitenDesarrollo Neurológico en El AdolescenteKatinaGonzalesYovera100% (1)
- Manual Huertos Urbanos Proyecto VMS 2 PDFDokument20 SeitenManual Huertos Urbanos Proyecto VMS 2 PDFFernando PachecoNoch keine Bewertungen
- Variedades de Mango EcuatorianoDokument6 SeitenVariedades de Mango EcuatorianoYonatan Ysrael ZuritaNoch keine Bewertungen
- Ludwig Von BertalanffyDokument38 SeitenLudwig Von BertalanffyMacias Miguel100% (1)
- Oficio - Clase 1Dokument6 SeitenOficio - Clase 1jhoanaveNoch keine Bewertungen
- Tema 3 NeuriDokument46 SeitenTema 3 Neuriyungmario MRNoch keine Bewertungen
- Adenosina TrifosfatoDokument5 SeitenAdenosina TrifosfatoCaArloss Adriian MarrtiinezzNoch keine Bewertungen
- Eosinofilia y ParasitosisDokument17 SeitenEosinofilia y ParasitosisErik J. Roshan FloresNoch keine Bewertungen