Beruflich Dokumente
Kultur Dokumente
Cinetica Quimica 21 Questoes Com Gabarito
Hochgeladen von
Cíntia Ghetti0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
739 Ansichten6 SeitenI) O documento apresenta diagramas de energia de reações químicas com e sem catalisador.
II) Fornece informações sobre velocidades de reações em diferentes intervalos de tempo.
III) Discute fatores que afetam a velocidade de reações como temperatura, concentração e área de superfície.
Originalbeschreibung:
Copyright
© Attribution Non-Commercial (BY-NC)
Verfügbare Formate
DOC, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenI) O documento apresenta diagramas de energia de reações químicas com e sem catalisador.
II) Fornece informações sobre velocidades de reações em diferentes intervalos de tempo.
III) Discute fatores que afetam a velocidade de reações como temperatura, concentração e área de superfície.
Copyright:
Attribution Non-Commercial (BY-NC)
Verfügbare Formate
Als DOC, PDF, TXT herunterladen oder online auf Scribd lesen
0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
739 Ansichten6 SeitenCinetica Quimica 21 Questoes Com Gabarito
Hochgeladen von
Cíntia GhettiI) O documento apresenta diagramas de energia de reações químicas com e sem catalisador.
II) Fornece informações sobre velocidades de reações em diferentes intervalos de tempo.
III) Discute fatores que afetam a velocidade de reações como temperatura, concentração e área de superfície.
Copyright:
Attribution Non-Commercial (BY-NC)
Verfügbare Formate
Als DOC, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 6
1) (Pucmg 2008) Considere o gráfico substância B e as espécies a cada
a seguir, referente aos diagramas momento segundo o tempo indicado.
energéticos de uma reação química
com e sem catalisador.
Sobre a velocidade dessa reação, é
correto afirmar que a velocidade de:
Assinale a afirmativa CORRETA. a) decomposição da substância A, no
a) A reação é endotérmica. intervalo de tempo de 0 a 20 s, é 0,46
b) A energia de ativação em presença mol /s.
do catalisador é 150 kJ. b) decomposição da substância A, no
c) A curva II representa o diagrama intervalo de tempo de 20 a 40 s, é
energético da reação catalisada. 0,012 mol/ s.
d) A reação acontece em duas c) decomposição da substância A, no
etapas. intervalo de tempo de 0 a 40 s, é
0,035 mol/ s.
2)(Ufrj2008 d) formação da substância B, no
intervalo de tempo de 0 a 20 s, é 0,46
mol /s.
e) formação da substância B, no
intervalo de tempo de 0 a 40 s, é 0,70
mol/ s.
4) (Pucsp 2007) O dióxido de
nitrogênio (NO2) reage com o
monóxido de carbono (CO) formando
o óxido nítrico (NO) e o dióxido de
a) Indique as etapas endotérmicas e carbono (CO2).
exotérmicas.
b) Calcule a variação da entalpia na NO2(g) + CO(g) → NO(g) + CO2(g)
conversão do CO‚ em metanol.
c) Indique a etapa lenta do processo.
Justifique sua resposta.
3) (Puc rio 2008) Considere a reação
de decomposição da substância A na
Analisando o diagrama de ( ) O aumento da temperatura
coordenadas de reação apresentado, diminui a energia de ativação,
um estudante fez as seguintes diminuindo, portanto, o tempo de
afirmações: dissolução.
I. A energia de ativação para a A seqüência correta é
formação do óxido nítrico é de 132 a) V - F - V - V.
kJ/ mol. b) F - V - F - V.
II. A formação do óxido nítrico é um c) V - V - F - V.
processo endotérmico. d) F - F - V - F.
III. O aumento da temperatura do e) V - V - F - F.
sistema reacional diminui a
velocidade de formação do óxido 6) (Ufrs) Observe o gráfico a seguir.
nítrico, pois aumenta a energia de
ativação da reação.
Está(ão) correta(s) somente a(s)
afirmação(ões)
a) I.
b) II.
c) III.
d) I e II.
e) I e III. O perfil da reação genérica A ë B,
5) (Ufsm 2007) Um comprimido nele representado, indica que a
efervescente de vitamina C intacto, energia de ativação do processo, em
pesando 5 g, quando colocado em kJ, é igual a
um copo contendo água a 25 °C, será a) 100.
dissolvido em dois minutos. b) 150.
Considerando essa informação, c) 250.
assinale verdadeira (V) ou falsa (F) d) 300.
em cada uma das proposições. e) 400.
( ) Se o comprimido efervescente 7) Quando uma fita de magnésio é
estiver em pequenos pedaços, o mergulhada em uma solução aquosa
tempo de dissolução também será de de ácido clorídrico, ocorre a reação:
dois minutos, pois a massa continua
sendo 5 g. Mg(s) + 2HCl(aq) → MgC2(aq) + H2(g)
( ) O tempo de dissolução do
comprimido efervescente intacto A temperatura da solução e a
mantém-se quando o comprimido for concentração do ácido afetam a
dissolvido em água a 40 °C, pois a velocidade da reação de oxidação do
área de contato é a mesma. magnésio. Considere as condições
( ) Quanto maior a superfície de experimentais durante a oxidação da
contato do comprimido efervescente fita de magnésio, de acordo com os
com a água, maior o número de registros a seguir.
colisões favoráveis, portanto maior a
velocidade de dissolução.
d) A curva "B" representa a reação
com a presença de um catalisador.
e) A letra "Z" representa o ∆H da
reação de decomposição do H2O2.
10) Em aquários, utilizam-se
borbulhadores de ar para oxigenar a
água. Para um mesmo volume de ar
bombeado nesse processo, bolhas
O magnésio será oxidado, mais pequenas são mais eficientes, porque
rapidamente, no experimento em bolhas pequenas
a) 1. a) a área superficial total é maior.
b) 2. b) a densidade é menor.
c) 3. c) a pressão é maior.
d) 4 d) a velocidade de ascensão é
. menor.
8) Aumentando-se a temperatura em e) o volume total é menor.
um sistema químico reagente, o único
fator que NÃO se altera é a (o) 11) Considere as afirmações sobre
a) energia de ativação da reação. velocidade das reações químicas,
b) tempo para o equilíbrio ser apresentadas a seguir.
alcançado.
c) energia cinética das partículas I. O aumento da superfície de contato
reagentes. entre os reagentes aumenta a
d) número de colisões efetivas entre velocidade da reação.
as partículas. II. O aumento da concentração dos
reagentes aumenta a velocidade da
9) (Ufij) Considere o diagrama de reação.
energia da reação de decomposição III. O aumento da temperatura
do H2O2 representado aumenta a velocidade da reação.
A afirmação está CORRETA em:
a) I apenas.
b) I e II apenas.
c) III apenas.
d) I, II e III.
12) (Ufsm) Para que ocorra uma
. reação química, é necessário que os
Assinale a alternativa INCORRETA: reagentes entrem em contato, através
a) A reação de decomposição do de colisões, o que se chama Teoria
H2O2 é exotérmica. das Colisões. Essa teoria baseia-se
b) A curva "A" apresenta maior em que
energia de ativação que a curva "B".
c) A presença de um catalisador afeta I - todas as colisões entre os
o ∆H da reação. reagentes são efetivas (ou
favoráveis).
II - a velocidade da reação é ( ) A freqüência de colisões
diretamente proporcional ao número efetivas entre reagentes diminui com
de colisões efetivas (ou favoráveis). o aumento de temperatura.
III - existem colisões que não são
favoráveis à formação do produto. ( ) Alumínio em pó pode ser
IV - maior será a velocidade de "queimado" mais facilmente do que
reação, quanto maior for a energia de alumínio em raspas.
ativação.
15) Observa-se que a velocidade de
Estão corretas reação é maior quando um
a) apenas I, II e III. comprimido efervescente, usado no
b) apenas II e III. combate à azia, é colocado:
c) apenas I e IV. a) inteiro, em água que está à
d) apenas I, II e IV. temperatura de 6°C.
e) apenas III e IV. b) pulverizado, em água que está à
temperatura de 45°C.
13) Considere a reação elementar c) inteiro, em água que está à
representada pela equação temperatura de 45°C.
d) pulverizado, em água que está à
3 O2(g) → 2 O3(g) temperatura de 6°C.
e) inteiro, em água que está à
Ao triplicarmos a concentração do temperatura de 25°C.
oxigênio, a velocidade da reação, em
relação à velocidade inicial, torna-se 16) Para responder à questão,
a) duas vezes menor. relacione os fenômenos descritos na
b) três vezes maior. coluna I com os fatores que
c) oito vezes menor. influenciam na velocidade dos
d) nove vezes maior. mesmos, mencionados na coluna II.
e) vinte e sete vezes maior.
COLUNA I
14) Analise as afirmações seguintes,
sobre CINÉTICA QUÍMICA. 1 - Queimadas se alastrando
rapidamente quando está ventando.
( ) A etapa determinante da rapidez 2 - Conservação dos alimentos no
de uma reação química é a mais refrigerador.
lenta. 3 - Efervescência da água oxigenada
na higiene de ferimentos.
( ) Catalisadores não participam 4 - Lascas de madeiras queimando
das etapas de uma reação química. mais rapidamente que uma tora de
madeira.
( ) Uma porção de maionese
deteriora-se mais rapidamente do que COLUNA II
os seus componentes considerados
separadamente, pois, entre outros A - superfície de contato
fatores, a superfície de contato de B - catalisador
cada um é maior. C - concentração
D - temperatura
b) II e III.
A alternativa que contém a c) I, II e III.
associação correta entre as duas d) I, II e IV.
colunas é e) II, III e IV.
a) 1 - C; 2 - D; 3 - B; 4 - A
b) 1 - D; 2 - C; 3 - B; 4 - A 19) No laboratório, o hidrogênio pode
c) 1 - A; 2 - B; 3 - C; 4 - D ser preparado pela reação de zinco
d) 1 - B; 2 - C; 3 - D; 4 - A com solução de ácido clorídrico.
e) 1 - C; 2 - D; 3 - A; 4 – B Observe as condições especificadas
nas experiências a seguir.
17) Considere os diagramas
representativos de Energia (E) versus
coordenada das reações (cr):
A velocidade da reação é maior em
a) I
b) II
c) III
O diagrama da reação mais lenta e o d) IV
da que tem a energia de ativação e) V
igual a zero são, respectivamente,
a) I e II. 20) A seguir estão representadas as
b) I e III. etapas da reação:
c) II e III.
d) I e IV. H2 + Br2 → 2HBr
e) II e IV.
18) Sobre catalisadores, são feitas as
quatro afirmações seguintes.
I - São substâncias que aumentam a
velocidade de uma reação.
II - Reduzem a energia de ativação
da reação.
III - As reações nas quais atuam não A velocidade da reação é
ocorreriam nas suas ausências. determinada pela etapa:
IV - Enzimas são catalisadores a) I
biológicos. b) II
c) III
Dentre estas afirmações, estão d) IV
corretas, apenas: e) V
a) I e II.
21) No estudo cinético de uma reação 10) a
representada por 11) d
12) b
2A(g) + B2(g) → 13) e
2AB(g) 14) V F F F V
15) b
colocou-se os seguintes dados: 16) a
17) b
18) d
19) c
20) b
21) d
A velocidade da reação pode ser
expressa pela reação
a) v = k 2[A]
b) v = k [B]2
c) v = k [A] [B]
d) v = k [A]2 [B]
e) V = K [A] [B]2
Gabarito
1c
2) a) Etapa endotérmica: II ë III.
Etapas exotérmicas: I ë II e III ë IV.
b) ∆H = - 40 kJ.
c) A etapa lenta é a etapa que vai de
II a III, por apresentar a maior energia
de ativação.
3b
4a
5d
6) d
7) d
8) a
9) c
Das könnte Ihnen auch gefallen
- Estatística Aplicada - Atividade 1 - UNILABDokument7 SeitenEstatística Aplicada - Atividade 1 - UNILABCícera EliNoch keine Bewertungen
- Apostila I - Prova Brasil - VERSÃO ALUNO 9° ANODokument68 SeitenApostila I - Prova Brasil - VERSÃO ALUNO 9° ANOLarissaNoch keine Bewertungen
- O Substantivo e Sua Construção de Sentidos Nos Textos.Dokument37 SeitenO Substantivo e Sua Construção de Sentidos Nos Textos.Adriana Moreira da CunhaNoch keine Bewertungen
- Atividade Adaptada - PEDRO 2ºDokument2 SeitenAtividade Adaptada - PEDRO 2ºmaria.nascimentoNoch keine Bewertungen
- Eco Da VidaDokument1 SeiteEco Da VidaNilton RibeiroNoch keine Bewertungen
- Exemplos de Atividades CULTURA DIGITALDokument3 SeitenExemplos de Atividades CULTURA DIGITALVanucci Evaristo100% (1)
- A Catequese Da CaridadeDokument31 SeitenA Catequese Da CaridadeJoão Melo100% (1)
- Temperatura e Dilatação - Exercícios de Fixação e TestesDokument4 SeitenTemperatura e Dilatação - Exercícios de Fixação e TestesArmando Ferreira AlvferreiraNoch keine Bewertungen
- A Parábola Do PerdãoDokument1 SeiteA Parábola Do PerdãoMarta Bastos de SouzaNoch keine Bewertungen
- Puc Rs 2008 2 Prova Completa 2o Dia Com GabaritoDokument21 SeitenPuc Rs 2008 2 Prova Completa 2o Dia Com Gabaritosimonigastmann0% (1)
- Exercícios Rec Física - 2 Série - VetoresDokument9 SeitenExercícios Rec Física - 2 Série - VetoresAntonio Silva50% (2)
- Lista de Exercícios Solubilidade, Concentração e Título - 2º Ano EMDokument1 SeiteLista de Exercícios Solubilidade, Concentração e Título - 2º Ano EMluiz felipe pereira mendesNoch keine Bewertungen
- 4º Ano Caderno 2 Matemática 2021Dokument72 Seiten4º Ano Caderno 2 Matemática 2021Emidia melly Neves de almeidaNoch keine Bewertungen
- Aprenda A Brincar de Xilogravura Sensorial Com Isopor e TintaDokument4 SeitenAprenda A Brincar de Xilogravura Sensorial Com Isopor e TintaThaisNoch keine Bewertungen
- Lista de Estudo Dirigido 1ano FISICA 01Dokument2 SeitenLista de Estudo Dirigido 1ano FISICA 01Cleiton Silva100% (1)
- 2 P.D - 2022 - Cien - 4° Ano - E.F - BPWDokument4 Seiten2 P.D - 2022 - Cien - 4° Ano - E.F - BPWFlávia VeigaNoch keine Bewertungen
- 7 º Avaliação AlavancasDokument3 Seiten7 º Avaliação AlavancasMaurim OlendinoNoch keine Bewertungen
- Fóruns Do 1b - Relação Das AtividadesDokument5 SeitenFóruns Do 1b - Relação Das AtividadesJadiel JunqueiraNoch keine Bewertungen
- Plano de Aula - 3º Medio 3bDokument3 SeitenPlano de Aula - 3º Medio 3bnubia santosNoch keine Bewertungen
- 4 Avaliação de Educação Física 08 de JULHO 4º Ano.Dokument2 Seiten4 Avaliação de Educação Física 08 de JULHO 4º Ano.Francisca PortelaNoch keine Bewertungen
- Apostila 5º Ano Outubro 04113753Dokument40 SeitenApostila 5º Ano Outubro 04113753Flávia MendesNoch keine Bewertungen
- Panfleto Combate À Dengue Simples Ilustrado Amarelo e VermelhoDokument1 SeitePanfleto Combate À Dengue Simples Ilustrado Amarelo e VermelhoWellington LeandroNoch keine Bewertungen
- Planilha Quinzenal 17Dokument5 SeitenPlanilha Quinzenal 17Jane OliverNoch keine Bewertungen
- A Galinha RuivaDokument5 SeitenA Galinha RuivaLisvania LimaNoch keine Bewertungen
- Atividades Ead Quimica 1º - AdaptadaDokument7 SeitenAtividades Ead Quimica 1º - AdaptadaSthefanny TeixeiraNoch keine Bewertungen
- Texto - o CarpinteiroDokument1 SeiteTexto - o CarpinteirolaniagarciaNoch keine Bewertungen
- Aula de PortuguesDokument8 SeitenAula de PortuguesRosângela Da Silva OliveiraNoch keine Bewertungen
- C1201 SubsDokument28 SeitenC1201 SubsLuciana BitencourtNoch keine Bewertungen
- Exercícios - Gases 1 - ENEM - RespostaDokument2 SeitenExercícios - Gases 1 - ENEM - RespostaGiliard CarletiNoch keine Bewertungen
- Peça TeatralDokument4 SeitenPeça TeatralSidnei OliveiraNoch keine Bewertungen
- 19 - Professor Ensino Fundamental - Matemática Prova 02Dokument10 Seiten19 - Professor Ensino Fundamental - Matemática Prova 02Vitoria SampaioNoch keine Bewertungen
- Torta Na CaraDokument6 SeitenTorta Na CaraMarcelo RonzaniNoch keine Bewertungen
- MTM AULA 03 - D20 - ProfessorDokument1 SeiteMTM AULA 03 - D20 - ProfessorDiones Cruz RibeiroNoch keine Bewertungen
- Simulado Matemática - 5º Ano - Material Do ProfessorDokument10 SeitenSimulado Matemática - 5º Ano - Material Do ProfessorEduardo SoutoNoch keine Bewertungen
- Projeto de Vida - Mantenha A Esperança Sempre VivaDokument1 SeiteProjeto de Vida - Mantenha A Esperança Sempre VivaCélio Roberto0% (1)
- Atividade Localização e MovimentaaçãoDokument3 SeitenAtividade Localização e Movimentaaçãojhonatas e beatrizNoch keine Bewertungen
- Atividades MatemáticaDokument2 SeitenAtividades MatemáticaAngela Helena100% (2)
- PPP Caldas Novas 2023Dokument180 SeitenPPP Caldas Novas 2023Livia ReisNoch keine Bewertungen
- Aula 5 - Reações QuímicasDokument35 SeitenAula 5 - Reações QuímicasLeonardo MacielNoch keine Bewertungen
- Os Desafios Da Educação No BrasilVon EverandOs Desafios Da Educação No BrasilNoch keine Bewertungen
- PLANO DE AULA - Matéria e Energia IagoDokument3 SeitenPLANO DE AULA - Matéria e Energia IagoThais Stefany75% (4)
- Otm Eja 3a4 Fases Matematica 2seg2Dokument13 SeitenOtm Eja 3a4 Fases Matematica 2seg2Rodrigo Saldanha-e DejianeNoch keine Bewertungen
- PROVA Atmosfera Terrestre 6 AnoDokument1 SeitePROVA Atmosfera Terrestre 6 AnoCamila Damasceno100% (1)
- AtividadesDokument6 SeitenAtividadesTamires SousaNoch keine Bewertungen
- Plano Leitura Anual PDFDokument2 SeitenPlano Leitura Anual PDFEdenir Araújo100% (1)
- Prova Fsadu São Luís 2023Dokument14 SeitenProva Fsadu São Luís 2023EXATAS CURSINHONoch keine Bewertungen
- Aula 3 - Introdução À Cinemática Escalar e Velocidade MédiaDokument7 SeitenAula 3 - Introdução À Cinemática Escalar e Velocidade MédiaCLAUDIO REINKE0% (1)
- Plano de AulaDokument14 SeitenPlano de AulawiliamiaNoch keine Bewertungen
- TD Do Professor 5anomtDokument16 SeitenTD Do Professor 5anomtAneNoch keine Bewertungen
- Simulado SaepiDokument5 SeitenSimulado SaepiKayllon MartinsNoch keine Bewertungen
- Prova 2 - Química AmbientalDokument3 SeitenProva 2 - Química AmbientalMárcio Alécio Maia100% (1)
- Texto EmbaralhadoDokument1 SeiteTexto EmbaralhadoMarlucia SantanaNoch keine Bewertungen
- Simulado 2 (Port. 9º Ano - Blog Do Prof. Warles)Dokument4 SeitenSimulado 2 (Port. 9º Ano - Blog Do Prof. Warles)Homer HomerNoch keine Bewertungen
- 1º Ano AtividadesDokument2 Seiten1º Ano AtividadesTerceirão Raulina100% (2)
- Plano Aula Ensino Medio 1Dokument18 SeitenPlano Aula Ensino Medio 1Marcia Xavier MaiaNoch keine Bewertungen
- Tríduo Bom Jesus 2018Dokument6 SeitenTríduo Bom Jesus 2018Elisângela Pereira da SilvaNoch keine Bewertungen
- A 42 V 663 BDokument1 SeiteA 42 V 663 Bagostinoburla4446Noch keine Bewertungen
- Anpad InglesDokument1 SeiteAnpad InglesCíntia GhettiNoch keine Bewertungen
- Apost3 QmovDokument5 SeitenApost3 QmovCíntia GhettiNoch keine Bewertungen
- Centro Massa 10 Questoes Com GabaritoDokument2 SeitenCentro Massa 10 Questoes Com GabaritoCíntia GhettiNoch keine Bewertungen
- VectocardiografíaDokument7 SeitenVectocardiografíaJose Rodrigues JuniorNoch keine Bewertungen
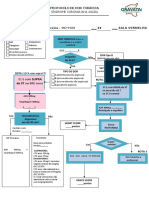
- Protocolo de Dor TorácicaDokument2 SeitenProtocolo de Dor Torácicamedicos.upamoradasNoch keine Bewertungen
- Decreto #9785 de 7 de Maio de 2019Dokument27 SeitenDecreto #9785 de 7 de Maio de 2019nelson during100% (3)
- 17 - Batalha EspiritualDokument211 Seiten17 - Batalha EspiritualGabriel Cachoeira100% (2)
- Anexo VI - Datasheet Módulo Jinko JKM530M-72HL4-TVDokument1 SeiteAnexo VI - Datasheet Módulo Jinko JKM530M-72HL4-TVfernandoNoch keine Bewertungen
- Leia A Parlenda E Depois Responda À Questão: Com Qual Palavra Rima VeludoDokument10 SeitenLeia A Parlenda E Depois Responda À Questão: Com Qual Palavra Rima VeludoWellington SantanaNoch keine Bewertungen
- Manual de ProjetosDokument226 SeitenManual de ProjetosbetobragajrNoch keine Bewertungen
- Gestão Da Conservação-Restauração Do Patrimônio Cultural Algumas Reflexões Sobre Teoria e PráticaDokument10 SeitenGestão Da Conservação-Restauração Do Patrimônio Cultural Algumas Reflexões Sobre Teoria e PráticaDébora LimaNoch keine Bewertungen
- Niquel, Titanio, Zirconio e Suas LigasDokument6 SeitenNiquel, Titanio, Zirconio e Suas LigasRuiter SantosNoch keine Bewertungen
- Mapa Mental Tecido MuscularDokument1 SeiteMapa Mental Tecido MuscularandressalopesmmNoch keine Bewertungen
- S - VelocidadesDokument5 SeitenS - Velocidadesjoao piter de paulaNoch keine Bewertungen
- Fispq 0073 - Primer HalogenanteDokument5 SeitenFispq 0073 - Primer HalogenanteAugusto VieceliNoch keine Bewertungen
- Educacao Infantil Como Organizar o Espaco Escolar Com Intencionalidade PedagogicaDokument6 SeitenEducacao Infantil Como Organizar o Espaco Escolar Com Intencionalidade PedagogicaIsa OliveiraNoch keine Bewertungen
- Lista de Exercícios - 22 - 10 - 22 UNIVERSALDokument2 SeitenLista de Exercícios - 22 - 10 - 22 UNIVERSALgiselle_azevedo29Noch keine Bewertungen
- Iguatu CeDokument12 SeitenIguatu CeGABRIELNoch keine Bewertungen
- Aprendizagem - Teorias e ProcessosDokument107 SeitenAprendizagem - Teorias e ProcessosNeuropsico pedagogiaNoch keine Bewertungen
- Alta Floresta Integrado Final MapaDokument177 SeitenAlta Floresta Integrado Final MapaGg GNoch keine Bewertungen
- Atividades CognitivasDokument76 SeitenAtividades CognitivasSimone Machado De OliveiraNoch keine Bewertungen
- As Idéias de EinsteinDokument142 SeitenAs Idéias de EinsteinFelipe00960% (1)
- Guião - ENPL 2014Dokument1 SeiteGuião - ENPL 2014daniel95sousaNoch keine Bewertungen
- Tese Roberto Final 16 01 2015 19Dokument148 SeitenTese Roberto Final 16 01 2015 19Jônatas EduardoNoch keine Bewertungen
- Alexandre Ordem Paranormal Wiki FandomDokument2 SeitenAlexandre Ordem Paranormal Wiki FandomIevan polkaNoch keine Bewertungen
- Planner Viver Leve 2Dokument9 SeitenPlanner Viver Leve 2Jaqueline BelezaNoch keine Bewertungen
- Cartilha Agroflorestal PDFDokument92 SeitenCartilha Agroflorestal PDFEliene OliveiraNoch keine Bewertungen
- Cap. 04 - Geometria, Ideias Intuitivas.Dokument3 SeitenCap. 04 - Geometria, Ideias Intuitivas.Douglas OliveiraNoch keine Bewertungen
- Esqueleto-Apendicular Com Imagens para FixaçaoDokument23 SeitenEsqueleto-Apendicular Com Imagens para FixaçaoRosangela FonsecaNoch keine Bewertungen
- Resumos Psicologia 1Dokument8 SeitenResumos Psicologia 1Francisca AlmeidaNoch keine Bewertungen
- 2 - Inglês Técnico 1aDokument33 Seiten2 - Inglês Técnico 1aOrlando Schetino ValenteNoch keine Bewertungen
- I CZC - Livro Do Evento - 2016-With-Cover-Page-V2Dokument232 SeitenI CZC - Livro Do Evento - 2016-With-Cover-Page-V2Joao FelipeNoch keine Bewertungen