Beruflich Dokumente
Kultur Dokumente
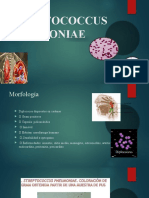
Streptococcus Pneumoniae
Hochgeladen von
Abel YPOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Streptococcus Pneumoniae
Hochgeladen von
Abel YPCopyright:
Verfügbare Formate
Streptococcus pneumoniae
Microbiología
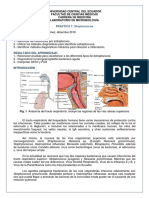
Fisiología y estructura. S. pneumoniae es una cocácea Gram positiva, capsulada.
Las células bacterianas tienen una forma lanceolada, miden 0,5 a 1,2 m de
diámetro y se disponen en pares o diplos. Son anaerobias facultativas. Para su
crecimiento y multiplicación tiene requerimientos específicos, como aportes de
proteínas y suplementos hematológicos, por lo que es considerada una bacteria
fastidiosa.
Condiciones para el crecimiento en medios de cultivo. Los medios artificiales que
aportan los nutrientes necesarios para el crecimiento de S. pneumoniae son medios
enriquecidos como agar soya tripticasa o agar infusión cerebro/corazón con adición
de 10% de sangre de cordero (entera o calentada lo que constituye el agar
chocolate). Carece de la enzima catalasa, la cual debe ser aportada en forma
exógena; en la práctica es proporcionada por la sangre. El crecimiento y desarrollo
bacteriano se ve facilitado en un ambiente con 8 a 10% de CO 2. En los medios de
cultivo antes señalados este patógeno crece formando colonias redondas, mucosas
y no pigmentadas, de 1 a 3 mm de diámetro, las cuales al cabo de 48 horas
presentan un aspecto umbilicado, con una depresión central producida por una
autolisis celular progresiva. En estos medios con sangre las colonias producen una a
hemólisis, es decir digestión parcial de la hemoglobina y la colonia se rodea de un
halo verdoso.
S. pneumoniae es sensible a la optoquina y en presencia de bilis o sales biliares se
produce una destrucción o lisis bacteriana; estas características fenotípicas son la
base para la identificación de especie. La susceptibilidad a optoquina se debe
determinar sembrando un inóculo denso en placa de agar sangre de cordero y
colocando en la superficie un disco impregnado con 5 mg de optoquina; si después
de 18 horas de incubación de la cepa a 37º C se observa un halo de inhibición del
crecimiento (dependiendo del disco comercial) > a 14 mm si es BBL o >16 mm si
es Oxoid, y además se solubiliza en presencia de sales biliares a una concentración
de 10%, esta cepa se define como S. pneumoniae.
Cápsula. Entre las estructuras interesantes de esta bacteria hay que mencionar
una cápsula externa a la pared celular, de naturaleza polisacárida compleja. Es la
piedra angular de la patogénesis de las infecciones neumocóccicas. La composición
antigénica de la cápsula es variable en diferentes cepas y permite agrupar a
losS. pneumoniae en más de 90 diferentes serotipos capsulares y
aproximadamente 45 serogrupos. Se definen como pertenecientes a un mismo
serogrupo, los serotipos que presentan inmunogenicidad cruzada, por ej. 6A y 6B.
La identificación de cada serotipo se realiza mediante una reacción antígeno-
anticuerpo utilizando antisueros específicos, lo que da como resultado una
hinchazón de la cápsula, fenómeno conocido como "quellung", término que en
alemán significa hinchazón. También se utilizan hoy en día otras técnicas para la
serotipificación, como aglutinación con látex o amplificación génica mediante RPC.
Todas estas técnicas de tipificación están disponibles sólo en laboratorios de
referencia.
La complejidad antigénica capsular de S. pneumoniae explica en parte la elevada
incidencia y severidad de las infecciones por este agente. La inmunidad es serotipo
específica, lo que significa que teóricamente un sujeto puede tener cerca de 90
infecciones neumocóccicas durante su vida. Esto podría ser verdad si la virulencia
de cada serotipo fuera similar y la inmunidad fuera de larga duración y homogénea
para todos los serotipos, pero en la realidad la calidad y duración de la inmunidad
depende del serotipo, de la edad del paciente y de otros parámetros aún no bien
definidos.
Si bien se han descrito 90 serotipos diferentes de S. pneumoniae, la experiencia
clínica mundial acumulada muestra que son pocos los serotipos con mayor impacto
clínico y es así como 12 serotipos: 1 - 3 - 4 - 5 - 6 - 7 - 8 - 9 - 14 - 18 - 19 y 23,
son responsables del 80% o más de las infecciones neumocóccicas invasoras. La
distribución geográfica y por grupo etario de estos serotipos también tiene
variaciones; se ha observado que los serotipos 1 y 5 son más frecuentes en
regiones del mundo de menor desarrollo socioeconómico.
La regulación genética de esta cápsula es también compleja y es así que algunas
cepas pueden experimentar una transformación o cambio de serotipo. Este
fenómeno publicado por Coffey en 1991, no había sido detectado previamente y, si
bien su frecuencia es baja, se presenta en cepas con resistencia a los
antimicrobianos y asociadas a colonización e infecciones en niños. Estos cambios de
serotipo en una cepa ocurren por mecanismo de recombinación genética en que se
modifica y reemplaza el locus (parte del genoma) que codifica para la expresión de
la cápsula. Uno de estos ejemplos es el serotipo 19F que surgió como variante de
un clon serotipo 23F multiresistente detectado en España y el cual se ha
diseminado a diferentes países. El análisis molecular de estas cepas mediante
diferentes técnicas de tipificación muestra una total identidad genética entre ellas,
diferenciándose sólo en el serotipo capsular. Como estas variantes han surgido en
las cepas resistentes a antimicrobianos, ya sea a penicilina o multiresistentes, se
podría plantear hipotéticamente que mutaciones o reordenamientos genéticos que
llevan a resistencia antimicrobiana se asocian a otras recombinaciones genéticas
resultando en cepas mejor adaptadas para persistir en el tiempo. Esto nos lleva a
otra reflexión obligada..., como estas variantes son cepas resistentes a los
antibióticos, la presión y selección de los antimicrobianos puede influir en forma
importante en un aumento potencial de su prevalencia y facilitar la diseminación de
estas variantes. Esto obliga a la vigilancia de este fenómeno y al uso racional de
antimicrobianos.
La capacidad de recombinación genética que posee S. pneumoniae se había puesto
en evidencia desde hace mucho tiempo. Ya en 1944 los investigadores Avery,
MacLeod y McCarty observaron un fenómeno muy peculiar en S. pneumoniae:
cepas acapsuladas, no virulentas, también denominadas R pueden transformarse
en cepas capsuladas o S, virulentas, en contacto con cepas S en un modelo in
vitro o también in vivo inoculándolas en ratón; esto ocurre por incorporación activa
de material genético desde el ambiente al genoma bacteriano y también por
mutaciones retrógadas espontáneas. Esta transformación genética está presente en
muy pocos microorganismos.
Pared bacteriana. La pared celular de S. pneumoniae tiene la estructura general
de las cocáceas Gram positivas, con una capa importante de peptidoglicano
constituida por subunidades alternadas de N-acetilglucosamina y ácido N-acetil
murámico enlazadas por puentes peptídicos (Figura 1). Un componente importante
de esta pared es el ácido teicoico, rico en galactosamina, fosfato y en colina; esta
última sustancia es exclusiva de esta bacteria y cumple una función reguladora
importante en la hidrólisis de la pared. El ácido teicoico se dispone de dos formas
en la pared celular, una expuesta en la superficie celular, (conocido como sustancia
C) y otra forma unida en forma covalente a los lípidos de la membrana
citoplasmática (Figura 1). En esta pared también están presentes la proteína R,
especie específica y la proteína M tipo específica. Ninguna de estas proteínas tiene
un papel en la virulencia.
Das könnte Ihnen auch gefallen
- Casos Clinicos VANEDokument14 SeitenCasos Clinicos VANEKevinSalinas0% (1)
- Conceptos Microbiológicos de S. PneumoniaeDokument5 SeitenConceptos Microbiológicos de S. PneumoniaeEdgar OrtizNoch keine Bewertungen
- Estrepto Neumonia BsesDokument4 SeitenEstrepto Neumonia BsesBarbara Seminario RamirezNoch keine Bewertungen
- Streptococcus AgalactiaeDokument5 SeitenStreptococcus AgalactiaeWagner CastilloNoch keine Bewertungen
- Histoplasma CapsulatumDokument12 SeitenHistoplasma CapsulatumCésar Hugo AparicioNoch keine Bewertungen
- Streptococcus PneumoniaeDokument7 SeitenStreptococcus Pneumoniaelila margarita villa cervantesNoch keine Bewertungen
- Info Staphylococcus AureusDokument8 SeitenInfo Staphylococcus Aureusdeceano2015Noch keine Bewertungen
- Info Flashcards 2Dokument12 SeitenInfo Flashcards 2Jaime De la CruzNoch keine Bewertungen
- CUESTIONARIO-IDENTIFICACION DE COCOS GRAM + ResueltoDokument29 SeitenCUESTIONARIO-IDENTIFICACION DE COCOS GRAM + ResueltoJaghnna Cristhel Cruz CastellonNoch keine Bewertungen
- El Estreptococo PneumoniaeDokument8 SeitenEl Estreptococo PneumoniaeEdgar Uriel BallinasNoch keine Bewertungen
- Capitulo 19 y 22Dokument7 SeitenCapitulo 19 y 22Ingrid PootNoch keine Bewertungen
- Caso Clinico de Infeccion Por Coco Gram PositivoDokument2 SeitenCaso Clinico de Infeccion Por Coco Gram PositivoJesusAcostaNoch keine Bewertungen
- P NeumococoDokument9 SeitenP NeumococoAngel Jose Vargas VarelaNoch keine Bewertungen
- Haemophilus Influenzae.Dokument9 SeitenHaemophilus Influenzae.DANNA STEPHANNY SOUZA PLASCENCIANoch keine Bewertungen
- Practica # 7 EstreptococoDokument8 SeitenPractica # 7 EstreptococoEddie RobNoch keine Bewertungen
- Tarea Integradora AntraxDokument8 SeitenTarea Integradora AntraxMiguel De la torreNoch keine Bewertungen
- Presentacion Proyecto de Epidemiologia y Salud Ilustrativo VerdeDokument44 SeitenPresentacion Proyecto de Epidemiologia y Salud Ilustrativo VerdeAlondra Guadalupe Chuc PinzonNoch keine Bewertungen
- Chlamydia y Bacilos Gram Negativos Informe Final FinalDokument19 SeitenChlamydia y Bacilos Gram Negativos Informe Final FinalBASTI�N FRANCISCO CAMPOS VARGASNoch keine Bewertungen
- Expo Chlamydophila PneumoniaeDokument5 SeitenExpo Chlamydophila PneumoniaeMarcela Ivette Fernández VelázquezNoch keine Bewertungen
- Microbiología y Patogenia de Streptococcus Pneumoniae - UpToDateDokument15 SeitenMicrobiología y Patogenia de Streptococcus Pneumoniae - UpToDateAstridKarolinaQuezadaQuezada100% (1)
- Angiomatosis BacilarDokument2 SeitenAngiomatosis BacilarJuan SolísNoch keine Bewertungen
- Cap 18 - Bacterias - STREPTOCOCCUS Y ENTEROCOCCUSDokument10 SeitenCap 18 - Bacterias - STREPTOCOCCUS Y ENTEROCOCCUSapi-3697245100% (1)
- Cap 20 - Bacterias - Neisserias, Haemophilus, Bordetella y BrucellaDokument17 SeitenCap 20 - Bacterias - Neisserias, Haemophilus, Bordetella y Brucellaapi-369724567% (3)
- EstafilococosDokument36 SeitenEstafilococosMax A. Carrillo Flores88% (8)
- Staphylococcus Aureus - Bacteria Patogena PDFDokument7 SeitenStaphylococcus Aureus - Bacteria Patogena PDFCarlos Sierra LandinNoch keine Bewertungen
- S AureusDokument7 SeitenS AureusMarcela JataNoch keine Bewertungen
- Estafilococo 2020Dokument34 SeitenEstafilococo 2020Chavez DaynaNoch keine Bewertungen
- Staphylococcus AureusDokument9 SeitenStaphylococcus AureusAlberto TorresNoch keine Bewertungen
- Factor Virulencia Staphylococcus AureusDokument5 SeitenFactor Virulencia Staphylococcus AureusValeria Rodriguez ValdiviaNoch keine Bewertungen
- Streptococcus PyogenesDokument8 SeitenStreptococcus PyogenesGonzalo Ferreiros MiguelNoch keine Bewertungen
- Resúmen BacteriasDokument87 SeitenResúmen BacteriasNEDRA JOANA PEREZ GARCIANoch keine Bewertungen
- Diagnóstico Microbiológico en La Detección e Identificación de StaphylococcusDokument7 SeitenDiagnóstico Microbiológico en La Detección e Identificación de StaphylococcusMaria Jose Rodriguez GaonaNoch keine Bewertungen
- M PneumoniaeDokument2 SeitenM PneumoniaePaulina SoberanesNoch keine Bewertungen
- Bacterias Gram Positivas.Dokument29 SeitenBacterias Gram Positivas.karen sofia sierra camposNoch keine Bewertungen
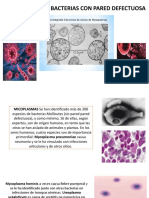
- Micoplasma y Bacterias Con Pared Defectuosa.Dokument27 SeitenMicoplasma y Bacterias Con Pared Defectuosa.Yaritza Pinargt0% (1)
- Strep To CocusDokument16 SeitenStrep To CocusElsaNoch keine Bewertungen
- GENERALIDADESDokument4 SeitenGENERALIDADESLina Marcela Quintero VargasNoch keine Bewertungen
- Microcap 50Dokument5 SeitenMicrocap 50Hellen MendezNoch keine Bewertungen
- Investigación BacteriologíaDokument16 SeitenInvestigación BacteriologíaCarmen ReyesNoch keine Bewertungen
- StreptococcusDokument9 SeitenStreptococcusMonserratNoch keine Bewertungen
- Microbiología EstafilococosDokument9 SeitenMicrobiología EstafilococosMarcoNoch keine Bewertungen
- Generalidades NeumococosDokument3 SeitenGeneralidades NeumococosJazmin Marte BaezNoch keine Bewertungen
- Laboratorio #3Dokument6 SeitenLaboratorio #3Maria Jose Feris CastellonNoch keine Bewertungen
- Tarea 1 - Microbiología - Camila AguileraDokument5 SeitenTarea 1 - Microbiología - Camila Aguileracamila aguilera garzonNoch keine Bewertungen
- StreptococcusDokument20 SeitenStreptococcusSoy SamNoch keine Bewertungen
- Practica 7Dokument9 SeitenPractica 7Janeth YépezNoch keine Bewertungen
- S PneumoniaeDokument14 SeitenS PneumoniaeTANIA VIRACA CATALANNoch keine Bewertungen
- Inmunidad-Humoral Naegleria FowleriDokument2 SeitenInmunidad-Humoral Naegleria Fowlerisaul enriquezNoch keine Bewertungen
- EnterobacteriasDokument14 SeitenEnterobacteriasPamela Ramos ParedesNoch keine Bewertungen
- Neisseria GonorrhoeaeDokument7 SeitenNeisseria GonorrhoeaeFidel QuiñonezNoch keine Bewertungen
- Acfrogcqdjc7rbitozk2nyk0blqctbkunb Ln7n4moqzaz1nztuj0oke3wf6qatyjvy1b4duxoi6u7pcdv8lvk Q7z7k93mmxgyo13me 3y Clgckxclmcgiwinrm533jyjxhafycydrlgcakvceDokument19 SeitenAcfrogcqdjc7rbitozk2nyk0blqctbkunb Ln7n4moqzaz1nztuj0oke3wf6qatyjvy1b4duxoi6u7pcdv8lvk Q7z7k93mmxgyo13me 3y Clgckxclmcgiwinrm533jyjxhafycydrlgcakvcejuanNoch keine Bewertungen
- Curva de Crecimiento Bacteria NoDokument15 SeitenCurva de Crecimiento Bacteria NoPepe Joshi SanNoch keine Bewertungen
- Microbiologia by Slidesgo 2 Microbiologia TopicosDokument21 SeitenMicrobiologia by Slidesgo 2 Microbiologia TopicosJavi AnainNoch keine Bewertungen
- Taller CocosDokument4 SeitenTaller CocosIngri Natalia Muñoz PachajoaNoch keine Bewertungen
- Características Neisseria GonorrhoeaeDokument5 SeitenCaracterísticas Neisseria GonorrhoeaePaula BatistaNoch keine Bewertungen
- Micoplasma Gallisepticum PDFDokument33 SeitenMicoplasma Gallisepticum PDFAlejandro BoteroNoch keine Bewertungen
- Cap 17 - Bacterias - ESTAFILOCOCOSDokument12 SeitenCap 17 - Bacterias - ESTAFILOCOCOSapi-3697245100% (7)
- Cocos Gram Positivos - : Streptococcus y EnterococcusDokument67 SeitenCocos Gram Positivos - : Streptococcus y EnterococcusMakarena RiquelmeNoch keine Bewertungen
- Transferencia de inmunidad en el binomio madre-cría: Estudio comparativo entre especiesVon EverandTransferencia de inmunidad en el binomio madre-cría: Estudio comparativo entre especiesNoch keine Bewertungen
- Uso de Derivados del Cannabis en Pacientes con CáncerVon EverandUso de Derivados del Cannabis en Pacientes con CáncerNoch keine Bewertungen
- Degradacion de PlaguicidasDokument8 SeitenDegradacion de PlaguicidasAbel YPNoch keine Bewertungen
- ParacoccidioidomicosisDokument1 SeiteParacoccidioidomicosisAbel YPNoch keine Bewertungen
- VibrioDokument1 SeiteVibrioAbel YPNoch keine Bewertungen
- BrucellaDokument2 SeitenBrucellaAbel YPNoch keine Bewertungen
- Informe de Demanda Bioquimica de Oxigeno DboDokument3 SeitenInforme de Demanda Bioquimica de Oxigeno DboAbel YPNoch keine Bewertungen
- Capnocytophaga y DysgonomonasDokument1 SeiteCapnocytophaga y DysgonomonasAbel YPNoch keine Bewertungen
- AmazonasDokument1 SeiteAmazonasAbel YPNoch keine Bewertungen
- INVESTIGACIÓNDokument2 SeitenINVESTIGACIÓNAbel YPNoch keine Bewertungen
- PicornavirusDokument2 SeitenPicornavirusAbel YPNoch keine Bewertungen
- Plasm OdiumDokument1 SeitePlasm OdiumAbel YPNoch keine Bewertungen
- MICELIOSDokument1 SeiteMICELIOSAbel YPNoch keine Bewertungen
- Ozono Tera PiaDokument1 SeiteOzono Tera PiaAbel YPNoch keine Bewertungen
- SarnaDokument1 SeiteSarnaAbel YPNoch keine Bewertungen
- Parásitos IntestinalesDokument1 SeiteParásitos IntestinalesAbel YPNoch keine Bewertungen
- Inmunidad AdquiridaDokument1 SeiteInmunidad AdquiridaAbel YPNoch keine Bewertungen
- Día Internacional de Las MontañasDokument2 SeitenDía Internacional de Las MontañasAbel YPNoch keine Bewertungen
- Estudios de AlimentosDokument1 SeiteEstudios de AlimentosAbel YPNoch keine Bewertungen
- Transfusion de SangreDokument1 SeiteTransfusion de SangreAbel YPNoch keine Bewertungen
- MicrobiosDokument1 SeiteMicrobiosAbel YPNoch keine Bewertungen
- HelmintosDokument1 SeiteHelmintosAbel YPNoch keine Bewertungen
- Celulas ViablesDokument1 SeiteCelulas ViablesAbel YPNoch keine Bewertungen
- Inocuidad AlimentariaDokument1 SeiteInocuidad AlimentariaAbel YPNoch keine Bewertungen
- Tiposdehipotesis Asi Como FuncionesDokument3 SeitenTiposdehipotesis Asi Como FuncionesmayaresNoch keine Bewertungen
- Instrucción 1Dokument1 SeiteInstrucción 1Abel YPNoch keine Bewertungen
- Inmunidad InnataDokument1 SeiteInmunidad InnataAbel YPNoch keine Bewertungen
- Brucelosis BovinaDokument2 SeitenBrucelosis BovinaAbel YPNoch keine Bewertungen
- Teoria de La RelatividadDokument1 SeiteTeoria de La RelatividadAbel YPNoch keine Bewertungen
- Vacuna NeumococoDokument3 SeitenVacuna NeumococoAbel YPNoch keine Bewertungen
- Brucelosis BovinaDokument2 SeitenBrucelosis BovinaAbel YPNoch keine Bewertungen
- NEUMOCOCODokument3 SeitenNEUMOCOCOAbel YPNoch keine Bewertungen
- Etiqueta AumentarDokument1 SeiteEtiqueta AumentarJaime CedeñoNoch keine Bewertungen
- 8 SEMANA Bio PreguntasDokument3 Seiten8 SEMANA Bio PreguntasCasaverde JimmyNoch keine Bewertungen
- Modelo Presentacion Proyecto de Investigacion CienciActivaDokument5 SeitenModelo Presentacion Proyecto de Investigacion CienciActivaDavid UrrutiaNoch keine Bewertungen
- Aplicaciones de La AgrobiotecnologíaDokument5 SeitenAplicaciones de La AgrobiotecnologíaJacson UlateNoch keine Bewertungen
- Gene PoolDokument4 SeitenGene PoolHeidiCoyVelásquezNoch keine Bewertungen
- Sistema Ecológico CerradoDokument1 SeiteSistema Ecológico CerradomaycolNoch keine Bewertungen
- UnellezDokument7 SeitenUnellezTeatro UniversitarioNoch keine Bewertungen
- Informe de AnatomiaDokument5 SeitenInforme de AnatomiaAngel quispe mamaniNoch keine Bewertungen
- Dilución SeriadaDokument5 SeitenDilución SeriadaMaria VivancoNoch keine Bewertungen
- Los Cinco ReinosDokument12 SeitenLos Cinco ReinossteicyNoch keine Bewertungen
- Experimento de Extraccion de ADNDokument7 SeitenExperimento de Extraccion de ADNBryanCoello100% (1)
- Reproducción en PlantasDokument7 SeitenReproducción en PlantasValeria Arevalo MoralesNoch keine Bewertungen
- Tarea - Sexaje de Pollitos de 1 Dia - Grupo 4aDokument2 SeitenTarea - Sexaje de Pollitos de 1 Dia - Grupo 4aSEBASTIAN ALONSO ORTIZ MATTANoch keine Bewertungen
- Manejo de SemillasDokument487 SeitenManejo de SemillasSantiago RuauNoch keine Bewertungen
- Plantas PDFDokument11 SeitenPlantas PDFASHLEE CAMPOS VALENCIANoch keine Bewertungen
- EJERCICIO COMPARACION Diego CocaDokument2 SeitenEJERCICIO COMPARACION Diego CocaDiego CocaNoch keine Bewertungen
- Reino ProtistaDokument7 SeitenReino ProtistaAngel Rodriguez moncayoNoch keine Bewertungen
- Control de PlagasDokument4 SeitenControl de PlagasGuillermoCorreaNoch keine Bewertungen
- Fotos WikiDokument4 SeitenFotos WikiNervo SánchezNoch keine Bewertungen
- Prac 1Dokument7 SeitenPrac 1NickyXltamiranoBegazoNoch keine Bewertungen
- Tipos de MamiferosDokument2 SeitenTipos de MamiferosDenisse VargasNoch keine Bewertungen
- Resumen Divison, Mutación y RecombinaciónDokument9 SeitenResumen Divison, Mutación y RecombinaciónNicole BautistaNoch keine Bewertungen
- Animales ArquitectosDokument16 SeitenAnimales ArquitectosBol Dig0% (1)
- Mejoramiento Genético en Plantas y en Animales DomésticosDokument11 SeitenMejoramiento Genético en Plantas y en Animales DomésticosAna MezaNoch keine Bewertungen
- La Selva PeruanaDokument7 SeitenLa Selva PeruanaDanny Espinoza Cumpa100% (2)
- Problemas Lógicos en La EvoluciónDokument6 SeitenProblemas Lógicos en La EvoluciónArmy Rob Lee, S. L.Noch keine Bewertungen
- Almácigos de CaféDokument4 SeitenAlmácigos de CaféInter BalthaNoch keine Bewertungen
- Regulación de La Expresión GenéticaDokument13 SeitenRegulación de La Expresión GenéticaMaríaNoch keine Bewertungen
- Sintesis de RnaDokument10 SeitenSintesis de Rnayeson David urbanoNoch keine Bewertungen
- HONGOSDokument8 SeitenHONGOSabelitoNoch keine Bewertungen