Beruflich Dokumente
Kultur Dokumente
Cumarinas
Hochgeladen von
Linda Mussa VargasOriginalbeschreibung:
Originaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Cumarinas
Hochgeladen von
Linda Mussa VargasCopyright:
Verfügbare Formate
Instituto Politécnico Nacional Revisar la importancia biológica de las
Escuela Nacional de Ciencias cumarinas
Biológicas
Químico Farmacéutico Industrial Parte experimental
Laboratorio de química heterocíclica Se pesaron 3.3 g de resorsinol y se mezclaron con
3.8 mL de acetoacetato de etilo. Posteriormente,
se adicionó lentamente 16 mL de HCl concentrado
Práctica 7: Síntesis de 7-Hidroxi-4- y se filtró la mezcla a un matraz balón.
metilcumarina El matraz balón se adaptó a un sistema de reflujo
empleando un baño de agua para su
calentamiento durante 15 minutos. Se comprobó
Introducción que la temperatura del calentamiento no superara
Las cumarinas compuestos heterociclos los 60°C. Finalmente, la mezcla se vertió en 100 mL
conformados por una Benzo-α-pironas, las cuales de agua/hielo para cristalizar.
se presentan en grandes cantidades de diversos Se filtró, purificó y recristalizó el producto
productos naturales como en hongos, bacterias, empleando carbón activado y agua para dichos
semillas, flores y frutos. Presenta propiedades procesos.
clínicas (anticoagulantes, sedante, entre otros.)1 Al obtener el producto, se realizó una
cromatografía de capa fina y se determinó pf.
Antecedentes Mecanismo de reacción
La cumarina se presenta en diversos productos
naturales, sin embargo prevalece prioritariamente
en uno de ellos, la umbeliferona derivada del haba
de Tonka. Se conoce a la umbeliferona como la
primera síntesis de cumarina debido a que parte
del ácido cumárico y genera una lactonización
(ciclación).2-3
Posteriormente, se han creado nuevos métodos
para sintetizar cumarina por ejemplo:
Condensación de Knoevenagel (Aldehído activado
y éster); reacción de Ponndorf (fenol y ácido
fumárico); reacción de Houben-Hoesch
(trimetilsilicetena); condensación de Perkin
(hidroxibenzofenonas y anhídrido acético) y la
reacción de Peachmann, la cual es la más
empleada debido al elevado rendimiento y
facilidad en la reacción de fenoles con β- Resultados
cetoésteres.4 Se obtuvo 3.8 g de un producto sólido color blanco de 7-
Hidroxi-4-metilcumarina correspondiente al 65.44% de
Objetivos rendimiento. Y un punto de fusión de
General Cromatografía en capa fina eluida en
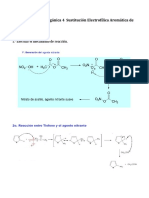
Efectuar la sustitución electrofilica (AcOEt/Hexano, 1:2)
aromática (SEAr) entre un electrófilo
poco activado (compuesto 1,3- 1.6
𝑅𝑓 = = 0.40 (𝑃𝑟𝑜𝑑𝑢𝑐𝑡𝑜)
dicarbonílico) con un nucleófilo activado, 4
benceno-1,3-diol (resorcinol)
Particular 1.9
𝑅𝑓 = = 0.47 (𝑟𝑒𝑓𝑒𝑟𝑒𝑛𝑐𝑖𝑎)
Ilustrar la formación de un heterociclo de 4
seis miembros benzofusionado
Figura 1. Cromatografía capa fina (AcOEt/Hexano
1:3), (M) Materia Prima Resorcinol, (P) Producto 7- Dado que para el carbono 2 existe un
Hidroxi-4-metilcumarina impedimento de tipo estérico contra la molécula
de 3-oxobutanoato de etilo mientras que en los
Discusión de resultados carbonos 4 y 6 no existe impedimento de ningún
Se realizó la formación la síntesis de 7-hidroxi-4- tipo.
metilcumarina o β-metilumbeliferona al calentar
resorcinol (que es un fenol) formando un éster 2. ¿Por qué es favorecida la formación
cumarínico como intermediario para la reacción. intramolecular del éster para obtener la lactona de
Se obtuvo un producto sólido blanco con un punto la cumarina?
de fusión de 185°C cercano a la literatura que nos
Por la reacción de transesterificación que se lleva
indica un punto de fusión entre 194° y 195°CSe
a cabo entre el alcohol del resorcinol y el grupo
identificó el producto por medio de una
alcóxido del 3-oxobutanoato, más el catalizador
cromatografía en capa fina como lo muestra la
(medio ácido).
Figura 1, se puede distinguir mediante el Rf
calculado, que el producto comparado con la
materia prima (Resorsinol) es menos polar, esto
indica que existen aún existen impurezas en el
producto, ya que el () debería ser ligeramente más
polar que la referencia por lo que se podría
cambiar el sistema de emisión para Finalmente se
obtuvo un rendimiento del: 65.44% comparado La transesterificación es una reacción donde los
con el reportado del 85%, confirma que se esteres reaccionan con los alcoholes sin necesidad
encuentran presentes ciertas impurezas. de formar ácido carboxílico, formando nuevos
esteres, se ve favorecida por condiciones acidas o
Conclusiones
básicas y una apropiada concentración de alcohol.
-Se llevo a cabo la formación de un anillo
benzofusionado de 6 miembros con un 3. ¿Por qué la mezcla de 3-oxobutanoato de etilo
heteroátomo , partiendo de compuestos aciclícos. y resorcinol debe ser reciente?
-Se obtuvo un % R= 65.44% para el compuesto 7-
Mientras que el acetoacetato tiene un punto bajo
hidroxi-4-metilcumarina y un Pf de 185°C
(-45°C) de fusión y se evapora fácilmente, el
resorcinol es ligeramente reductor esto podría
Cuestionario
llevarlo a reaccionar con algunas sales presentes
1. ¿Cómo se explica la regia selectividad de la
en el agua o compuestos en el medio llevándolo a
formación de la 7-hidroxi-4-metil cumarina?
su descomposición como resorcinol y
Por las direcciones a las que favorecen los grupos transformándolo en una di cetona
funcionales alcohol el cual es un activantes fuerte
4. ¿Qué resultados esperaría en la síntesis
para las posiciones orto y para.
efectuada, si sustituyera el resorcinol por catecol
o por hidroquinona?
Cuando los alcoholes cambian de posición solo son
favorecidos por un alcohol, por tal aumenta el
tiempo de reacción y disminuye el rendimiento de
forma radical en algunos casos. Para catecol se
obtienen dos compuestos la 8-Hidroxi-
4metilcumarina y el Ácido (2E) -3- (3,4-
dihidroxifenil) but-2-enoico. Mientras que para la 8. ¿Cree usted que la síntesis de la 7-hidroxi-4-
Hidroquinona solo se obtiene la 6-Hidroxi-4- metilcumarina operaría también en medio básico?
metilcumarina, ya que todas sus posiciones son Explique por qué
equivalentes
No, bibliográficamente establece que la reacción
es únicamente favorecida con ácido, ya sea de
Bronsted o ácido de Lewis,
Bibliografía
1
Romero Márquez M; “Plantas aromáticas:
Tratado de aromaterapia científica”; 2004;
Primera edición; Editorial Kier; Buenos Aires,
Argentina; Pp: 81, 120-121.
2
Rejia Otero B; “Estudio estructural y dinámico de
sistemas organizados mediante sondas
fluorescentes”; 2007; Universidad Santiago de
Compostela; España; Pp: 40-41.
3
Claramunt Vallespí R. [𝑒𝑡 𝑎𝑙]; “Química
bioorgánica y productos naturales”; 2013;
Universidad Nacional de Educación a Distancia;
España: Pp: 204-205.
5. ¿Qué sustancias se eliminan en el lavado 4
Crecente Campos J; “Síntesis orgánica asistida
acuoso? por microondas. Obtención de enol carbamatos,
Se eliminará el acetoacetato de etilo, el resorcinol tetrahidroisoquinolinas, benzoazepinas,
que no reacciona, ácido clorhídrico y el etanol tiazolinas, sulfuros de fosfoles, isoflavonas,
formado durante la reacción. arilcumarinas, cumarinocumarinas y núcleos
dendrímeros. Aplicaciones”; 2010; Universidad
6. ¿Podría la cumarina formada reaccionar con Santiago de Compostela; España; Pp: 198-207.
otro equivalente de 3-oxobutanoato de etilo?
explique por qué.
Si podría reaccionar con otra molécula de
acetoacetato de etilo debido a que aún mantiene
un grupo OH sin reaccionar, aunque el tiempo de
reacción aumentaría pues la adición del otro
acetoacetato de etilo solo solo se vería favorecido
por un solo alcohol.
7. Escriba la estructura del producto que se
generaría si se emplearan 2 equivalentes de
3oxobutanoato de etilo y 1 equivalente de
resorcinol.
Das könnte Ihnen auch gefallen
- Reporte QuinoxalinaDokument3 SeitenReporte QuinoxalinaMonserrat Blanquel GarcíaNoch keine Bewertungen
- Pirrol PDFDokument3 SeitenPirrol PDFGustavo Adolfo Lopez Rodriguez0% (1)
- Pract 6 Hetero FinalDokument3 SeitenPract 6 Hetero FinalCecilia ValdiviaNoch keine Bewertungen
- P-7-Cuestionario SÍNTESIS DE 7-HIDROXI-4-METILCUMARINADokument3 SeitenP-7-Cuestionario SÍNTESIS DE 7-HIDROXI-4-METILCUMARINAKaren SalasNoch keine Bewertungen
- Formacion de IndolesDokument4 SeitenFormacion de IndolesMariana CervanteesNoch keine Bewertungen
- AlvaavlaavlaavlaavlaDokument2 SeitenAlvaavlaavlaavlaavlaMiguel SaavedraNoch keine Bewertungen
- NitrotiofenoDokument3 SeitenNitrotiofenoGaby RodriguezNoch keine Bewertungen
- Preperacion Del Sistema IndolDokument31 SeitenPreperacion Del Sistema IndolRosa Linda Soriano TorresNoch keine Bewertungen
- Practica 7Dokument5 SeitenPractica 7Xanat CortésNoch keine Bewertungen
- Previo Práctica 3 2-NitrotiofenoDokument25 SeitenPrevio Práctica 3 2-NitrotiofenoJonathan JacomeNoch keine Bewertungen
- 55 Difenilhidantoina 1.esDokument7 Seiten55 Difenilhidantoina 1.esStiven GranadosNoch keine Bewertungen
- Chuingnaiajsnjnm, AderDokument3 SeitenChuingnaiajsnjnm, AderMiguel SaavedraNoch keine Bewertungen
- Cuestionario OrganometalicaDokument2 SeitenCuestionario OrganometalicaOSMIN DURAN VILLEDANoch keine Bewertungen
- PRÁCTICA No. 4: OBTENCIÓN DE 5,5-DIFENILHIDANTOINADokument7 SeitenPRÁCTICA No. 4: OBTENCIÓN DE 5,5-DIFENILHIDANTOINADiana HMNoch keine Bewertungen
- Cuestionario-Practica 11Dokument3 SeitenCuestionario-Practica 11Jose Manuel Perez VargasNoch keine Bewertungen
- Previo 5 Q.O IIIDokument2 SeitenPrevio 5 Q.O IIIMichell Maximiliano Santillan HerrejonNoch keine Bewertungen
- Benzoxazoles Benzotiazoles Bencimidazoles 3FM1Dokument32 SeitenBenzoxazoles Benzotiazoles Bencimidazoles 3FM1Pamela Adkins50% (2)
- Qoiii Rep 01 MenadionaDokument2 SeitenQoiii Rep 01 MenadionaFrancisco QuirozNoch keine Bewertungen
- 2,4 Dietoxicarbonil 3,5 DimetilpirrolDokument10 Seiten2,4 Dietoxicarbonil 3,5 Dimetilpirrolgerardo Gaona montalva0% (2)
- Cuestionario BencimidazolDokument3 SeitenCuestionario BencimidazolAndresDuranNoch keine Bewertungen
- Reporte 3. TiofenoDokument4 SeitenReporte 3. TiofenoJosh Tapia MuciñoNoch keine Bewertungen
- Practica 4 Sintesis de 1-Fenil-3metilpirazol-5-OnaDokument2 SeitenPractica 4 Sintesis de 1-Fenil-3metilpirazol-5-OnaJackCrack1221Noch keine Bewertungen
- Previo 2 NitrotiofenoDokument4 SeitenPrevio 2 NitrotiofenoAngelicaBaezNoch keine Bewertungen
- Previo 6 Sintesis de Hantzsch para PiridinasDokument3 SeitenPrevio 6 Sintesis de Hantzsch para PiridinasJulio Cesar Venegas Muñoz50% (2)
- Práctica 8. Verde 1h-BencimidazolDokument25 SeitenPráctica 8. Verde 1h-BencimidazolAndresDuran0% (1)
- Previo BenciloDokument6 SeitenPrevio BenciloHeber Daniel Andrade Rivera100% (1)
- p1 Obtencion Del Epoxido de MenadionaDokument6 Seitenp1 Obtencion Del Epoxido de MenadionadanielNoch keine Bewertungen
- 2-Nitrotiofeno PrevioDokument5 Seiten2-Nitrotiofeno PrevioLyn Quinn Mim100% (1)
- Aldair 201 Q Qo4 Vi B Hidantoinas 1° Intento PDokument9 SeitenAldair 201 Q Qo4 Vi B Hidantoinas 1° Intento PAldair HernandezNoch keine Bewertungen
- Preparación de N-Óxido de 4-Nitro-2-PicolinaDokument15 SeitenPreparación de N-Óxido de 4-Nitro-2-PicolinaMónica MedinaNoch keine Bewertungen
- Antecedentes 2Dokument3 SeitenAntecedentes 2Julio Cesar FeruizNoch keine Bewertungen
- Analitica III Reporte 4 Ditizona LuisDokument9 SeitenAnalitica III Reporte 4 Ditizona LuisAngel HernandezNoch keine Bewertungen
- Síntesis de Pirazolona 1Dokument3 SeitenSíntesis de Pirazolona 1Mónica MedinaNoch keine Bewertungen
- 2 Nitro TiofenoDokument7 Seiten2 Nitro TiofenoAngel HernándezNoch keine Bewertungen
- Informe 3 Síntesis de BenzalanilinaDokument6 SeitenInforme 3 Síntesis de BenzalanilinaNatalia Aroz OrtizNoch keine Bewertungen
- Previo 2-NitrotiofenoDokument5 SeitenPrevio 2-NitrotiofenoEdgar Armando100% (5)
- Previo 3 Orgánica 4Dokument5 SeitenPrevio 3 Orgánica 4dany_289Noch keine Bewertungen
- P-11 - Cuestionario EXTRACCIÓN DE CAFEÍNA A PARTIR DE UNA FORMA FARMACEUTICADokument3 SeitenP-11 - Cuestionario EXTRACCIÓN DE CAFEÍNA A PARTIR DE UNA FORMA FARMACEUTICAKaren SalasNoch keine Bewertungen
- Be NC Imidazol 2Dokument2 SeitenBe NC Imidazol 2Adriana ArzateNoch keine Bewertungen
- Investigación Previa Obtención de Hidantoinas OrgánicaDokument8 SeitenInvestigación Previa Obtención de Hidantoinas OrgánicaDaniel Romano100% (1)
- Preparación de BencimidazolDokument2 SeitenPreparación de BencimidazolHéctor BalmoriNoch keine Bewertungen
- Obtención de FurfuralDokument1 SeiteObtención de FurfuralGabriel GMNoch keine Bewertungen
- Reporte FurfuralDokument9 SeitenReporte FurfuralMary FallNoch keine Bewertungen
- PirazolonasDokument7 SeitenPirazolonasFanny Venado HernandezNoch keine Bewertungen
- BenciloDokument3 SeitenBenciloLily LeroNoch keine Bewertungen
- Practica 6 ADokument6 SeitenPractica 6 AMiguel Angel LlunaNoch keine Bewertungen
- Practica 8Dokument6 SeitenPractica 8Rob HBNoch keine Bewertungen
- Pra 9. Sintesis de 23 DifenilquinoxalinaDokument4 SeitenPra 9. Sintesis de 23 DifenilquinoxalinaAldo TrejoNoch keine Bewertungen
- Obtención de FurfuralDokument7 SeitenObtención de FurfuralAndy Gaona Vera33% (3)
- Previo de Orgánica III Práctica 2Dokument4 SeitenPrevio de Orgánica III Práctica 2ChirinoNoch keine Bewertungen
- Sintesis de Acido BencilicoDokument14 SeitenSintesis de Acido BencilicoxPiixaaaNoch keine Bewertungen
- Reporte 5 PirazolonasDokument4 SeitenReporte 5 PirazolonasAnonymous enA4SSNoch keine Bewertungen
- Previo-2-Fenil-Indol Autor: Patricio A. M.Dokument7 SeitenPrevio-2-Fenil-Indol Autor: Patricio A. M.Patricio ArreolaNoch keine Bewertungen
- Practica 7 Cumarinas PDFDokument6 SeitenPractica 7 Cumarinas PDFGirard GarciaNoch keine Bewertungen
- AcetanilidaDokument9 SeitenAcetanilidaLizandro Galleguillos DiazNoch keine Bewertungen
- Reporte Practica 6Dokument3 SeitenReporte Practica 6dulceNoch keine Bewertungen
- CumarinalDokument4 SeitenCumarinalAndresDuranNoch keine Bewertungen
- Reporte 7 QOFH PDFDokument6 SeitenReporte 7 QOFH PDFJoselin CortesNoch keine Bewertungen
- PRACT6 HETEROFinalDokument3 SeitenPRACT6 HETEROFinalMonseNoch keine Bewertungen
- Práctica 8 CumarinasDokument3 SeitenPráctica 8 CumarinasDaniela IbarraNoch keine Bewertungen
- Inmunología AglutinaciónDokument17 SeitenInmunología AglutinaciónLinda Mussa Vargas100% (1)
- Adsorción de GibbsDokument7 SeitenAdsorción de GibbsLinda Mussa VargasNoch keine Bewertungen
- Arco ReflejoDokument4 SeitenArco ReflejoLinda Mussa Vargas100% (1)
- Aspirina Practica ReporteDokument2 SeitenAspirina Practica ReporteLinda Mussa VargasNoch keine Bewertungen
- Práctica N°8 Musculo EsqueleticoDokument13 SeitenPráctica N°8 Musculo EsqueleticoLinda Mussa VargasNoch keine Bewertungen
- Sesión de AprendizajeDokument2 SeitenSesión de Aprendizajeflavio sene senciaNoch keine Bewertungen
- Presentación-Diseño de EncofradosDokument40 SeitenPresentación-Diseño de EncofradosYenner Gamarra AsencioNoch keine Bewertungen
- Políticas de Seguridad en Las Redes de DatosDokument2 SeitenPolíticas de Seguridad en Las Redes de DatosC BozadaNoch keine Bewertungen
- Informe Amplificador Clase ADokument10 SeitenInforme Amplificador Clase ADaniel OsoNoch keine Bewertungen
- PA2 WillyDokument7 SeitenPA2 WillyWilly Choque GonzaNoch keine Bewertungen
- Cienaga AmbientalDokument21 SeitenCienaga AmbientalBaltasar Herrera RoviraNoch keine Bewertungen
- Guia 27.Dokument4 SeitenGuia 27.ADRIANA CATHERIN AGUILAR LEMUSNoch keine Bewertungen
- Resultado de AprendizajeDokument8 SeitenResultado de AprendizajeKarly StyNoch keine Bewertungen
- Líquidos Del Gas NaturalDokument3 SeitenLíquidos Del Gas NaturalDay VergaraNoch keine Bewertungen
- EJE 2 TP 5 Mary Richmond y Otros PrecursoresDokument17 SeitenEJE 2 TP 5 Mary Richmond y Otros PrecursoresflavioNoch keine Bewertungen
- Resumen SombrerosDokument2 SeitenResumen SombrerosJorge Eduardo Lalito Reategui CarrascoNoch keine Bewertungen
- Anestesia CX PlasticaDokument25 SeitenAnestesia CX PlasticaPamelita Francys Mamani FloresNoch keine Bewertungen
- S10.s1. Caso Práctico en Clase.Dokument6 SeitenS10.s1. Caso Práctico en Clase.Nathaly LooezNoch keine Bewertungen
- TESIS ALE Y EMI 2 CompletaDokument27 SeitenTESIS ALE Y EMI 2 CompletaalejandroNoch keine Bewertungen
- Cuestionario Practica 2Dokument2 SeitenCuestionario Practica 2AnelPeña0% (1)
- Análisis de Cancion DesesperadaDokument3 SeitenAnálisis de Cancion DesesperadaRodrigoNoch keine Bewertungen
- Test 3Dokument10 SeitenTest 3Segundo PicoNoch keine Bewertungen
- Ram (Exposicion)Dokument11 SeitenRam (Exposicion)Ricardo Bladimir Arias CastroNoch keine Bewertungen
- Aldiss, Brian W. - El Suave DilemaDokument21 SeitenAldiss, Brian W. - El Suave DilemaCristhian TorresNoch keine Bewertungen
- Circular 6 Campamento Nacional de Lideres ScoutsDokument4 SeitenCircular 6 Campamento Nacional de Lideres ScoutsInfo FolletoNoch keine Bewertungen
- Cuanto Falta para El 5 de Enero - Buscar Con GoogleDokument1 SeiteCuanto Falta para El 5 de Enero - Buscar Con Googleqpnpdz8kpxNoch keine Bewertungen
- Brenda (11 y 12)Dokument7 SeitenBrenda (11 y 12)Daniel AlonsoNoch keine Bewertungen
- GUIA DescuentoDokument6 SeitenGUIA DescuentoMaria CoreaNoch keine Bewertungen
- Catalogo Inversiones RHDokument16 SeitenCatalogo Inversiones RHalexander gutierrezNoch keine Bewertungen
- Plan de Saguridad Defensa CivilDokument24 SeitenPlan de Saguridad Defensa CivilAlvaro JosuéNoch keine Bewertungen
- Ficha de Trabajo - S2 PDFDokument3 SeitenFicha de Trabajo - S2 PDFjan zarasiNoch keine Bewertungen
- Comidas Típicas Del Estado MirandaDokument9 SeitenComidas Típicas Del Estado MirandajjorNoch keine Bewertungen
- Como Hacer Una A CaseraDokument7 SeitenComo Hacer Una A CaseraMaria Gabriela Castillo HernandesNoch keine Bewertungen
- Sebastián Ibarra Mendieta: Guia de Trabajo No 3Dokument3 SeitenSebastián Ibarra Mendieta: Guia de Trabajo No 3Gilberto Ramirez SeguraNoch keine Bewertungen
- Notebook Inspiron 14 3000 Core I3-5005u 4GB 500GB 14Dokument2 SeitenNotebook Inspiron 14 3000 Core I3-5005u 4GB 500GB 14Nico InfanteNoch keine Bewertungen