Beruflich Dokumente
Kultur Dokumente
Jitorres Taller 1
Hochgeladen von
Sandra GomezOriginalbeschreibung:
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Jitorres Taller 1
Hochgeladen von
Sandra GomezCopyright:
Verfügbare Formate
UNIVERSIDAD INDUSTRIAL DE SANTANDER
Primer taller – Química Inorgánica II
Prof. Martha E. Niño
28 de agosto 2018
1. a. Represente las dos estructuras que describen la mayoría de complejos
tetracoordinados.
b. ¿En qué geometría son posibles isómeros para complejos de formula MA2B2?
2. Explique el significado de los términos monodentado, bidentado y
cuadridentado.
3. ¿Cuáles de las siguientes moléculas podrían actuar como ligantes quelatantes?
N
N
N
N
a. P(OPh)3 b. Me2P(CH2)2PMe2 c. d.
4. ¿Qué tipo de isómeros son los compuestos [RuBr(NH3)5]Cl y [RuCl(NH3)5] Br?
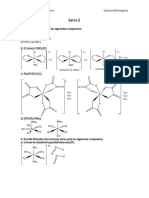
5. Para los siguientes complejos octaédricos dibuje todos los posibles isómeros.
[FeCl(OH2)5]2+, [Ir(Cl)3(PEt3)3], [Ru(bipy)3]2+, [CO(Cl)2(en)(NH3)2]+, [w(CO)4(py)2].
6. El complejo inicialmente designado como β-[PtCl2(NH3)2] se identificó como el
isómero trans (el isómero cis fue designado como α). Éste reacciona
lentamente con Ag2O sólido para producir [Pt(NH3)2(OH2)]2+. Este complejo no
reacciona con etilendiamina para dar un complejo quelato. Nombre y dibuje la
estructura del complejo diacuo. Un tercer complejo de composición PtCl 2·2NH3
es un sólido insoluble que, cuando se muele con AgNO3, da una disolución que
contiene [Pt(NH3)4](NO3)2 y una nueva fase sólida de composición Ag2[PtCl4]. Dé
las estructuras y los nombres de cada uno de los tres compuestos de platino II.
7. La oxidación con aire del carbonato de cobalto II y cloruro de amonio acuoso da
un cloruro salino de color rosa que tiene una relación 4NH3:Co. Al añadir HCl a
una solución de esta sal, se desprende con rapidez un gas y la solución se torna
lentamente violeta al calentarla. La evaporación completa de la solución violeta
da CoCl3·4NH3. Cuando se calienta este compuesto en HCl concentrado, se
puede aislar una sal verde de composición CoCl3·4NH3·HCl. Escriba las
ecuaciones balanceadas correspondientes a las transformaciones que se
producen después de la oxidación con aire y dé toda la información que sea
posible referente al isomerÍsmo que tiene lugar, explicando el razonamiento
seguido. ¿Ayuda en algo saber que la forma de [Co(Cl)2(en)2]+ que se puede
resolver en enantiómeros es violeta?
8. Cuando las sales de cobalto II son oxidadas por el aire en una solución que
contiene amoniaco y nitrito de sodio, se puede aislar un sólido amarillo:
[Co(NO2)3(NH3)3]. En solución este compuesto no tiene conductividad, pero al
tratarlo con HCl da un complejo que, tras una serie de reacciones adicionales,
puede ser identificado como trans-[Co(Cl)2(NH3)3(OH2)]+. La preparación del cis-
[Co(Cl)2(NH3)3(OH2)]+ requiere de un método completamente distinto. ¿De qué
color son estos compuestos?
9. Nombre y dibuje las estructuras de los complejos siguientes: a. [Ni(CO)4]; b.
[Ni(CN)4]2-; c. [CoCl4]2-; d. [Mn(NH3)6]2+
10. ¿Cuáles de los siguientes complejos son quirales? a. [Cr(ox)3]3-; b. cis-
[Pt(Cl)2(en)]; c. [Ru(bipy)3]2+; d. cis-[Rh(Cl)2(NH3)4]+; e. fac-[Co(NO2)3(dien)], y
mer-[Co(NO2)3(dien)]. Dibuje los enantiómeros de los complejos identificados
como quirales e identifique el plano de simetría en las estructuras de los
complejos aquirales.
Das könnte Ihnen auch gefallen
- IsomeriaDokument2 SeitenIsomeriaEvelyn Tapia100% (1)
- Reporte - Lab 4 - Arenazas, YadiraDokument8 SeitenReporte - Lab 4 - Arenazas, YadiraRomy ArenazasNoch keine Bewertungen
- Cuestionario 1Dokument3 SeitenCuestionario 1Anghella SanchezNoch keine Bewertungen
- EJERCICIOS Organometálicos - 2024Dokument1 SeiteEJERCICIOS Organometálicos - 2024ireneNoch keine Bewertungen
- Taller UNIDAD I NOMENCLATURADokument4 SeitenTaller UNIDAD I NOMENCLATURAvillegas.angelaNoch keine Bewertungen
- 1 Examen Quimica Inorganica 2 CABRERA DIAZ ALVARO MAURICIODokument8 Seiten1 Examen Quimica Inorganica 2 CABRERA DIAZ ALVARO MAURICIOAlvaro Cabrera DiazNoch keine Bewertungen
- Taller 2 InorganicaDokument5 SeitenTaller 2 InorganicaAlvaro Cabrera DiazNoch keine Bewertungen
- EjerciciosDokument2 SeitenEjerciciosSylvia EspinNoch keine Bewertungen
- Armenta Chacón Alfonso Alam S2Dokument3 SeitenArmenta Chacón Alfonso Alam S2alfonso alamNoch keine Bewertungen
- Taller de Estudio II Química Inorgánica IIDokument3 SeitenTaller de Estudio II Química Inorgánica IIHerman Ruiz CalderinNoch keine Bewertungen
- Ejercicios de ComplejosDokument1 SeiteEjercicios de Complejoschupetintrujillo123Noch keine Bewertungen
- Listado Ejercicios Preparacion certamenII INO1 2018Dokument3 SeitenListado Ejercicios Preparacion certamenII INO1 2018Cami SotoNoch keine Bewertungen
- Compuesto de Coordinacion TEV y TCC (2) Febr 2020-2Dokument85 SeitenCompuesto de Coordinacion TEV y TCC (2) Febr 2020-2Renato Cesar Ccoa SalcedoNoch keine Bewertungen
- Tarea - Compuestos de CoordinaciónDokument1 SeiteTarea - Compuestos de CoordinaciónUnknow100% (1)
- Nomenclatura de Compuestos Coordinados By-Astrid PDFDokument5 SeitenNomenclatura de Compuestos Coordinados By-Astrid PDFqazxswNoch keine Bewertungen
- Seminario de Complejos 2023Dokument4 SeitenSeminario de Complejos 2023NagiiNoch keine Bewertungen
- Taller Unidad 2Dokument5 SeitenTaller Unidad 2Blanca MasabandaNoch keine Bewertungen
- Quimica Inorganica Complejos 1ra ParteDokument90 SeitenQuimica Inorganica Complejos 1ra Partedaniela estefiNoch keine Bewertungen
- CuestQI IDokument18 SeitenCuestQI ILuis CastroNoch keine Bewertungen
- P ComplejosDokument2 SeitenP ComplejosLuis VillonNoch keine Bewertungen
- Guia de Compuestos de Coordinacion UcDokument3 SeitenGuia de Compuestos de Coordinacion UcJeimyCastroPrietoNoch keine Bewertungen
- Ex Parc 2Dokument2 SeitenEx Parc 2Luciano AlonsoNoch keine Bewertungen
- Seminario 10Dokument4 SeitenSeminario 10anaNoch keine Bewertungen
- Taller 2 FinalDokument4 SeitenTaller 2 FinalMary SolNoch keine Bewertungen
- Examen FinalDokument2 SeitenExamen FinalFernanda PovedaNoch keine Bewertungen
- Problemario Qoa U1-2Dokument10 SeitenProblemario Qoa U1-2Robles Gutiérrez Kevin GabrielNoch keine Bewertungen
- Complejos Quimicos Coordinacion 2012Dokument2 SeitenComplejos Quimicos Coordinacion 2012artedlcNoch keine Bewertungen
- Coordinacion1-1 3269Dokument38 SeitenCoordinacion1-1 3269Karla Dominguez CastilloNoch keine Bewertungen
- Taller Final Química General PDFDokument5 SeitenTaller Final Química General PDFmariaNoch keine Bewertungen
- 2023 Serie 12 - CorregidaDokument5 Seiten2023 Serie 12 - CorregidaKevin Baez MenciaNoch keine Bewertungen
- Taller No 1 (QUIM 1212)Dokument2 SeitenTaller No 1 (QUIM 1212)Salima GutierrezNoch keine Bewertungen
- Examen MQS DepartamentalDokument9 SeitenExamen MQS DepartamentalMiguel Angel Velazquez CarmonaNoch keine Bewertungen
- Taller 2 Corte: Química GeneralDokument10 SeitenTaller 2 Corte: Química GeneralJosé Parodi CartagenaNoch keine Bewertungen
- Exercicios 4º Eso FeqDokument4 SeitenExercicios 4º Eso FeqPoluteg XDNoch keine Bewertungen
- Ejercicios QuimicaDokument8 SeitenEjercicios QuimicaIsmael GallardoNoch keine Bewertungen
- Guia de Ejercicios Capitulo IDokument14 SeitenGuia de Ejercicios Capitulo IGeraldineArrietaZacariasNoch keine Bewertungen
- Taller 8. Enlace QuímicoDokument1 SeiteTaller 8. Enlace QuímicoVanessa Saavedra100% (1)
- GuíaDokument4 SeitenGuíaShoot DieselNoch keine Bewertungen
- QGI P4 Enlaces QuímicosDokument3 SeitenQGI P4 Enlaces QuímicosJuan Manuel Uceda PérezNoch keine Bewertungen
- Guía de Ejercicios Capítulo IDokument14 SeitenGuía de Ejercicios Capítulo Icristianvaras3100% (2)
- Guía de Problemas de Whitten Quimica I 2021 2C PDFDokument41 SeitenGuía de Problemas de Whitten Quimica I 2021 2C PDFZoe BetazzaNoch keine Bewertungen
- Obtencion de Compuestos de Coordinacion Nro 4Dokument3 SeitenObtencion de Compuestos de Coordinacion Nro 4Deyvit GutierrezNoch keine Bewertungen
- Tarea 1Dokument2 SeitenTarea 1Ricardo Martínez CondeNoch keine Bewertungen
- QuimicaDokument10 SeitenQuimicaDenys A. Quispe Ramos100% (1)
- Examen de Repaso Quimica.Dokument11 SeitenExamen de Repaso Quimica.Caroline AilynNoch keine Bewertungen
- Compuestos de CoordinacionDokument24 SeitenCompuestos de CoordinacionBernardo ValadezNoch keine Bewertungen
- Cuaderno de Ejercicios: Química Tercero 2020Dokument13 SeitenCuaderno de Ejercicios: Química Tercero 2020logokillaNoch keine Bewertungen
- QM-1121 Serie de Problemas 3 Prof. BarriolaDokument21 SeitenQM-1121 Serie de Problemas 3 Prof. BarriolaEnriqueArmijosNoch keine Bewertungen
- QM-1121 Serie de Problemas 3 Prof. BarriolaDokument21 SeitenQM-1121 Serie de Problemas 3 Prof. BarriolaRaul CamachoNoch keine Bewertungen
- Serie de Problemas 03Dokument21 SeitenSerie de Problemas 03Daniel AndresNoch keine Bewertungen
- Taller No. 1 - Principios Q. Org. Gral.Dokument6 SeitenTaller No. 1 - Principios Q. Org. Gral.Ronal RenteriaNoch keine Bewertungen
- Banco Qui MicaDokument9 SeitenBanco Qui MicaE HernándezNoch keine Bewertungen
- Tarea Complejos Simetria - Pazmiño Alexander - bf3 p1Dokument9 SeitenTarea Complejos Simetria - Pazmiño Alexander - bf3 p1Alexander PazmiñoNoch keine Bewertungen
- 15 Seminario T6Dokument2 Seiten15 Seminario T6Raysale BANoch keine Bewertungen
- Practica Aula - Ii UnidadDokument2 SeitenPractica Aula - Ii UnidadFrank PortillaNoch keine Bewertungen
- Taller Cap. 2Dokument2 SeitenTaller Cap. 2Kathereen DGDNoch keine Bewertungen
- Preparación Del Complejo de CobaltoDokument10 SeitenPreparación Del Complejo de CobaltoJorge RosalesNoch keine Bewertungen
- Calcufa 13Dokument5 SeitenCalcufa 13Josue Velasquez RamosNoch keine Bewertungen
- Metodo de MohrDokument3 SeitenMetodo de MohrFïïtööBräävööNoch keine Bewertungen
- Elaboracion de PigmentosDokument7 SeitenElaboracion de PigmentosSusa Garzón GuereñaNoch keine Bewertungen
- Química Analítica - Colorometría - Clasificación de ReaccionesDokument11 SeitenQuímica Analítica - Colorometría - Clasificación de ReaccioneshanscortesNoch keine Bewertungen
- Practica 7-Reacciones Químicas - IndustrialDokument8 SeitenPractica 7-Reacciones Químicas - IndustrialPaul MantillaNoch keine Bewertungen
- Libro1 2Dokument136 SeitenLibro1 2MelanyValenciaNoch keine Bewertungen
- Disoluciones Solubilidad y EstequiometriaDokument13 SeitenDisoluciones Solubilidad y EstequiometriaRafael Arce FernándezNoch keine Bewertungen
- Analisis CompletoDokument42 SeitenAnalisis Completofrida ximena larios almonte100% (1)
- Quimica 2Dokument4 SeitenQuimica 2Haruka KouNoch keine Bewertungen
- Analisis GravimetricoDokument14 SeitenAnalisis GravimetricoRinnenNoch keine Bewertungen
- Propiedades Químicas de Los Alcoholes y FenolesDokument10 SeitenPropiedades Químicas de Los Alcoholes y FenolesJuan Diego PeñaNoch keine Bewertungen
- Practica 9 Reaccion Quimica II 2023-1Dokument7 SeitenPractica 9 Reaccion Quimica II 2023-1Andrea MendozaNoch keine Bewertungen
- Practica 2. Separacion de Una MezclaDokument6 SeitenPractica 2. Separacion de Una MezclaValentina RaposoNoch keine Bewertungen
- CARTEL Sintesis de TerbutiloDokument1 SeiteCARTEL Sintesis de Terbutiloestefania garciaNoch keine Bewertungen
- AnalisisDokument3 SeitenAnalisisOswäldo SuárezNoch keine Bewertungen
- Determinacion de Co2Dokument3 SeitenDeterminacion de Co2serdnasolNoch keine Bewertungen
- ACTIVIDAD EXPERIMENTAL 3 Identificacion de Iones en SueloDokument3 SeitenACTIVIDAD EXPERIMENTAL 3 Identificacion de Iones en SueloGC GonzaloNoch keine Bewertungen
- Analitica EjemplosDokument21 SeitenAnalitica EjemplosDaniel Zaldaña0% (1)
- ArgentometríaDokument5 SeitenArgentometríaCcortesO100% (1)
- Guia de LaboratorioDokument58 SeitenGuia de LaboratorioHector Valdes RojasNoch keine Bewertungen
- Aminas Parte 1Dokument121 SeitenAminas Parte 1Silvana CortésNoch keine Bewertungen
- Sintesis ClorociclohexanoDokument4 SeitenSintesis ClorociclohexanoAntonio Cortez D Lara XD100% (1)
- LIXIVIACIONDokument12 SeitenLIXIVIACIONemersonmonzonNoch keine Bewertungen
- Informe 10Dokument24 SeitenInforme 10AnelizNoch keine Bewertungen
- Pract.n10 ToxicologiaDokument42 SeitenPract.n10 ToxicologiaYOBANA ROJASNoch keine Bewertungen
- Apurate RoqueDokument5 SeitenApurate RoqueRoque Cortez YahirNoch keine Bewertungen
- Lab 4 Subgrupo Del CobreDokument7 SeitenLab 4 Subgrupo Del CobreMendoza RomeroNoch keine Bewertungen
- Ejercicios Estequimetria Con SolucionDokument2 SeitenEjercicios Estequimetria Con SolucionIdiomas BabelNoch keine Bewertungen
- Leches Carol y EliDokument20 SeitenLeches Carol y EliCarito ContrerasNoch keine Bewertungen
- Guia de Prácticas de Química Orgánica IIDokument86 SeitenGuia de Prácticas de Química Orgánica IIDina ReyesbNoch keine Bewertungen