Beruflich Dokumente
Kultur Dokumente
Expresiones Alg
Hochgeladen von
Rafael OnofreOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Expresiones Alg
Hochgeladen von
Rafael OnofreCopyright:
Verfügbare Formate
Expresiones Algebraicas
Se conoce como Expresiones Algebraicas a la combinación de letras,
signos y números en la operaciones matemática. Por lo general las letras
representan cantidades desconocidas y son llamadas variables o
incógnitas. Las expresiones algebraicas nos permiten traducir a las
expresiones del lenguaje matemático del lenguaje habitual.
Las expresiones algebraicas surgen de la obligación de traducir valores
desconocidos a números, que
como lo señalamos antes, están
representados por letras. La rama
de las matemáticas responsable
del estudio de estas expresiones
en las que aparecen números y
letras, así como signos de
operaciones matemáticas, es Álgebra.
La representación en letras de un valor indeterminado, llamados
variables o incógnitas, son tratados como números, por lo que se le
aplican las mismas leyes y propiedades.
Como las expresiones algebraicas son combinaciones de letras y
números que se pueden encontrar en cualquier tipo de operación,
presumiblemente hay una clasificación de expresiones algebraicas
preestablecidas. Es importante tener claro las funciones de los criterios
de clasificación, para resolver correctamente los ejercicios de expresion
algebraica.
Las expresiones algebraicas recordamos que es el concepto en álgebra
el que define la combinación de números y letras unidas por
operaciones matemáticas elementales. Las expresiones algebraicas se
dividen en: monomios y polinomio. Esto debido a que su clasificación
está establecida según el número de términos.
CLASIFICACION DE EXPRESIONES ALGEBRAICAS
De acuerdo al número de términos, las expresiones algebraicas se
pueden clasificar generalmente en monomios y polinomios.
MONOMIO:
Es una expresión algebraica que consta de un solo término, por
ejemplo, 12m⁴, - a² b ,
POLINOMIO:
Nombre : Génesis Vasconez
Son expresiones algebraicas que constan de dos o más términos.
Ejemplo:
a. x+y+z
b. 9m² - 16n⁴
c. 2x⁴ + 5x⁵ - 54x – 135
Los polinomios de dos términos reciben el nombre especial de
BINOMIOS.
Ejemplos de binomios:
a. x² - y²
b. a⁴ b⁵ + 3 a² b² c⁷
Los polinomios de tres términos reciben el nombre de TRINOMIOS.
Son ejemplos de trinomios:
a. x² - 10x + 25
b. ab³ + 5a² b⁷ m – 35 abx⁵
ACLARACION IMPORTANTE:
En algunos modernos libros de álgebra, el concepto de polinomio varía
mucho del concepto tradicional que acabamos de mencionar.
“La condición para que una expresión sea polinomio es que todos los
exponentes de la variable sean enteros y positivos”
En cambio, la expresión 2x⁵ es un polinomio de acuerdo a la expresión
dada, pues su exponente es entero y positivo.
Así también, la cantidad 5 es un polinomio, pues este número lo
podemos expresar como 5x0 donde vemos que el exponente es entero
y no es negativo.
Nombre : Génesis Vasconez
Organización química de los seres vivos
Los organismos somos auténticas "industrias químicas". Esta frase tiene un
significado más profundo de lo que, en principio, podría parecer; si
pensamos en una fábrica y la analizamos, veremos lo que se esconde
detrás: una fábrica está hecha de ciertos materiales y de máquinas, las
piezas que realizan sus productos. Además, la fábrica realiza algún tipo
de proceso, en general transformando ciertas sustancias (recursos) en
otras (productos) para lo cual necesita algún tipo de energía. Esto es
también así en el caso de las células (y, por extensión, de los seres vivos),
pero aquí aparece la peculiaridad de nuestra naturaleza como fábricas
químicas.
Los seres vivos somos capaces de construir nuestras propias estructuras a
partir de las sustancias químicas que encontramos en nuestro entorno.
Precisamente por eso, es sorprendente observar la gran diferencia que
existe entre la composición química de cualquier organismo y la materia
inorgánica que nos rodea de la que, al fin y al cabo, hemos tomado los
materiales para autoensamblarnos.
Esa diferencia es absolutamente evidente si observamos las sustancias
químicas que nos componen, pero en cierto sentido esto es esperable,
si tenemos en cuenta que somos máquinas químicas, sistemas que
tenemos como modo de funcionamiento la modificación de ciertas
sustancias químicas para dar lugar a otras. La diferencia es algo más
extraña si en lo que nos fijamos es en los elementos químicos que
forman parte de esas sustancias: los organismos no poseemos
capacidad para modificar átomos, solo para utilizar unos u otros según
nuestras necesidades.
Establezcamos una comparación con las rocas, otro de los elementos
naturales que forman parte de nuestro planeta: la composición química
de las rocas siempre es una muestra representativa del ambiente
química en que se formaron, además de ser tremendamente variable
entre los distintos tipos de rocas. Por el contrario, la composición química
de los seres vivos es prácticamente igual en todos ellos, y nunca guarda
relación con el entorno químico del que forman parte. Esta situación
plantea dos preguntas: ¿qué diferencias existen en la composición
química de los organismos y la de su entorno? ¿A qué se deben estas
diferencias?
Nombre : Génesis Vasconez
En la naturaleza podemos encontrar 92 elementos químicos diferentes.
Aunque no es una ley matemática, se puede decir que,
aproximadamente, su abundancia es inversamente proporcional a su
número atómico (esto es así porque inicialmente solo se generó
Hidrógeno, y el resto de los elementos químicos se han ido produciendo
a partir de él).
Los virus, un caso especial
Reconstrucción de un rotavirus.
Los virus cumplen con algunas de estas características (materia
organizada y compleja, reproducción y evolución), pero no tienen
metabolismo ni desarrollo. Hay cierto consenso en no considerarlos
organismos aunque aún hay quien discrepa sobre la cuestión. Si
consideramos que la característica básica de un ser vivo es tener
Nombre : Génesis Vasconez
descendencia y evolucionar, también los virus podrían considerarse
seres vivos, pero si añadimos la posesión de un metabolismo y la
capacidad de desarrollo, entonces no. Si definimos a la vida como un
sistema con autopoiesis, la polémica si un virus es un ser viviente se
resuelve con este concepto, ya que el virus no cuenta con una
organización material autopoiética
Elementos químicos
La materia viva está constituida por unos 60 elementos, casi todos los
elementos estables de la Tierra, exceptuando los gases nobles. Estos
elementos se llaman bioelementos o elementos biogénicos. Se pueden
clasificar en dos tipos: primarios y secundarios.
Los elementos primarios son indispensables para formar las
biomoléculas orgánicas (glúcidos, lípidos, proteínas y ácidos nucléicos).
Constituyen el 96,2% de la materia viva. Son el carbono, el hidrógeno, el
oxígeno, el nitrógeno, el fósforo y el azufre.
Los elementos secundarios son todos los bioelementos restantes.
Existen dos tipos: los indispensables y los variables. Entre los primeros se
encuentran el calcio, el sodio, el potasio, el magnesio, el cloro, el hierro,
el silicio, el cobre, el manganeso, el boro, el flúor y el iodo.
La bacteria Escherichia coli es un organismo procarionte presente en el
intestino de los seres humanos. Mide 1-4 µm.
El elemento químico fundamental de todos los compuestos orgánicos es
el carbono. Las características físicas de este elemento tales como su
gran afinidad de enlace con otros átomos pequeños, incluyendo otros
átomos de carbono, y su pequeño tamaño le permiten formar enlaces
múltiples y lo hacen ideal como base de la vida orgánica. Es capaz de
formar compuestos pequeños que contienen pocos átomos (por
ejemplo el dióxido de carbono) así como grandes cadenas de muchos
miles de átomos denominadas macromoléculas; los enlaces entre
átomos de carbono son suficientemente fuertes para que las
macromoléculas sean estables y suficientemente débiles como para ser
Nombre : Génesis Vasconez
rotos durante el catabolismo; las macromoléculas a base
de silicio (siliconas) son virtualmente indestructibles en condiciones
normales, lo que las descartan como componentes de un ser vivo con
metabolismo.
Macromoléculas
Véase también: Biomolécula
Los compuestos orgánicos presentes en la materia viva muestran una
enorme variedad y la mayor parte de ellos son extraordinariamente
complejos. A pesar de ello, las macromoléculas biológicas están
constituidas a partir de un pequeño número de pequeñas moléculas
fundamentales (monómeros), que son idénticas en todas las especies
de seres vivos. Todas las proteínas están constituidas solamente por
20 aminoácidos distintos y todos los ácidos nucleicos por
cuatro nucleótidos. Se ha calculado que, aproximadamente un 90% de
toda la materia viva, que contiene muchos millones de compuestos
diferentes, está compuesta, en realidad por unas 40 moléculas
orgánicas pequeñas.
Por ejemplo, aun en las células más pequeñas y sencillas, como
la bacteria Escherichia coli, hay unos 5.000 compuestos orgánicos
diferentes, entre ellos, unas 3.000 clases diferentes de proteínas y se
calcula que en el cuerpo humano puede haber hasta 5 millones de
proteínas distintas; además ninguna de las moléculas proteicas de E.
coli es idéntica a alguna de las proteínas humanas, aunque varias
actúen del mismo modo.
La mayor parte de las macromoléculas biológicas que componen los
organismos pueden clasificarse en uno de los siguientes cuatro
grupos: ácidos nucleicos, proteínas, lípidos y glúcidos.
Nombre : Génesis Vasconez
Doble hélice de ADN.
Una proteína (hemoglobina).
Fosfolípidos organizados en liposoma, micela y bicapa lipídica.
Un glúcido (glucosa).
Nombre : Génesis Vasconez
Ácidos nucleicos
Los ácidos nucleicos (ADN y ARN) son macromoléculas formadas por
secuencias de nucleótidos que los seres vivos utilizan para almacenar
información. Dentro del ácido nucleico, un codón es una secuencia
particular de tres nucleótidos que codifica un aminoácido particular,
mientras que una secuencia de aminoácidos forma una proteína.
Proteínas
Las proteínas son macromoléculas formadas por secuencias de
aminoácidos que debido a sus características químicas se pliegan de
una manera específica y así realizan una función particular. Se
distinguen las siguientes funciones de las proteínas:
Enzimas, que catalizan las reacciones metabólicas.
Proteínas estructurales, por ejemplo, la tubulina y el colágeno.
Proteínas reguladoras, por ejemplo, la insulina, la hormona del
crecimiento y los factores de transcripción que regulan el ciclo de la
célula.
Proteínas señalizadoras y sus receptores, tales como
algunas hormonas.
Proteínas defensivas, por ejemplo, los anticuerpos del sistema
inmune y las toxinas. Algunas veces las toxinas contienen aminoácidos
inusuales tales como la canavanina.
MOLÉCULAS BIOLÓGICAS
Son moléculas compuestas por carbono, hidrógeno, oxígeno y otros
elementos, estos elementos se encuentran en cuatro tipos de moléculas
orgánicas: carbohidratos, lípidos, proteínas y nucleótidos. Todas estas
moléculas contienen C, H y O2, pero las proteínas contienen N y S, y los
nucleótidos, así como algunos lípidos, contienen N y P.
MOLÉCULAS BIOLÓGICAS: CARBOHIDRATOS
Aunque también son conocidos como glucanos o sacáridos, desde el
punto de vista químico su nombre es incorrecto, porque describe solo un
parte ínfima de estas moléculas, se debería llamar aldehídos o cetonas
polihidroxilados. Pero como tradición en este articulo también lo
llamaremos carbohidratos. En fin estas moléculas son muy importantes
para los seres vivos, son la fuente primaria de energía química y forman
parte de diversas estructuras de las células vías.
Los carbohidratos se pueden clasificar por diferentes aspectos, como la
ubicación de su carbonilo, por el número de carbonos en su estructura,
por la ubicación del grupo hidroxilo y también de acuerdo al número de
moléculas de azúcar que contiene, encontramos tres tipos de
carbohidratos:
Nombre : Génesis Vasconez
Los monosacáridos con solo una molécula de azúcar, por sus funciones
aldehídas o cetonas pueden ser cetonas o aldosas respectivamente.
Los disacáridos con dos monómeros por síntesis de deshidratación, los
oligosacáridos de tres a diez moléculas y los polisacáridos, carbohidratos
más complejos, pueden desde veinte a cientos de moléculas de azúcar
y cumplen funciones de reserva y estructural.
CLASIFICACION DE POLISACÁRIDOS
Algunos de los más comunes son:
Almidón: Es energía de reserva y se encuentra en las células vegetales,
tiene especial abundancia en el trigo, arroz y otros granos, lo que les
hace la mayor fuente de calorías.
Glicógeno: Se encuentra en tejidos animales y es almacenado en el
hígado o en el tejido muscular. Este polímero es útil manteniendo
concentraciones de azúcar en la sangre cuando la glucosa falta.
Celulosa: A diferencia de los anteriores polímeros, este es insoluble,
producido en plantas. A pesar de ser unión de monómeros de glucosa,
su unión es tan fuerte e insoluble, que la digestión de este compuesto es
un proceso lento.
Las funciones principales de los hidratos de carbono son: energética,
estructural, informativa y de desintoxicación.
Nombre : Génesis Vasconez
Función Energética: Son compuestos de reducción suficiente para ser
buenos combustibles, es decir la combustión de 1 g de carbohidratos
puede producir unas 4 Kcal, además al contener carbonilos y alcoholes,
pueden interactuar con el agua por lo que son combustibles de uso
inmediato, contrario a las grasas. Su degradación puede darse en
condiciones anaeróbicas por fermentación, que lo realizan todas las
células vivas, o aeróbicas por respiración, que lo realizan los organismos
fotosintéticos.
Función Estructural: Las paredes celulares de organismos como hongos,
bacterias, artrópodos, vegetales, entre otros; están constituidos por
hidratos de carbono o derivados. Estas membranas necesitan matrices
hidrofilias capaces de interactuar con medios acuosos, pero con su
cierta resistencia mecánica. Ej. La celulosa, molécula más abundante
de la Biosfera.
Función Informativa: Esta función se cumple gracias a que los lípidos o
proteínas de la célula pueden unirse a los carbohidratos, esta unión se
representa como una señal de reconocimiento para hormonas,
anticuerpos, bacterias, virus y otras células. Cuando un carbohidrato se
une a una proteína, también ayuda a que la proteína llegue a su
destino dentro de la célula y aumenta la solubilidad de las proteínas al
aportarle cargas negativas.
Función de Desintoxicación: Se encarga de eliminar compuestos tóxicos
que son muy poco solubles en agua, y que pueden acumularse en
tejidos con contenido lipídico como el cerebro o el tejido adiposo. Estos
compuestos tóxicos, por ejemplo, la bilirrubina se vuelve más solubles
cuando se conjugan con un derivado de la glucosa: el ácido
glucorónico y es eliminado por la orina u otras vías.
Carbono
El Carbono es un elemento químico abundante en la naturaleza, sus
detalles técnicos son los siguientes: en la tabla periodo ocupa la casilla
numero 6 y este número a su vez es el número atómico, su masa
atómica es 12,017 y su estado es
solido (No metálico, no magnético).
Este material completamente
orgánico presenta
características alotrópicasmuy poco
comunes, lo que permite que el uso
del carbono sea variado y muy útil. El
carbono se puede encontrar
como diamante, grafito y carbón, todas y cada una con una naturaleza
antológica a las demás, resulta curioso el uso que se le da a estas
variantes del carbono, pues uno de los más comunes es para la
fabricación de hidrocarburos y combustibles a base de fósiles los cuales
son potenciadores de energía renovable. Se ha demostrado en todas
sus variantes, que el carbono es cristalino, inclusive el carbón utilizado
Nombre : Génesis Vasconez
para la manufactura de la gasolina y otros aceites, ha sido sometido a
evaluaciones microscópicas en las que se ha evidenciado la naturaleza
cristalina de este elemento químico.
Hidrogeno
El primer paso necesario para poder comenzar a analizar en
profundidad el significado del término hidrógeno es determinar su
origen etimológico. Al hacerlo descubrimos que emana del griego, en
concreto de la palabra
“hydrogenium”. Esta se
encuentra conformada por
dos partes claramente
diferenciadas: “hydro”, que es
sinónimo de “agua”, y
“genos”, que es equivalente a
“generador”.
El hidrógeno es el elemento
químico de número atómico 1.
Se trata del más ligero de los elementos con una masa atómica de
1,00794 (7) u y del más abundante del universo y de la corteza terrestre
(constituye el 83,9% de la materia visible). En la atmósfera, el hidrógeno
se halla como gas incoloro, inodoro e inflamable, en su forma molecular
H2.
El protio y el deuterio son los isotopos naturales del hidrógeno. El más
común en la naturaleza es el protio, que dispone de un único protón y
no tiene ningún neutrón. El tritio, por otra parte, es un isotopo artificial de
hidrógeno.
NITROGENO
En el griego es donde se encuentra el origen etimológico de la palabra
que vamos a analizar a continuación: nitrógeno. En concreto podemos
dejar patente que aquella está formada por
la unión del vocablo nitron que significa
“nitrato potásico” y gen que equivale a
“generación”. No obstante, hay que dejar
patente que quien creó este término no fue
otro que el químico francés Jean Antonie
Chaptal en el año 1790.
Nombre : Génesis Vasconez
Se conoce como nitrógeno al elemento químico que se caracteriza por
tener como número atómico al 7 y que se simboliza con la letra N. Se
trata de un gas sin color ni olor y de carácter insípido que está presente
en las cuartas quintas partes del aire de la atmósfera (en su versión
molecular, reconocido como N2).
Cabe resaltar que el nitrógeno se suele aprovechar como refrigerante y
es útil en el proceso de formación del amoniaco que luego permite
crear fertilizantes y explosivos, entre otros productos. Con el nitrógeno
también es posible fabricar ácido nítrico.
AMINOACIDOS
Un aminoácido es una molécula orgánica con un grupo amino (-NH2) y
un grupo carboxilo (-COOH).1 Los aminoácidos más frecuentes y de
mayor interés son aquellos que forman
parte de las proteínas; juegan en casi
todos los procesos biológicos un papel
clave. Los aminoácidos son la base de las
proteínas.
Dos aminoácidos se combinan en una
reacción de condensación entre el grupo
amino de uno y el carboxilo del otro,
liberándose una molécula de agua y
formando un enlace amida que se
denomina enlace peptídico; estos dos "residuos" de aminoácido forman
un dipéptido, si se une un tercer aminoácido se forma un tripéptido y así,
sucesivamente, hasta formar un polipéptido. Esta reacción tiene lugar
de manera natural dentro de las células, en los ribosomas.
Todos los aminoácidos componentes de las proteínas son L-alfa-
aminoácidos. Esto significa que el grupo amino está unido al carbono
contiguo al grupo carboxilo (carbono alfa) o, dicho de otro modo, que
tanto el carboxilo como el amino están unidos al mismo carbono;
además, a este carbono alfa se unen un hidrógeno y una cadena
(habitualmente denominada cadena lateral o radical R) de estructura
variable, que determina la identidad y las propiedades de cada uno de
los diferentes aminoácidos. Existen cientos de radicales por lo que se
conocen cientos de aminoácidos diferentes, pero sólo 22 (los dos
últimos fueron descubiertos en los años 1986 -selenocisteína- y 2002 -
pirrolisina-)2 forman parte de las proteínas y tienen codones específicos
Nombre : Génesis Vasconez
en el código genético. Estos 22 aminoácidos son capaces de codificar
para las proteínas y es por ello que forman parte de ellas.
CARBOHIDRATOS
Los carbohidratos son unas biomoléculas que también toman los nombres
de hidratos de carbono, glúcidos, azúcares
o sacáridos; aunque los dos primeros
nombres, los más comunes y empleados,
no son del todo precisos, ya que no se
tratan estrictamente de átomos de
carbono hidratados, pero los intentos por
sustituir estos términos por otros más
precisos no han tenido éxito. Estas
moléculas están formadas por tres
elementos fundamentales: el carbono,
el hidrógeno y el oxígeno, este último en
una proporción algo más baja. Su principal
función en el organismo de los seres vivos
es la de contribuir en el almacenamiento y en la obtención de energía de
forma inmediata, sobre todo al cerebro y al sistema nervioso.
Esto se cumple gracias a una enzima, la amilasa, que ayuda a
descomponer esta molécula en glucosa o azúcar en sangre, que hace
posible que el cuerpo utilice la energía para realizar sus funciones.
LIPIDOS.
Los lípidos o grasas son moléculas
orgánicas solubles en solventes
diferentes al agua. Están compuestas
principalmente de carbono e hidrógeno,
y, en menor proporción, de oxígeno,
nitrógeno y fósforo.
Los lípidos se caracterizan por cómo se
disuelven en diferentes líquidos o
solventes. La mayoría son insolubles en
agua, mientras que se disuelven fácilmente en solventes orgánicos
como el éter, el benceno o la acetona.
A diferencia de las proteínas, los ácidos nucleicos y los carbohidratos, los
lípidos no tienen una estructura básica común. Por eso, dentro de este
grupo de biomoléculas se encuentran muchos compuestos de formas
variadas.
Nombre : Génesis Vasconez
AGUA
El agua ( escuchar) (del latín aqua) es una sustancia cuya molécula
está compuesta por dos átomos de hidrógeno y uno
de oxígeno (H2O). El término agua generalmente se
refiere a la sustancia en su estado líquido, aunque la
misma puede hallarse en su forma sólida, llamada
hielo, y en su forma gaseosa, denominada vapor.
VIDA
En el latín es donde se encuentra el origen etimológico de la palabra vida.
Concretamente procede del vocablo vita, que a
su vez emana del término griego bios. Todos ellos
significan precisamente vida.
El concepto de vida puede ser definido desde
diversos enfoques. La noción más habitual está
vinculada a la biología, que sostiene que la vida es
la capacidad de nacer, crecer, reproducirse y
morir. En este sentido, la vida es aquello que distingue a hombres, animales y
plantas, por ejemplo, de los objetos como una roca o una mesa.
PH
Se trata de una unidad de medida de alcalinidad o acidez de una
solución, más específicamente el pH mide la cantidad de iones de
hidrógeno que contiene una
solución determinada, el significado
de sus sigla son, potencial de
hidrogeniones, el pH se ha
convertido en una forma práctica
de de manejar cifras de alcalinidad,
en lugar de otros métodos un poca
más complicados.
El pH se puede medir de manera precisa a través de la utilización de
una herramienta conocida como pH-metro, este aparato puede medir
la diferencia de potencial entre un par de electrolitos. El pH de una
solución se puede llegar a medir con aproximaciones, utilizando para
ellos indicadores de ácidos o bases los cuales pueden presentar una
coloración distinta dependiendo del pH, normalmente el método
consiste en emplear un papel impregnado con los indicadores
cualitativos.
Nombre : Génesis Vasconez
Das könnte Ihnen auch gefallen
- Trabajo de Nomenclatura y EstequiometriaDokument16 SeitenTrabajo de Nomenclatura y EstequiometriaCarmen ChirinosNoch keine Bewertungen
- PRE CE QuimicaDokument48 SeitenPRE CE QuimicaOmarCristobalNoch keine Bewertungen
- Qué Es BioenergéticaDokument4 SeitenQué Es BioenergéticaGrisel RodriguezNoch keine Bewertungen
- PolinomiosDokument6 SeitenPolinomiosTriste RealidadNoch keine Bewertungen
- Tema 1 2023 - ADokument28 SeitenTema 1 2023 - AAnahi MilagrosNoch keine Bewertungen
- Reacciones QuímicasDokument9 SeitenReacciones QuímicasHéctor LópezNoch keine Bewertungen
- SecciónA Práctica3 EFGRDokument18 SeitenSecciónA Práctica3 EFGRFernando RojoNoch keine Bewertungen
- Conceptos de monómeros, oligómeros, polímeros y masa molecularDokument5 SeitenConceptos de monómeros, oligómeros, polímeros y masa molecularAsarel Torres MartinezNoch keine Bewertungen
- Act.1 Investigacion Antonio DelacruzDokument19 SeitenAct.1 Investigacion Antonio DelacruzHirondelle García HernándezNoch keine Bewertungen
- Tarea 1 de AlgebraDokument2 SeitenTarea 1 de AlgebraFrancisca M MejiaNoch keine Bewertungen
- Trabajo Autónomo Unidad 2Dokument26 SeitenTrabajo Autónomo Unidad 2Genessis Vanessa Marquez PalaciosNoch keine Bewertungen
- Que Es AlgebraDokument6 SeitenQue Es AlgebraP Henry Xajil QNoch keine Bewertungen
- QUIMICA Guía # 5 - DECIMODokument7 SeitenQUIMICA Guía # 5 - DECIMOCamila Mendez SanchezNoch keine Bewertungen
- Química Mercedes CuestionarioDokument21 SeitenQuímica Mercedes Cuestionarioangeled4Noch keine Bewertungen
- Ejemplos de Cambios Químicos ExplicadosDokument6 SeitenEjemplos de Cambios Químicos ExplicadosJavi MiraNoch keine Bewertungen
- AlgebraDokument6 SeitenAlgebraElvis Dreycko BenditaNoch keine Bewertungen
- Mate Matic ADokument11 SeitenMate Matic AAIMEENoch keine Bewertungen
- Práctica 3 Química General, IPN.Dokument16 SeitenPráctica 3 Química General, IPN.Fernando Rojo100% (1)
- Nomenclatura de Compuestos Inorganicos - Lic en QuimicaDokument14 SeitenNomenclatura de Compuestos Inorganicos - Lic en QuimicaSempiterno ARoseNoch keine Bewertungen
- Clase de La 1 A La 7Dokument201 SeitenClase de La 1 A La 7COFRISA SA DE CVNoch keine Bewertungen
- Tipos de reacciones químicas e identificación de símbolosDokument5 SeitenTipos de reacciones químicas e identificación de símbolosAna María Alvarado Medinilla100% (1)
- Tema 1Dokument23 SeitenTema 1Katerin Melipsa Moscoso EsquivelNoch keine Bewertungen
- Act. 1 Investigación Cruz Pérez.Dokument30 SeitenAct. 1 Investigación Cruz Pérez.Hirondelle García HernándezNoch keine Bewertungen
- Ciencias ExperimentalesDokument129 SeitenCiencias ExperimentalesdevilmoskNoch keine Bewertungen
- ¡QUIMICAS POR TODAS PARTES¡Dokument6 Seiten¡QUIMICAS POR TODAS PARTES¡Rosa danny Valenzuela taverasNoch keine Bewertungen
- 1.1. Clasificacion de Materia y ConceptosDokument20 Seiten1.1. Clasificacion de Materia y ConceptosHumberto Javier Guirao MartinezNoch keine Bewertungen
- Monomios y PolinomiosDokument22 SeitenMonomios y PolinomiosDeyvin Burgos GomezNoch keine Bewertungen
- Antología de Química Orgánica IDokument44 SeitenAntología de Química Orgánica ILunaNoch keine Bewertungen
- 8.-Tipos de Fórmulas de Compuestos OrgánicosDokument3 Seiten8.-Tipos de Fórmulas de Compuestos OrgánicosMaida Rocabado100% (1)
- Reglas Del Cálculo ProposicionalDokument6 SeitenReglas Del Cálculo ProposicionalluwevaNoch keine Bewertungen
- Conceptos ExposiciónDokument2 SeitenConceptos ExposiciónRodríguez Barranco José KenenNoch keine Bewertungen
- Nomenclatura Química de Los Compuestos OrgánicosDokument13 SeitenNomenclatura Química de Los Compuestos OrgánicosJuan David De FreitasNoch keine Bewertungen
- Nomenclatura de Compuestos Cos PH, Expoc. de Mi EquipoDokument27 SeitenNomenclatura de Compuestos Cos PH, Expoc. de Mi EquipoRodo AlvarezNoch keine Bewertungen
- POLIMEROSDokument45 SeitenPOLIMEROSMartina SolarNoch keine Bewertungen
- La MezclaDokument6 SeitenLa MezclaGenesis Zoralys HacheNoch keine Bewertungen
- Fundamentos de estequiometría químicaDokument52 SeitenFundamentos de estequiometría químicamaria sotoNoch keine Bewertungen
- Reaccion y Formula Química - NomenclaturaDokument7 SeitenReaccion y Formula Química - NomenclaturaKAREN DANIELA SANCHEZ GARCIANoch keine Bewertungen
- Benceno, el máximo exponente de los hidrocarburos aromáticosDokument16 SeitenBenceno, el máximo exponente de los hidrocarburos aromáticosRoxi-chan UwUNoch keine Bewertungen
- 8 A Guia - NomenclaturaDokument3 Seiten8 A Guia - NomenclaturaValery Sofia villa maldonadoNoch keine Bewertungen
- Reglas IUPACDokument10 SeitenReglas IUPACBrandon ParicaguaNoch keine Bewertungen
- Und 2, Expresiones Algebraicas.Dokument21 SeitenUnd 2, Expresiones Algebraicas.rubneidaNoch keine Bewertungen
- Nomenclatura QuimicaDokument6 SeitenNomenclatura Quimicacaroline hernandezNoch keine Bewertungen
- Concepto de Compuestos InorgánicosDokument4 SeitenConcepto de Compuestos Inorgánicosalexander enrique suarez bastidasNoch keine Bewertungen
- Bloque 1. Atomo Molecula y Mol EvlreconvDokument4 SeitenBloque 1. Atomo Molecula y Mol EvlreconvSilvia CBNoch keine Bewertungen
- FOLLETO QUIMICA DEL CARBONO UNIDAD I ContinuacionDokument11 SeitenFOLLETO QUIMICA DEL CARBONO UNIDAD I ContinuacionJose Antonio Osejo IbarraNoch keine Bewertungen
- Química I - INTRODokument53 SeitenQuímica I - INTROjosu.diaz.juarrosNoch keine Bewertungen
- Bioquimica General MFIDokument9 SeitenBioquimica General MFIMarianela GambelliNoch keine Bewertungen
- Quimica de Octavo y Noveno Mayo y Junio 2021Dokument30 SeitenQuimica de Octavo y Noveno Mayo y Junio 2021Yomaira Romero VitolaNoch keine Bewertungen
- Guia de PolinomiosDokument7 SeitenGuia de PolinomiosLibardoNoch keine Bewertungen
- Macro Mole Cul AsDokument16 SeitenMacro Mole Cul AsFernando GutierrezNoch keine Bewertungen
- Guia Nomenclatura QuimicaDokument25 SeitenGuia Nomenclatura QuimicaMayGap100% (1)
- Nombrar compuestos químicosDokument6 SeitenNombrar compuestos químicosMike MaxxNoch keine Bewertungen
- C. Naturales 2° SecundariaDokument26 SeitenC. Naturales 2° SecundariaYarin Valladares GuerreroNoch keine Bewertungen
- Preguntas Sobre NomenclaturaDokument5 SeitenPreguntas Sobre NomenclaturaYanerys PaulinoNoch keine Bewertungen
- ISOMERÍADokument12 SeitenISOMERÍARichard BriceñoNoch keine Bewertungen
- MacromoléculasDokument4 SeitenMacromoléculasAnaNoch keine Bewertungen
- Guia Trabajo 3 LindheimerDokument4 SeitenGuia Trabajo 3 Lindheimerlauracgp1Noch keine Bewertungen
- QUIMICADokument2 SeitenQUIMICAKenia GarciiaNoch keine Bewertungen
- Guia de Aprendizaje 1 QuímicaDokument7 SeitenGuia de Aprendizaje 1 Químicayesica isaNoch keine Bewertungen
- Las resinas sintéticas usadas para el tratamiento de obras policromasVon EverandLas resinas sintéticas usadas para el tratamiento de obras policromasNoch keine Bewertungen
- Los Países IndustrializadosDokument3 SeitenLos Países IndustrializadosRafael OnofreNoch keine Bewertungen
- Preguntas MoreliaDokument2 SeitenPreguntas MoreliaRafael OnofreNoch keine Bewertungen
- Funciones de Base de DatosDokument2 SeitenFunciones de Base de DatosRafael OnofreNoch keine Bewertungen
- Caso Clinico ImpresionDokument22 SeitenCaso Clinico ImpresionRafael OnofreNoch keine Bewertungen
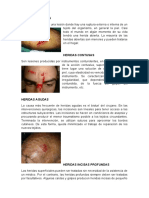
- Heridas AbiertasDokument3 SeitenHeridas AbiertasRafael Onofre100% (1)
- Gran Canasta NavideñaDokument1 SeiteGran Canasta NavideñaRafael OnofreNoch keine Bewertungen
- Tarea Virtual 6 Coe-Denis GuerreroDokument7 SeitenTarea Virtual 6 Coe-Denis GuerreroRafael OnofreNoch keine Bewertungen
- Caso Clinico ImpresionDokument22 SeitenCaso Clinico ImpresionRafael OnofreNoch keine Bewertungen
- Unidad 1 - Semana 1 Tarea C7 1roDokument2 SeitenUnidad 1 - Semana 1 Tarea C7 1roRafael OnofreNoch keine Bewertungen
- Amor y Sexualidad Del Adulto MayorDokument2 SeitenAmor y Sexualidad Del Adulto MayorRafael OnofreNoch keine Bewertungen
- Heridas AbiertasDokument3 SeitenHeridas AbiertasRafael OnofreNoch keine Bewertungen
- Actividad de Aprendizaje Tarea 2 Unidad 1 SOCIALESDokument3 SeitenActividad de Aprendizaje Tarea 2 Unidad 1 SOCIALESRafael OnofreNoch keine Bewertungen
- Acciones Que Constituyen Hostigamiento o Acoso SexualDokument2 SeitenAcciones Que Constituyen Hostigamiento o Acoso SexualRafael OnofreNoch keine Bewertungen
- Como La Tecnología Afecta La Planificación de Lecciones de Educación BásicaDokument2 SeitenComo La Tecnología Afecta La Planificación de Lecciones de Educación BásicaRafael OnofreNoch keine Bewertungen
- 2.... Hagamos EmpanadasDokument7 Seiten2.... Hagamos EmpanadasRafael OnofreNoch keine Bewertungen
- Actividad de Aprendizaje 4 Unidad 1 INTERDISCIPLINARDokument2 SeitenActividad de Aprendizaje 4 Unidad 1 INTERDISCIPLINARRafael OnofreNoch keine Bewertungen
- Área de Ciencias Naturales - Química y Biología-Tarea Unidad 1 Actividad de Aprendizaje 3Dokument2 SeitenÁrea de Ciencias Naturales - Química y Biología-Tarea Unidad 1 Actividad de Aprendizaje 3Rafael OnofreNoch keine Bewertungen
- C6 T2-U1 Historia e HistoriografíaDokument3 SeitenC6 T2-U1 Historia e HistoriografíaRafael OnofreNoch keine Bewertungen
- Carta de PoderDokument1 SeiteCarta de PoderRafael OnofreNoch keine Bewertungen
- Actividad de Recuperación Unidad 1 LENGUADokument2 SeitenActividad de Recuperación Unidad 1 LENGUARafael OnofreNoch keine Bewertungen
- Actividad de Aprendizaje Tarea 3 Unidad 1 SOCIALESDokument3 SeitenActividad de Aprendizaje Tarea 3 Unidad 1 SOCIALESRafael OnofreNoch keine Bewertungen
- Prueba de Diagnostico Segundo ADokument4 SeitenPrueba de Diagnostico Segundo ARafael OnofreNoch keine Bewertungen
- Actividad de Aprendizaje 2 Unidad 1-LENGUADokument3 SeitenActividad de Aprendizaje 2 Unidad 1-LENGUARafael OnofreNoch keine Bewertungen
- Actividad de Aprendizaje 3 U1. 1ro BGUDokument3 SeitenActividad de Aprendizaje 3 U1. 1ro BGURafael OnofreNoch keine Bewertungen
- Actividad de Aprendizaje 3 Unidad 1 LENGUADokument5 SeitenActividad de Aprendizaje 3 Unidad 1 LENGUARafael OnofreNoch keine Bewertungen
- Actividad de Aprendizaje 2 Unidad 1 INTERDISCPLINARDokument2 SeitenActividad de Aprendizaje 2 Unidad 1 INTERDISCPLINARRafael OnofreNoch keine Bewertungen
- Actividad de Recuperación U1Dokument3 SeitenActividad de Recuperación U1Rafael OnofreNoch keine Bewertungen
- Datos Del EstudianteDokument1 SeiteDatos Del EstudianteRafael OnofreNoch keine Bewertungen
- Dignóstico para 2do 2021Dokument5 SeitenDignóstico para 2do 2021Rafael OnofreNoch keine Bewertungen
- Conflict oDokument27 SeitenConflict oRafael OnofreNoch keine Bewertungen
- Actividad catalasa en patataDokument5 SeitenActividad catalasa en patataAndres LizarazoNoch keine Bewertungen
- Cloro Gas MSDS QuimpacDokument6 SeitenCloro Gas MSDS QuimpacErik ValenciaNoch keine Bewertungen
- Extracción de Oro Con Solución Lixiviante TioureaDokument36 SeitenExtracción de Oro Con Solución Lixiviante TioureaMILTON ANDRES ANGULO MORRIS100% (1)
- Unidad 8 AlquinosDokument14 SeitenUnidad 8 AlquinosFLORES POMA THIAGO ALEXNoch keine Bewertungen
- Ejercicios de Soluciones DesarrolladosDokument8 SeitenEjercicios de Soluciones DesarrolladosMarianoo Montalvo FonsecaNoch keine Bewertungen
- Introduccion de PiedraDokument21 SeitenIntroduccion de Piedracristian mamani balconaNoch keine Bewertungen
- Aldehidos y CetonasDokument8 SeitenAldehidos y CetonasMARIO FERNANDO CABRERA RIASCOSNoch keine Bewertungen
- Acidez de cationes y basicidad de oxoanionesDokument5 SeitenAcidez de cationes y basicidad de oxoanionesAzul HernándezNoch keine Bewertungen
- Reacciones Redox Química ExperimentalDokument1 SeiteReacciones Redox Química ExperimentalAleManosalvaNoch keine Bewertungen
- Cuadernillo Química GeneralDokument118 SeitenCuadernillo Química GeneralGon MedinaNoch keine Bewertungen
- Sustancias Compuestas o CompuestosDokument5 SeitenSustancias Compuestas o Compuestosvaldir freitasNoch keine Bewertungen
- Cuerva de ValoracionDokument7 SeitenCuerva de ValoracionJonathan MontesdeocaNoch keine Bewertungen
- Equilibrio IonicoDokument47 SeitenEquilibrio IonicoKariito CyNoch keine Bewertungen
- Clasificación de Las Rocas Ígneas Según Su Composición QuímicaDokument5 SeitenClasificación de Las Rocas Ígneas Según Su Composición QuímicaSergio Marca AlvarezNoch keine Bewertungen
- Drogas Psicoactivas.Dokument49 SeitenDrogas Psicoactivas.ddenuNoch keine Bewertungen
- Determinacion de Calcio y MagnesioDokument3 SeitenDeterminacion de Calcio y MagnesioChristian Arias VeraNoch keine Bewertungen
- Cuadro de Simbolos y Valencias de Los Principales Elementos QuimicosDokument1 SeiteCuadro de Simbolos y Valencias de Los Principales Elementos QuimicosSantiago Daniel Murillo Espinosa0% (1)
- Ejercicios-Electroquimica S9Dokument2 SeitenEjercicios-Electroquimica S9Sol TapullimaNoch keine Bewertungen
- Informe 6 (Grupo3)Dokument16 SeitenInforme 6 (Grupo3)RAMOS OLLACHICA MARYORI JENNIFERNoch keine Bewertungen
- Reacciones Quimicas Organicas Selectividad PDFDokument12 SeitenReacciones Quimicas Organicas Selectividad PDFDaniel GarabitoNoch keine Bewertungen
- Segundo Parcial Problemas 3 y 2Dokument5 SeitenSegundo Parcial Problemas 3 y 2Iris Estephanie Sanchez Betancourt33% (3)
- 501885-Anhídrido CarbónicoDokument2 Seiten501885-Anhídrido CarbónicoHugo CsbNoch keine Bewertungen
- Química del carbono USACDokument25 SeitenQuímica del carbono USACMiguel BedoyaNoch keine Bewertungen
- Ejercicios Nom. Gral 1Dokument3 SeitenEjercicios Nom. Gral 1Paoli RuizNoch keine Bewertungen
- Polimerizaciones iónicas: diferencias con radicalariasDokument11 SeitenPolimerizaciones iónicas: diferencias con radicalariasCarlos CorpasNoch keine Bewertungen
- Tema CompuestosDokument13 SeitenTema CompuestosAldahir DavilaNoch keine Bewertungen
- Tarea Entregable U3-S1 YS2Dokument4 SeitenTarea Entregable U3-S1 YS2moyanet moyanetNoch keine Bewertungen
- Tablas de Termodinamica Ene 2010 7 (1) - RemovedDokument26 SeitenTablas de Termodinamica Ene 2010 7 (1) - RemovedDanyNoch keine Bewertungen
- Minerales: formación, clasificación y propiedadesDokument30 SeitenMinerales: formación, clasificación y propiedadesRodrigo CáceresNoch keine Bewertungen
- Test 1 CAMARERAS LIMPIADORASDokument3 SeitenTest 1 CAMARERAS LIMPIADORASantonio minchillo100% (4)