Beruflich Dokumente
Kultur Dokumente
Metal
Hochgeladen von
Leandro Espino MaurtuaCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Metal
Hochgeladen von
Leandro Espino MaurtuaCopyright:
Verfügbare Formate
Para otros usos de este t�rmino, v�ase Metal (desambiguaci�n).
Forja met�lica en la marquesina del actual Ayuntamiento de Madrid, antiguo Palacio
de Comunicaciones.
Se denominan metales a los elementos qu�micos caracterizados por ser buenos
conductores del calor y la electricidad. Poseen alta densidad y son s�lidos a
temperatura ambiente (excepto el mercurio); sus sales forman iones electropositivos
(cationes) en disoluci�n.1?
La ciencia de materiales define un metal como un material en el que existe un
solapamiento entre la banda de valencia y la banda de conducci�n en su estructura
electr�nica (enlace met�lico).2? Esto le da la capacidad de conducir f�cilmente
calor y electricidad (tal como el cobre) y generalmente la capacidad de reflejar la
luz, lo que le da su peculiar brillo. En ausencia de una estructura electr�nica
conocida, se usa el t�rmino para describir el comportamiento de aquellos materiales
en los que, en ciertos rangos de presi�n y temperatura, la conductividad el�ctrica
disminuye al elevar la temperatura, en contraste con los semiconductores.
Reaccionan qu�micamente con no metales, no son reactivos entre s� la gran mayor�a
de las veces (aunque algunos formen aleaciones entre s�).
Dentro de los metales se encuentran los alcalinos (como el sodio) y los
alcalinot�rreos (como el magnesio) los cuales presentan baja densidad, son buenos
conductores del calor y la electricidad, adem�s de ser muy reactivos.3? Tambi�n se
incluyen los metales de transici�n (los cuales conforman la mayor�a de los
metales), los que se encuentran en diversos grupos y los lant�nidos, act�nidos y
transact�nidos.4?Te�ricamente, el resto de elementos que queda por descubrir y
sintetizar ser�an metales.
Periodic-Table-Metals.jpg
El concepto de metal se refiere tanto a elementos puros, as� como aleaciones con
caracter�sticas met�licas, como el acero y el bronce. Los metales comprenden la
mayor parte de la tabla peri�dica de los elementos y se separan de los no metales
por una l�nea diagonal entre el boro y el polonio.5? En comparaci�n con los no
metales tienen baja electronegatividad y baja energ�a de ionizaci�n, por lo que es
m�s f�cil que los metales cedan electrones y m�s dif�cil que los ganen.
En astrof�sica se llama metal a todo elemento m�s pesado que el helio.6?
Se obtiene a partir de los minerales que contienen (menas met�licas)
�ndice
1 Historia
2 Propiedades de los metales
2.1 Teor�a del gas electr�nico
3 Obtenci�n
4 Usos en la industria
5 Dilataci�n de los metales
6 Definiciones de t�rminos usados en fundiciones
7 Aleaciones
8 Fractura en materiales met�licos[12]?
8.1 Fractura d�ctil
8.2 Fractura fr�gil
9 V�ase tambi�n
10 Referencias
11 Enlaces externos
Historia
Herramientas de cobre datadas hacia 3000 a. C. en el Antiguo Egipto.
Metales como el oro, la plata y el cobre, fueron utilizados desde la prehistoria.
Al principio, solo se usaron los que se encontraban f�cilmente en estado puro (en
forma de elementos nativos), pero paulatinamente se fue desarrollando la tecnolog�a
necesaria para obtener nuevos metales a partir de sus menas, calent�ndolos en un
horno mediante carb�n de madera.
El primer gran avance se produjo con el descubrimiento del bronce, fruto de la
utilizaci�n de mineral de cobre con incursiones de esta�o, entre 3500 a. C. y 2000
a. C., en diferentes regiones del planeta, surgiendo la denominada Edad del Bronce,
que sucede a la Edad de Piedra.
Otro hecho importante en la historia fue la utilizaci�n del hierro, hacia 1400 a.
C. Los hititas fueron uno de los primeros pueblos en utilizarlo para elaborar
armas, tales como espadas, y las civilizaciones que todav�a estaban en la Edad del
Bronce, como los egipcios.
No obstante, en la antig�edad no se sab�a alcanzar la temperatura necesaria para
fundir el hierro, por lo que se obten�a un metal impuro que hab�a de ser moldeado a
martillazos. Hacia el a�o 1400 se empezaron a utilizar los hornos provistos de
fuelle,7?que permiten alcanzar la temperatura de fusi�n del hierro, unos 1535 �C.
Henry Bessemer descubri� un modo de producir acero en grandes cantidades con un
coste razonable. Tras numerosos intentos fallidos, dio con un nuevo dise�o de horno
(el convertidor Thomas-Bessemer) y, a partir de entonces, mejor� la construcci�n de
estructuras en edificios y puentes, pasando el hierro a un segundo plano.
Poco despu�s se utiliz� el aluminio y el magnesio, que permitieron desarrollar
aleaciones mucho m�s ligeras y resistentes, muy utilizadas en aviaci�n, transporte
terrestre y herramientas port�tiles.
El titanio, es el �ltimo de los metales abundantes y estables con los que se est�
trabajando y se espera que, en poco tiempo, el uso de la tecnolog�a del titanio se
generalice.
Los elementos met�licos, as� como el resto de elementos, se encuentran ordenados en
un sistema denominado tabla peri�dica. La mayor�a de los elementos de esta tabla
son metales.
Los metales se diferencian del resto de elementos, fundamentalmente en el tipo de
enlace que constituyen sus �tomos. Se trata de un enlace met�lico y en �l los
electrones forman una �nube� que se mueve, rodeando todos los n�cleos. Este tipo de
enlace es el que les confiere las propiedades de conducci�n el�ctrica, brillo, etc.
Hay todo tipo de metales: metales pesados, metales preciosos, metales ferrosos,
metales no ferrosos, etc., y el mercado de metales es muy importante en la econom�a
mundial.
Propiedades de los metales
La gran resistencia del metal junto a la facilidad de su trabajo lo hacen un
material excelente para cualquier construcci�n, en la imagen el Puente de La
Vicaria construido en acero corten.
Los metales poseen propiedades f�sicas caracter�sticas, entre ellas son conductores
de la electricidad. La mayor�a de ellos son de color gris�ceo, pero algunos
presentan colores distintos; el bismuto (Bi) es ros�ceo, el cobre (Cu) rojizo y el
oro (Au) amarillo. En otros metales aparece m�s de un color; este fen�meno se
denomina policromismo.
Otras propiedades ser�an:
Maleabilidad: capacidad de los metales de hacerse l�minas al ser sometidos a
esfuerzos de compresi�n.
Ductilidad: propiedad de los metales a moldearse en alambre e hilos al ser
sometidos a esfuerzos de tracci�n.
Tenacidad: resistencia que presentan los metales al romperse o al recibir fuerzas
bruscas (golpes, etc.)
Resistencia mec�nica: capacidad para resistir esfuerzo de tracci�n, compresi�n,
torsi�n y flexi�n sin deformarse ni romperse.
Suelen ser opacos o de brillo met�lico, tienen alta densidad, son d�ctiles y
maleables, tienen un punto de fusi�n alto, son duros, y son buenos conductores
(calor y electricidad).
La ciencia de materiales define un metal como un material en el que existe un
traslape entre la banda de valencia y la banda de conducci�n en su estructura
electr�nica (enlace met�lico). Esto le da la capacidad de conducir f�cilmente calor
y electricidad, y generalmente la capacidad de reflejar la luz, lo cual le da su
peculiar brillo.
Teor�a del gas electr�nico
Los metales tienen ciertas propiedades f�sicas caracter�sticas: a excepci�n del
mercurio son s�lidos en condiciones ambientales normales, suelen ser opacos y
brillantes, tener alta densidad, ser d�ctiles y maleables, tener un punto de fusi�n
alto, ser duros, y ser buenos conductores del calor y la electricidad.
Estas propiedades se deben al hecho de que los electrones exteriores est�n ligados
solo �ligeramente� a los �tomos, formando una especie de gas (tambi�n llamado �gas
electr�nico�, �nube electr�nica� o �mar de electrones�), que se conoce como enlace
met�lico. Drude y Lorentz propusieron este modelo hacia 1900.8?
Mediante la teor�a del �gas electr�nico� podemos explicar por qu� los metales son
tan buenos conductores del calor y la electricidad, pero es necesario comprender la
naturaleza del enlace entre sus �tomos.
Un primer intento para explicar el enlace met�lico consisti� en considerar un
modelo en el cual los electrones de valencia de cada metal se pod�an mover
libremente en la red cristalina. De esta forma, el ret�culo met�lico se considera
constituido por un conjunto de iones positivos (los n�cleos rodeados por su capa de
electrones) y electrones (los de valencia), en lugar de estar formados por �tomos
neutros.
En definitiva, un elemento met�lico se considera que est� constituido por cationes
met�licos distribuidos regularmente e inmersos en un �gas electr�nico� de valencia
deslocalizados, actuando como un aglutinante electrost�tico que mantiene unidos a
los cationes met�licos.
El modelo del �gas electr�nico� permite una explicaci�n cualitativa sencilla de la
conductividad el�ctrica y t�rmica de los metales. Dado que los electrones son
m�viles, se pueden trasladar desde el electrodo negativo al positivo cuando el
metal se somete al efecto de una diferencia de potencial el�ctrico. Los electrones
m�viles tambi�n pueden conducir el calor transportando la energ�a cin�tica de una
parte a otra del cristal. El car�cter d�ctil y maleable de los metales est�
permitido por el hecho de que el enlace deslocalizado se extiende en todas las
direcciones; es decir, no est� limitado a una orientaci�n determinada, como sucede
en el caso de los s�lidos de redes covalentes.
Cuando un cristal met�lico se deforma, no se rompen enlaces localizados; en su
lugar, el mar de electrones simplemente se adapta a la nueva distribuci�n de los
cationes, siendo la energ�a de la estructura deformada similar a la original. La
energ�a necesaria para deformar un metal como el litio es relativamente baja,
siendo, como es l�gico, mucho mayor la que se necesita para deformar un metal de
transici�n, porque este �ltimo posee muchos m�s electrones de valencia que son el
aglutinante electrost�tico de los cationes.
Mediante la teor�a del �gas electr�nico� se pueden justificar de forma
satisfactoria muchas propiedades de los metales, pero no es adecuada para explicar
otros aspectos, como la descripci�n detallada de la variaci�n de la conductividad
entre los elementos met�licos.
Obtenci�n
Un fragmento de oro nativo.
Algunos metales se encuentran en forma de elementos nativos, como el oro, la plata
y el cobre, aunque no es el estado m�s usual.
Muchos metales se encuentran en forma de �xidos. El ox�geno, al estar presente en
grandes cantidades en la atm�sfera, se combina muy f�cilmente con los metales, que
son elementos reductores, formando compuestos como el corind�n (Al2O3) y la
hematita (Fe2O3).
Los sulfuros constituyen el tipo de mena met�lica m�s frecuente. En este grupo
destacan el sulfuro de cobre (I), Cu2S, el sulfuro de mercurio (II), HgS, el
sulfuro de plomo, PbS y el sulfuro de bismuto (III), Bi2S3.
Los metales alcalinos, adem�s del berilio y el magnesio, se suelen extraer a partir
de los cloruros depositados debido a la evaporaci�n de mares y lagos, aunque
tambi�n se extrae del agua del mar. El ejemplo m�s caracter�stico es el cloruro
s�dico o sal com�n, NaCl.
Algunos metales alcalinot�rreos, el calcio, el estroncio y el bario, se obtienen a
partir de los carbonatos insolubles en los que est�n insertos.
Por �ltimo, los lant�nidos y act�nidos se suelen obtener a partir de los fosfatos,
que son unas sales en las que pueden estar incluidos.
Usos en la industria
Metales que est�n destinados a un uso especial, son el antimonio, el cadmio o el
litio.
Los pigmentos amarillos y anaranjados del cadmio son muy buscados por su gran
estabilidad, como protecci�n contra la corrosi�n, para las soldaduras y las
aleaciones correspondientes y en la fabricaci�n de bater�as de n�quel y cadmio,
consideradas excelentes por la seguridad de su funcionamiento. Tambi�n se le
utiliza como estabilizador en los materiales pl�sticos (PVCsad) y como aleaci�n
para mejorar las caracter�sticas mec�nicas del alambre de cobre.9?Su producci�n se
lleva a cabo en el momento de la refinaci�n de zinc, con el que est� ligado, se
trata de un contaminante peligroso.
El litio, metal ligero, se emplea principalmente en la cer�mica y en los cristales,
como catalizador de polimerizaci�n y como lubricante, as� como para la obtenci�n
del aluminio mediante electr�lisis. Tambi�n se emplea para soldar, en las pilas y
en las bater�as para relojes, en medicina (tratamiento para los man�aco-depresivos)
y en qu�mica.
El n�quel, a causa de su elevada resistencia a la corrosi�n, sirve para niquelar
los objetos met�licos, con el fin de protegerlos de la oxidaci�n10? y de darles un
brillo inalterable en la intemperie.
El denominado �hierro blanco� es, en realidad, una l�mina de acero dulce que recibe
un ba�o de cloruro de zinc fundido, y a la que se da despu�s un revestimiento
especial de esta�o.
Dilataci�n de los metales
Los metales son materiales que tienen una elevada dilataci�n, en parte debido a su
conductividad. Las dilataciones son perceptibles a veces aun con los cambios de
temperatura ambiental. Se miden linealmente y se fija la unidad de longitud para la
variaci�n de 1 �C de temperatura.
Maleabilidad es la propiedad de los metales de poder ser modificados en su forma y
aun ser reducidos a l�minas de poco espesor a temperatura ambiente, por presi�n
continua, martillado o estirado. Produciendo las modificaciones en el metal, se
llega a un momento en que el l�mite de elasticidad es excedido, torn�ndose el metal
duro y quebradizo; es decir, sufre deformaciones cristalinas que lo hacen fr�gil.
La maleabilidad puede ser recuperada mediante el recocido, que consiste en calentar
el metal a una alta temperatura luego de laminado o estirado, y dejarlo enfriar
lentamente. La maleabilidad se aprecia por la sutileza del laminado. Tomando el oro
como base, se suele hacer la siguiente clasificaci�n:
1. Oro.
2. Plata.
3. Cobre.
4. Aluminio.
5. Esta�o.
6. Platino.
7. Plomo.
8. Zinc.
9. Hierro.
10. N�quel.
Definiciones de t�rminos usados en fundiciones
Aleaci�n: Una aleaci�n es una mezcla homog�nea de dos o m�s elementos, generalmente
metales (aunque a veces uno de ellos puede ser un no metal).
Arrabio: Hierro l�quido con menos impurezas que el hierro inicial.
Escoria: Las impurezas que reaccionan con caliza.
Alto horno: Horno para hacer aleaciones y fundiciones, se alcanzan temperaturas muy
elevadas. Hay que construirlo con materiales refractarios, es decir muy resistentes
al calor.
Aleaciones
Los metales pueden formar aleaciones entre s� y se clasifican en:11?
Ultraligeros: Densidad en g/cm� inferior a 2. Los m�s comunes de este tipo son el
magnesio y el berilio.
Ejemplo de aleaci�n ligera
Ligeros: Densidad en g/cm� inferior a 4,5. Los m�s comunes de este tipo son el
aluminio y el titanio.
Pesados: Densidad en g/cm� superior a 4,5. Son la mayor�a de los metales.
V�ase tambi�n la clasificaci�n de los metales en la tabla peri�dica.
Fractura en materiales met�licos12?
Fractura d�ctil
Suele presentarse en forma transgranular, es decir a trav�s de los granos, en los
metales d�ctiles y con buena tenacidad.
La deformaci�n sucede antes de la fractura final, se puede observar una
deformaci�n, la modificaci�n visible que aparenta un cuello, entallamiento o
estricci�n justo en la parte donde se ocasion� la falla. Estas fracturas pueden ser
ocasionadas por sobrecargas simples o al aplicar un esfuerzo muy grande al
material.
Si se realiza una prueba de tensi�n en un ensayo simple el proceso de fractura ser�
con la nucleaci�n, el crecimiento y la coalescencia de micro huecos, formados
cuando un gran esfuerzo crea una separaci�n en los l�mites de granos, conforme el
esfuerzo aumenta la separaci�n de los granos crea cavidades m�s grandes con lo cual
el �rea de contacto con el metal es muy peque�a y no puede soportar la carga
provocando finalmente la fractura.
Fractura fr�gil
Sucede en los metales y aleaciones de alta resistencia o pueden presentarse en los
de mala ductibilidad y tenacidad, sin importar que los metales tengan dentro de sus
propiedades la ductibilidad al exponerlos a bajas temperaturas pueden fallar por
fragilidad, as� mismo en las secciones gruesas o por imperfecciones.
Las fracturas fr�giles son observadas con frecuencia cuando es el impacto y no la
sobrecarga lo que causa la falla. El proceso comienza formando una peque�a grieta,
imperfecci�n, donde se concentra el esfuerzo. La grieta puede extenderse con una
velocidad cercana al sonido, la cual se propaga con m�s facilidad a lo largo de
planos cristalogr�ficos espec�ficos.
Das könnte Ihnen auch gefallen
- FimeDokument8 SeitenFimeDayana GarcíaNoch keine Bewertungen
- MMk-643+Hardware+manual V.a.8 ESP PDFDokument22 SeitenMMk-643+Hardware+manual V.a.8 ESP PDFMileNoch keine Bewertungen
- PT-GO-04 Izaje y Montajes de Postes Hormigon .Dokument19 SeitenPT-GO-04 Izaje y Montajes de Postes Hormigon .RaulNoch keine Bewertungen
- Instructivo Mantenimiento Equipo AlturaDokument8 SeitenInstructivo Mantenimiento Equipo AlturaLuis CarlosNoch keine Bewertungen
- 1 PDFDokument28 Seiten1 PDFRICHARD APAZA ARPASINoch keine Bewertungen
- Reaccion Endergonica y ExergonicaDokument3 SeitenReaccion Endergonica y ExergonicaJosé Soto0% (1)
- Ejemplo TrabeDokument10 SeitenEjemplo TrabetomascuevasNoch keine Bewertungen
- Sistema de Prevencion de PreventoresDokument5 SeitenSistema de Prevencion de PreventoresadolfoNoch keine Bewertungen
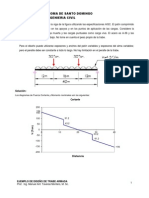
- 01 Niveles y DinagramasDokument18 Seiten01 Niveles y DinagramasAndrea Frias Gomez100% (1)
- Programa de Máquinas HidráulicasDokument21 SeitenPrograma de Máquinas HidráulicasCarlosCámbaraNoch keine Bewertungen
- Aeropuertos en Ingenieria CivilDokument76 SeitenAeropuertos en Ingenieria CivilJoelHuamayalliNoch keine Bewertungen
- Práctica 4Dokument6 SeitenPráctica 4JESUS JOEL FELIX QUINTERONoch keine Bewertungen
- Extra Soldadura PDFDokument43 SeitenExtra Soldadura PDFSpanishRacingNoch keine Bewertungen
- Equipo de Presion CaudalDokument24 SeitenEquipo de Presion CaudalCamilo Alejandro Cubillos TrujilloNoch keine Bewertungen
- Texto Especial 2008Dokument161 SeitenTexto Especial 2008Cardenas Zegarra YilmerNoch keine Bewertungen
- Seguridad en Circuitos ElectroneumáticosDokument36 SeitenSeguridad en Circuitos ElectroneumáticosEdgardo Moyano RojasNoch keine Bewertungen
- Instalacion de IRAF en UbuntuDokument4 SeitenInstalacion de IRAF en Ubuntueliaspizarro100% (1)
- Estudio de Suelos-CimentacionesDokument13 SeitenEstudio de Suelos-CimentacionesMilusca CalderónNoch keine Bewertungen
- Estructura molecular-OrganiGramaDokument5 SeitenEstructura molecular-OrganiGramaDewis Duar Moreno CottaNoch keine Bewertungen
- TESIS Clasificación Geomecánica Del Proyecto Vial Negromayo - OccoruroDokument115 SeitenTESIS Clasificación Geomecánica Del Proyecto Vial Negromayo - OccoruromagnoliaNoch keine Bewertungen
- Valenzuela Rojas Alejandro 201212451Dokument2 SeitenValenzuela Rojas Alejandro 201212451Alejandro ValenzuelaNoch keine Bewertungen
- INFORME HIDROL - Pte.YAURICHAMBIDokument4 SeitenINFORME HIDROL - Pte.YAURICHAMBIAlex QuintoNoch keine Bewertungen
- Arquitectura de ComputadorasDokument47 SeitenArquitectura de ComputadorasRigoberto He HeNoch keine Bewertungen
- Oaci 4444Dokument460 SeitenOaci 4444Cristian SalcedoNoch keine Bewertungen
- Fabricación de Un Filtro Purificador de Agua CaseroDokument5 SeitenFabricación de Un Filtro Purificador de Agua CaseroSergioSanabria100% (1)
- Fanel en Minería SubterráneaDokument28 SeitenFanel en Minería SubterráneaIber Jhon Alvarado VillanuevaNoch keine Bewertungen
- Cimentacciones de Trabla A EstacaDokument8 SeitenCimentacciones de Trabla A Estacadiasum123Noch keine Bewertungen
- Instalación y Configuración de MySQLDokument3 SeitenInstalación y Configuración de MySQLLeonardo PelayoNoch keine Bewertungen
- AmplificadoresDokument2 SeitenAmplificadoresAlan AnguianoNoch keine Bewertungen
- Mandos NeumáticosDokument3 SeitenMandos Neumáticoscristian morales50% (2)