Beruflich Dokumente
Kultur Dokumente
Clasificación de Los DM y Reactivos in Vitro
Hochgeladen von
Elizabeth Ortega Clavijo0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
67 Ansichten15 SeitenCLASIFICACION
Originaltitel
Clasificación de Los Dm y Reactivos in Vitro
Copyright
© © All Rights Reserved
Verfügbare Formate
DOCX, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCLASIFICACION
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
67 Ansichten15 SeitenClasificación de Los DM y Reactivos in Vitro
Hochgeladen von
Elizabeth Ortega ClavijoCLASIFICACION
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 15
CLASIFICACIÓN DE LOS DISPOSITIVOS MÉDICOS Y
LOS REACTIVOS DE DIAGNÓSTICOS IN-VITRO
ORTEGA CLAVIJO ELIZABETH
POLO ALVARADO JESUS
RODRIGUEZ PINTO ELIANA
ZULUAGA GOMEZ ANDRES
Presentado a:
QF. ALVIS SERRANO MARTIN
ELECTIVA VIII: DISPOSITIVOS MEDICOS
X SEMESTRE
UNIVERSIDAD DEL ATLÁNTICO
FACULTAD DE QUÍMICA Y FARMACIA
PROGRAMA DE FARMACIA
PUERTO COLOMBIA
2019 - I
INTRODUCCIÓN
Los Dispositivos Médicos son cualquier instrumento, aparato, máquina, software,
equipo biomédico u otro artículo similar o relacionado, utilizado solo o en
combinación, incluyendo sus componentes, partes, accesorios y programas
informáticos que intervengan en su correcta aplicación, destinado por el fabricante
para el uso en seres humanos. Los dispositivos médicos NO desarrollan una
acción terapéutica, como sí lo hacen los medicamentos, los cuales ejercen su
acción principal por medios farmacológicos, inmunológicos o metabólicos; sin
embargo, muchas veces el dispositivo es utilizado para administrar productos
farmacéuticos. También existen Dispositivos Médicos Combinados, es decir
cuando forman con un fármaco un sólo producto destinado a ser utilizado
exclusivamente en esta combinación, si la función principal del producto tiene una
acción farmacológica, se considera como un medicamento, por el contrario, si la
función principal es la de ser dispositivo y la del fármaco es accesoria, se cataloga
como dispositivo médico.
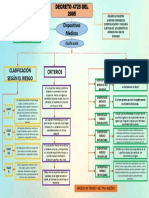
Los dispositivos médicos se clasifican por el fabricante según los potenciales
riesgos de su uso y el posible fracaso de estos por algunos criterios como el grado
de invasión, efecto sistémico, lugar de utilización, etc. Esta clasificación viene
definida por una serie de factores y criterios establecidos en el decreto 4725/2005.
Por su parte los reactivos de diagnóstico in-vitro son un producto reactivo,
calibrador, elaborado en material de control, utilizado sólo o en asociación con
otros, destinado por el fabricante a ser utilizado in vitro para el estudio de
muestras procedentes del cuerpo humano, incluidas las donaciones de sangre,
órganos y tejidos, principalmente con el fin de proporcionar información
relacionada con un estado fisiológico o patológico, una anomalía congénita,
determinar la seguridad y compatibilidad con receptores potenciales, y supervisión
de medidas terapéuticas. Estos reactivos se clasifican en tres categorías (bajo,
medio y alto riesgo) en base a una serie de reglas establecidas por el Decreto
3770/2004 basándose en las características propias del reactivo con base al
riesgo sanitario que estos conllevan.
CLASIFICACIÓN DE LOS DISPOSITIVOS MÉDICOS SEGÚN SU RIESGO
La clasificación de los dispositivos médicos realizada por el fabricante se
fundamenta en los riesgos potenciales relacionados con el uso y el posible fracaso
de los dispositivos con base en la combinación de varios criterios tales como,
duración del contacto con el cuerpo, grado de invasión y efecto local contra efecto
sistémico.
Tabla 1. Clasificación de los dispositivos médicos según su riesgo.
NIVEL DE
CLASE DEFINICIÓN EJEMPLOS
RIESGO
Son aquellos dispositivos
médicos, sujetos a controles
generales, no destinados para
proteger o mantener la vida o
para un uso de importancia Instrumental
Clase I Bajo
especial en la prevención del quirúrgico / Gasa.
deterioro de la salud humana
y que no representan un
riesgo potencial no razonable
de enfermedad o lesión.
Son aquellos dispositivos
Agujas
médicos, sujetos a controles
hipodérmicas /
Clase IIA Moderado especiales en la fase de
equipo de
fabricación para demostrar su
seguridad y efectividad. succión.
Son aquellos dispositivos
Ventilador
médicos, sujetos a controles
pulmonar /
Clase IIB Alto especiales en el diseño y
implantes
fabricación para demostrar su
seguridad y efectividad. ortopédicos.
Son aquellos dispositivos
médicos, sujetos a controles
especiales, destinados a
proteger o mantener la vida o Válvulas
para un uso de importancia
Clase III Muy alto cardiacas /
sustancial en la prevención
del deterioro de la salud marcapasos.
humana, o si su uso presenta
un riesgo potencial de
enfermedad o lesión.
Fuente: Elaboración Propia.
Ejemplos de dispositivos médicos por su clasificación
CLASE I (Instrumental quirúrgico) CLASE IIA (Agujas hipodérmicas)
CLASE IIB (Ventilador pulmonar) CLASE III (marcapasos)
Fuente: Google imágenes
CRITERIOS BÁSICOS PARA LA CLASIFICACIÓN POR RIESGO
La aplicación de las reglas de clasificación seregirá por la finalidad prevista de los
dispositivos médicos:
a) Si un dispositivo médico se destina a utilizarse en combinación con otro
dispositivomédico, las reglas de clasificación se aplicarán a cada uno de los
productos por separadodel producto con el que se utilicen;
b) Los soportes informáticos que sirvan para manejar un producto o que tengan
influenciaen su utilización se incluirán automáticamente en la misma categoría;
c) Si un dispositivo médico no se destina a utilizarse exclusiva o principalmente en
unaparte específica del cuerpo, se considerará para la clasificación, su utilización
específicamás crítica;
d) Si para el mismo dispositivo médico, son aplicables varias reglas teniendo en
cuentalas funciones que le atribuye el fabricante, se aplicarán las reglas que
conduzcan a laclasificación más elevada.
FACTORES QUE INFLUYEN EN LA CLASIFICACIÓN
Factores tales como tiempo de contacto, grado de invasión, si el dispositivo libera
un medicamento o energía, cuando afecta biológicamente a un paciente de forma
local ó sistémica, si es sólo o combinado, así:
1. Cuando un dispositivo va a ser utilizado junto con otros dispositivos, que son o
no del mismo fabricante, la regla de clasificación debe ser aplicada a cada uno de
los dispositivos por separado. Ejemplo: Kits.
2. Si el software independiente cae en la amplitud de la definición de dispositivo
médico, debería ser clasificado así:
Cuando éste conduce o influye en el empleo de un dispositivo médico,
debería ser clasificado según el uso indicado.
Cuando es independiente de cualquier otro dispositivo médico, es
clasificado teniendo en cuenta las reglas de clasificación del artículo 7 del
Decreto 4725 de 2005.
REGLAS DE CLASIFICACIÓN, SEGÚN ARTICULO 7 DEL DECRETO 4725
Para clasificar un dispositivo médico se tendrán en cuenta las siguientes reglas:
DISPOSITIVOS MÉDICOS NO INVASIVOS
Regla 1. Todos los dispositivos médicos no invasivos se incluirán en la clase I,
salvo que les sean aplicables algunas de las reglas siguientes.
Regla 2. Todos los dispositivos médicos no invasivos destinados a la conducción
o almacenamiento de sangre, fluidos o tejidos corporales, líquidos o gases
destinados a una perfusión, administración o introducción en el cuerpo, harán
parte de la clase IIA; siempre que:
a) Puedan conectarse a un dispositivo médico activo de la clase IIA o de una clase
superior;
b) Estén destinados a ser utilizados para el almacenamiento o canalización de
sangre u otros fluidos o para el almacenamiento de órganos, partes de órganos o
tejidos corporales. En todos los demás casos se incluirán en la clase I.
Regla 3. Todos los dispositivos médicos no invasivos destinados a modificar la
composición biológica o química de la sangre, de otros fluidos corporales o de
otros líquidos destinados a introducirse en el cuerpo se incluirán en la clase IIB,
salvo si el tratamiento consiste en filtración, centrifugación o intercambios de
gases o de calor, en cuyo caso, se incluirán en la clase IIa.
Regla 4. Todos los dispositivos médicos no invasivos que entren en contacto con
la piel lesionada se clasificarán en:
a) La clase I, si están destinados a ser utilizados como barrera mecánica para la
compresión o para la absorción de exudados;
b) La clase IIB, si se destinan principalmente a utilizarse con heridas que hayan
producido una ruptura de la dermis y sólo pueden cicatrizar por segunda intención;
c) La clase IIA, en todos los demás casos, incluidos los dispositivos médicos
destinados principalmente a actuar en el microentorno de una herida;
Diagrama 1. Reglas de los dispositivos médicos no invasivos.
Fuente:https://www.invima.gov.co/images/pdf/tecnovigilancia/ABC%20Dispositivos%20Me
dicos%20INVIMA.pdf
DISPOSITIVOS MEDICOS INVASIVOS
Regla 5. Todos los dispositivos médicos invasivos en relación con los orificios
corporales, salvo los dispositivos médicos invasivos de tipo quirúrgico, que no
estén destinados a ser conectados a un dispositivo médico activo, se incluirán en:
a) La clase I, si se destinan a un uso transitorio;
b) La clase IIA, si se destinan a un uso a corto plazo, salvo si se utilizan en la
cavidad oral hasta la faringe, en el conducto auditivo externo hasta el tímpano o en
una cavidad nasal, en cuyo caso, si incluirán en la clase I;
c) La clase IIB, si se destinan a un uso prolongado, salvo si se utilizan en la
cavidad oral hasta la faringe, en el conducto auditivo externo hasta el tímpano o en
una cavidad nasal, y no pueden ser absorbidos por la membrana mucosa, en cuyo
caso, se incluirán en la clase IIA.
d) Todos los productos invasivos en relación con los orificios corporales, salvo los
productos invasivos de tipo quirúrgico, que se destinen a conectarse a un producto
activo de la clase IIA o de una clase superior, entrarán en la clase IIA.
Regla 6. Todos los dispositivos médicos invasivos de tipo quirúrgico destinados a
un uso transitorio se incluirán en la clase IIA, salvo que:
a) Sean instrumentos quirúrgicos reutilizables, en cuyo caso, se incluirán en la
clase I;
b) Se destinen a suministrar energía en forma de radiaciones ionizantes, en cuyo
caso, se incluirán en la clase IIB;
c) Se destinen a ejercer un efecto biológico o a ser absorbidos totalmente o en
gran parte, en cuyo caso, se incluirán en la clase IIB;
d) Se destinen a la administración de medicamentos mediante un sistema de
suministro, si ello se efectúa de manera potencialmente peligrosa teniendo en
cuenta el modo de aplicación, en cuyo caso, se incluirán en la clase IIB;
e) Se destinen específicamente a diagnosticar, vigilar o corregir una alteración
cardiaca o del sistema circulatorio central por contacto directo con estas partes del
cuerpo, en cuyo caso, se incluirán en la clase III.
Regla 7. Todos los dispositivos médicos invasivos de tipo quirúrgico destinados a
un uso a corto plazo se incluirán en la clase IIA, salvo que tengan por finalidad:
a) Suministrar energía en forma de radiaciones ionizantes, en cuyo caso, se
incluirán en la clase IIB;
b) Experimentar modificaciones químicas en el organismo, salvo si los productos
se colocan dentro de los dientes, o administrar medicamentos, en cuyo caso, se
incluirán en la clase IIB;
c) Específicamente diagnosticar, vigilar o corregir una alteración cardiaca o del
sistema circulatorio central por contacto directo con estas partes del cuerpo, en
cuyo caso, se incluirán en la clase III;
d) Utilizarse, específicamente, en contacto directo con el sistema nervioso central,
en cuyo caso, se incluirán en la clase III;
e) Ejercer un efecto biológico o ser absorbidos, totalmente o en gran parte, en
cuyo caso, se incluirán en clase III.
Regla 8. Todos los dispositivos médicos implantables y los dispositivos médicos
invasivos de uso prolongado de tipo quirúrgico se incluirán en la clase IIB salvo
que se destinen a:
a) Colocarse dentro de los dientes, en cuyo caso, se incluirán en la clase IIA;
b) Utilizarse en contacto directo con el corazón, el sistema circulatorio central o el
sistema nervioso central, en cuyo caso, se incluirán en la clase III;
c) Ejercer un efecto biológico o ser absorbidos totalmente o en gran parte, en cuyo
caso, se incluirán en la clase III;
d) Sufrir modificaciones químicas en el organismo, salvo si los productos se
colocan dentro de los dientes, o a la administración de medicamentos, en cuyo
caso, se incluirán en la clase III;
Diagrama 2. Reglas de los dispositivos médicos invasivos.
Fuente:https://www.invima.gov.co/images/pdf/tecnovigilancia/ABC%20Dispositivos%20Medicos
%20INVIMA.pdf.
REGLAS ADICIONALES APLICABLES A LOS DISPOSITIVOS MEDICOS
ACTIVOS
Regla 9. Todos los dispositivos médicos terapéuticos activos destinados a
administrar o intercambiar energía se incluirán en la clase IIa, salvo si sus
características son tales que puedan administrar energía al cuerpo humano o
intercambiarla con el mismo, de formapotencialmente peligrosa, teniendo en
cuenta la naturaleza, la densidad y el punto de aplicación de la energía, en cuyo
caso, se incluirán en la clase IIB. Todos los dispositivos médicos activos
destinados a controlar el funcionamiento de los productos terapéuticos activos de
la clase IIb o destinados a influir directamente en el funcionamiento de dichos
productos se incluirán en la clase IIB.
Regla 10. Todos los dispositivos médicos activos con fines de diagnóstico se
incluirán en la clase IIA, siempre que:
a) Se destinen a suministrar energía que vaya a ser absorbida por el cuerpo
humano, caso en el cual, son excluidos los productos cuya función sea la
iluminación del organismo del paciente en el espectro visible;
b) Se destinen a crear una imagen de la distribución in vivo de fármacos
radiactivos; c) Se destinen a permitir un diagnóstico directo o la vigilancia de
procesos fisiológicos vitales, a no ser que se destinen específicamente a la
vigilancia de parámetros fisiológicos vitales, cuando las variaciones de esos
parámetros, por ejemplo, las variaciones en el funcionamiento cardíaco, la
respiración, la actividad del sistema nervioso central, puedan suponer un peligro
inmediato para la vida del paciente, en cuyo caso, se incluirán en la clase IIB;
d) Los dispositivos médicos activos destinados a emitir radiaciones ionizantes y
que se destinen a la radiología con fines diagnósticos y terapéuticos, incluidos los
productos para controlar o vigilar dichos productos, o que influyan directamente en
el funcionamiento de los mismos, se incluirán en la clase IIB.
Regla 11. Todos los dispositivos médicos activos destinados a administrar
medicamentos, líquidos corporales u otras sustancias al organismo, o extraerlos
del mismo, se incluirán en la clase IIA, salvo que ello se efectúe de forma
potencialmente peligrosa, teniendo en cuenta la naturaleza de las sustancias, la
parte del cuerpo de que se trate y el modo de aplicación, en cuyo caso, se
incluirán en la clase IIB.
Regla 12. Todos los demás dispositivos médicos activos se incluirán en la clase I.
Diagrama 3. Reglas adicionales de los dispositivosmédicos activos.
Fuente:https://www.invima.gov.co/images/pdf/tecnovigilancia/ABC%20Dispositivos%20Me
dicos%20INVIMA.pdf.
Diagrama 4. Reglas especiales de los dispositivos médicos.
Fuente:https://www.invima.gov.co/images/pdf/tecnovigilancia/ABC%20Dispositivos%20Me
dicos%20INVIMA.pdf.
CLASIFICACIÓN DE LOS REACTIVOS DE DIAGNÓSTICOS IN-VITRO
La clasificación de los reactivos de diagnóstico in vitro se debe basar en el
riesgosanitario, Categoría III (alto riesgo), Categoría II (mediano riesgo) y
Categoría I(bajo riesgo), teniendo en cuenta el conocimiento, entrenamiento,
tecnología,análisis e impacto del resultado, de acuerdo con lo siguiente:
Tabla 2. Clasificación de los reactivos de diagnósticos In Vitro según su riesgo.
NIVEL DE
CATEGORÍA REACTIVOS IN VITRO INCLUIDOS
RIESGO
1. Usados para el tamizaje de enfermedades
transmisibles en donantes de sangre,
componentes sanguíneos y demás tejidos y
órganos para trasplante.
2. Usados para asegurar compatibilidad
Categoría III Alto inmunológica de sangre y demás tejidos y
órganos para trasplante.
3. Usados para diagnóstico de enfermedades
transmisibles de alto riesgo de peligrosidad
para la vida en la población general
colombiana, incluyendo las pruebas rápidas.
Relacionados con las siguientes áreas:
1. Biología Molecular.
2. Endocrinología.
3. Tóxico-Farmacología.
4. Química sanguínea.
5. Hematología.
6. Inmunología.
Categoría II Mediano 7. Microbiología.
8. Coproparasitología.
9. Coagulación.
10. Gases sanguíneos.
11. Uroanálisis.
12. Células de rastreo de inmunohematología.
13. Pruebas de autodiagnóstico y autocontrol.
1. Medios de cultivo.
2. Componentes de reposición de un estuche.
Categoría I Bajo 3. Materiales colorantes.
4. Soluciones diluyentes, tampones y lisantes.
5. Soluciones de lavado.
Fuente: Elaboración Propia.
Aclaraciones:
La Categoría II incluye todos los reactivos de diagnóstico invitro que no
estén específicamente relacionados en las Categorías I o III.
La Sala Especializada de Insumos para la Salud y ProductosVarios de la
Comisión Revisora, podrá conceptuar sobre los reactivos dediagnóstico in
vitro sujetos a cualquier registro sanitario, teniendo en cuenta lasreglas de
clasificación descritas en el artículo 4º del Decreto 3770/2004 y bajo
lascuales se basa la clasificación descrita.
REGLAS DE CLASIFICACIÓN DE LOS REACTIVOS DE DIAGNÓSTICO IN
VITRO.
Laclasificación de los reactivos diagnóstico in vitro se realizará de acuerdo con
lassiguientes reglas:
CLASIFICACIÓN DE LOS REACTIVOS DE DIAGNÓSTICO IN VITRO
RESPECTO DE LOS AGENTES TRANSMISIBLES
Para la clasificación de los reactivos de diagnóstico in vitro respecto de losagentes
transmisibles se aplicarán las reglas 1 y 2 con las cuales se obtieneinformación
sobre el estado de enfermedad o el estado inmune de individuoscon respecto a
agentes transmisibles.
Estos Reactivos de diagnóstico in vitro seutilizan para diversos propósitos, tales
como tamizaje, diagnóstico o manejo delpaciente. En el contexto del sistema de
clasificación basado en el riesgo, eltérmino "agente transmisible" se refiere a
agentes infecciosos convencionalestales como bacterias, virus, hongos y
protozoos, así como a priones. No incluyerasgos genéticos.
Regla 1: Reactivos de diagnóstico in vitro utilizados para el tamizaje
dedonantes con respecto a agentes transmisibles.
Se clasifican como Categoría III los reactivos de diagnóstico in vitro utilizadospara
detectar la presencia o exposición a un agente transmisible en la
sangre,componentes de la sangre, derivados de la sangre, tejidos u órganos
paradeterminar su seguridad para transfusión o trasplante.
Regla 2: Reactivos de diagnóstico in vitro utilizados para determinar
elestado inmune y el estado y manejo de la enfermedad con respecto
aagentes transmisibles.
Se clasifican como Categoría III:
1. Los reactivos de diagnóstico in vitro para detectar la presencia o laexposición a
un agente transmisible que cause una enfermedad peligrosa parala vida y exista
alto riesgo de propagación en la población colombiana.
2. Los reactivos de diagnóstico in vitro para detectar la presencia o laexposición a
un agente transmisible que cause una enfermedad congénita quesea peligrosa
para la vida de la descendencia del individuo infectado.
CLASIFICACIÓN DE LOS REACTIVOS DE DIAGNÓSTICO IN VITRO
PARA APLICACIONES DIFERENTES A LA DETECCIÓN DE AGENTES
TRANSMISIBLES
Para la clasificación de los reactivos de diagnóstico in vitro utilizados para
ladeterminación de grupos sanguíneos o tipificación de tejidos se aplica la regla 3.
Regla 3:Reactivos de diagnóstico in vitro para tipificación inmunológicaen
transfusiones y trasplantes.
Se clasifican como categoría III los reactivos de diagnóstico in vitro utilizadospara
la tipificación básica (Anti A, Anti B, Anti AB y D) o de tejidos para asegurarla
compatibilidad inmunológica de la sangre, los componentes sanguíneos, lostejidos
u órganos para transfusión o trasplante.
Regla 4: Cuando las reglas del 1 al 3 no se apliquen al reactivo
dediagnóstico In - Vitro este será clasificado como de clase I o II según
elcaso.
Siempre que un kit contenga varios reactivos de diagnóstico in vitro seráclasificado
de acuerdo con el reactivo con más alto riesgo.
BIBLIOGRAFÍA
Decreto 4725 del 26 de diciembre de 2005. “Por el cual se reglamenta
elrégimen de registros sanitarios, permiso de comercializacióny vigilancia
sanitaria de los dispositivos médicos para uso humano.” Ministerio de
protección social de Colombia. [Consultado el 27/04/2019]. Disponible en:
https://www.invima.gov.co/decretos-en-dispositivos-medicos/decreto-4725-
2005-pdf/detail.html
Abc de Dispositivos Médicos. Ministerio de Salud y Protección Social de
Colombia. INVIMA. Bogotá D.C. 2013. [Consultado el 27/04/2019].
Disponible en:
https://www.invima.gov.co/images/pdf/tecnovigilancia/ABC%20Dispositivos
%20Medicos%20INVIMA.pdf
Decreto 3770 del 12 de noviembre de 2004. “Por el cual se reglamentan el
régimen de registros sanitarios y la vigilanciasanitaria de los reactivos de
diagnóstico in Vitro para exámenes de especímenes de origen humano”.
Ministerio de protección social de Colombia. [Consultado el 27/04/2019].
Disponible en:https://www.invima.gov.co/decretos-reactivos-de-diagnostico-
in-vitro.html
Abc de Reactivovigilancia. Ministerio de Salud y Protección Social de
Colombia. INVIMA. Bogotá D.C. 2015. [Consultado el 27/04/2019].
Disponible
en:https://www.invima.gov.co/images/pdf/Prensa/publicaciones/ABC-
Reactivovigilancia.pdf
Das könnte Ihnen auch gefallen
- Decreto 4725 de 2005Dokument4 SeitenDecreto 4725 de 2005Edgar VergaraNoch keine Bewertungen
- 5 - Clasificación de DM - InvimaDokument34 Seiten5 - Clasificación de DM - InvimaJulio CarrilloNoch keine Bewertungen
- Dispositivos MedicosDokument3 SeitenDispositivos Medicoslucero caballero arenasNoch keine Bewertungen
- Taller Dispositivos MedicosDokument2 SeitenTaller Dispositivos MedicosFELIX ARTURO MENDEZ COLORADONoch keine Bewertungen
- Programa de TecnovigilanciaDokument14 SeitenPrograma de Tecnovigilanciamarlen quimbayNoch keine Bewertungen
- Farmacia TallerDokument2 SeitenFarmacia TallerFELIX ARTURO MENDEZ COLORADONoch keine Bewertungen
- Regulación de dispositivos médicos en ColombiaDokument22 SeitenRegulación de dispositivos médicos en ColombiaESNEIDER ANTONIO MENDEZ OSORIO67% (3)
- Protocolo de TecnovigilanciaDokument14 SeitenProtocolo de Tecnovigilanciadauc0% (1)
- ¿Qué Son Los Dispositivos Médicos?: EjemplosDokument1 Seite¿Qué Son Los Dispositivos Médicos?: Ejemplosapi-560164281Noch keine Bewertungen
- Conferencia Clasificacion DM PeruDokument28 SeitenConferencia Clasificacion DM PeruBren Lioncourt100% (1)
- Equipos BiomedicosDokument1 SeiteEquipos Biomedicosbrigithe grimaldosNoch keine Bewertungen
- Clasificacion de Dispositivos MedicosDokument1 SeiteClasificacion de Dispositivos Medicosapi-447863630Noch keine Bewertungen
- Decreto 4725 Del 2005 - Mapa ConceltualDokument4 SeitenDecreto 4725 Del 2005 - Mapa Conceltualapi-52189354150% (2)
- Bpm equipos médicos InvimaDokument11 SeitenBpm equipos médicos InvimaAlejo RoseroNoch keine Bewertungen
- Clasificacion de Los Equipos Por Riesgo Según InvimaDokument29 SeitenClasificacion de Los Equipos Por Riesgo Según InvimaDianaPaolaPeñuelaNoch keine Bewertungen
- Vigilancia de dispositivos médicosDokument19 SeitenVigilancia de dispositivos médicosWilson EstradaNoch keine Bewertungen
- Clasificación de equipos biomédicos y dispositivos médicosDokument5 SeitenClasificación de equipos biomédicos y dispositivos médicosDaniser CuestaNoch keine Bewertungen
- Dispositivos MedicosDokument8 SeitenDispositivos Medicosjuan maciasNoch keine Bewertungen
- Clasificacion de Riesgo de Dispositivos MedicosDokument3 SeitenClasificacion de Riesgo de Dispositivos Medicosmaylee smith sandoval100% (1)
- Ucsm - Segunda Especialidad. Dispositivos Medicos Ene - 2018 - Parte 1 (1) Doctor ManriqueDokument48 SeitenUcsm - Segunda Especialidad. Dispositivos Medicos Ene - 2018 - Parte 1 (1) Doctor Manriquemariela maldonado escobedoNoch keine Bewertungen
- Decreto 4725 InfografiaDokument2 SeitenDecreto 4725 Infografiaapi-560105949Noch keine Bewertungen
- Clasificacion Dispositivos MedicosDokument4 SeitenClasificacion Dispositivos MedicosYolyNoch keine Bewertungen
- Mapa Conceltual - Decreto 4725 Del 2005Dokument4 SeitenMapa Conceltual - Decreto 4725 Del 2005Yeison HernandezNoch keine Bewertungen
- Dispositivos MedicosDokument2 SeitenDispositivos Medicosapi-394187731Noch keine Bewertungen
- Mapa Conceptual de DispositivosDokument2 SeitenMapa Conceptual de Dispositivosapi-500268209Noch keine Bewertungen
- Dispositivos MedicosDokument8 SeitenDispositivos Medicosjannia guerreroNoch keine Bewertungen
- Tutoria 4Dokument22 SeitenTutoria 4GABRIELA BARRIOS DIAZNoch keine Bewertungen
- Ingeniería Clínica - DISPOSITIVOS MÉDICOS-2022Dokument16 SeitenIngeniería Clínica - DISPOSITIVOS MÉDICOS-2022Andres DuarteNoch keine Bewertungen
- Mapa Conceltual - Decreto 4725 Del 2005Dokument4 SeitenMapa Conceltual - Decreto 4725 Del 2005api-521894902Noch keine Bewertungen
- Apendice II SDM FEUM 4a Ed - 180126Dokument18 SeitenApendice II SDM FEUM 4a Ed - 180126Anonymous HUY0yRexYf100% (1)
- Queesinstrumentacionbiomedica 150125230415 Conversion Gate02Dokument27 SeitenQueesinstrumentacionbiomedica 150125230415 Conversion Gate02Mauriant BriceñoNoch keine Bewertungen
- Dispositivos Medicos PDFDokument16 SeitenDispositivos Medicos PDFYenny LuNoch keine Bewertungen
- Clasificación de Riesgo Equipos BiomedicosDokument3 SeitenClasificación de Riesgo Equipos BiomedicosMiguel Angel RodríguezNoch keine Bewertungen
- CLASE LLLDokument2 SeitenCLASE LLLmaylee smith sandovalNoch keine Bewertungen
- Riesgos biomédicosDokument22 SeitenRiesgos biomédicosedin pereaNoch keine Bewertungen
- Mapa Conceptual dm2Dokument2 SeitenMapa Conceptual dm2api-522798819Noch keine Bewertungen
- 072 Apendice II - VF 180413 MARCA DE AGUADokument18 Seiten072 Apendice II - VF 180413 MARCA DE AGUAFabiola OlivaresNoch keine Bewertungen
- Manual de Gestion de InsumosDokument17 SeitenManual de Gestion de InsumosZully RiascosNoch keine Bewertungen
- Clasificación de riesgo DMDokument21 SeitenClasificación de riesgo DMAlejandra Ramirez SanchezNoch keine Bewertungen
- TecnovigilanciaDokument18 SeitenTecnovigilanciaLibertad lamarqueNoch keine Bewertungen
- Dispositivos MedicosDokument42 SeitenDispositivos MedicosMaría Amparo Delgado BurbanoNoch keine Bewertungen
- Dispositivos médicos: definiciones y clasificaciónDokument3 SeitenDispositivos médicos: definiciones y clasificaciónLUIS JUNIOR NUÑEZ SORIANONoch keine Bewertungen
- IESS - Seminario de TecnovigilanciaDokument42 SeitenIESS - Seminario de Tecnovigilanciaboris betancourtNoch keine Bewertungen
- Qué Son Los Dispositivos Médicos CONSULTADokument10 SeitenQué Son Los Dispositivos Médicos CONSULTAYeni CortezNoch keine Bewertungen
- Dispositivos MedicosDokument2 SeitenDispositivos Medicosapi-502779391Noch keine Bewertungen
- Clasificación Según El Riesgo de Los Dispositivos MédicosDokument17 SeitenClasificación Según El Riesgo de Los Dispositivos MédicosAngie VergaraNoch keine Bewertungen
- Tecnovigilancia 2021Dokument27 SeitenTecnovigilancia 2021Lina CordobaNoch keine Bewertungen
- Ley PF, DM, PSDokument64 SeitenLey PF, DM, PSketiNoch keine Bewertungen
- Decreto 4725 de 2005Dokument1 SeiteDecreto 4725 de 2005api-502020150Noch keine Bewertungen
- TecnovigilanciaDMDokument26 SeitenTecnovigilanciaDMRicardo Robles100% (1)
- Ra & Medical DeviceDokument46 SeitenRa & Medical Devicelaura ChicchonNoch keine Bewertungen
- Dispositivos Medicos AfmmDokument1 SeiteDispositivos Medicos Afmmapi-47253785750% (4)
- Decreto 4725Dokument2 SeitenDecreto 4725api-394129962Noch keine Bewertungen
- 6criterios Clasif Riesgosan DM 251108Dokument11 Seiten6criterios Clasif Riesgosan DM 251108Carmen Rosa Amau QuispeNoch keine Bewertungen
- Manual Uso y ReusoDokument6 SeitenManual Uso y ReusoJuan David Naranjo SanchezNoch keine Bewertungen
- Sesion 4 TecnovigilanciaDokument21 SeitenSesion 4 TecnovigilanciaFIORELA SARAHI SALHUANA JUAN DE DIOS100% (1)
- Dispositivos MedicosDokument31 SeitenDispositivos MedicosBetsyNoch keine Bewertungen
- Módulo 3. MDR e IVDRDokument59 SeitenMódulo 3. MDR e IVDRpapucicuNoch keine Bewertungen
- Identificación de los productos y medios empleados para el control de plagas. SEAG0110Von EverandIdentificación de los productos y medios empleados para el control de plagas. SEAG0110Noch keine Bewertungen
- Ciencia regulatoria: Medicamentos bio y su relevancia para la saludVon EverandCiencia regulatoria: Medicamentos bio y su relevancia para la saludNoch keine Bewertungen
- Introduccion ControlDokument2 SeitenIntroduccion ControlElizabeth Ortega ClavijoNoch keine Bewertungen
- Diseño de ProyectoDokument15 SeitenDiseño de ProyectoElizabeth Ortega ClavijoNoch keine Bewertungen
- Guia 6 Admo Parte de Will y Mi Parte CompletaDokument20 SeitenGuia 6 Admo Parte de Will y Mi Parte CompletaElizabeth Ortega ClavijoNoch keine Bewertungen
- Uniformidad de Dosificacion IBUPROFENO TERMINADODokument8 SeitenUniformidad de Dosificacion IBUPROFENO TERMINADODeinir SolanoNoch keine Bewertungen
- Informe de Valoracion y Uniformidad de Acetaminofen (2) 2Dokument8 SeitenInforme de Valoracion y Uniformidad de Acetaminofen (2) 2Elizabeth Ortega ClavijoNoch keine Bewertungen
- Caso Clínico Final (2) FinaalDokument15 SeitenCaso Clínico Final (2) FinaalElizabeth Ortega ClavijoNoch keine Bewertungen
- Page0007 PDFDokument1 SeitePage0007 PDFBeimar Miguel CeronNoch keine Bewertungen
- CURVA DE CALIBRACION CON ESTANDAR DE ACETAMINOFEN POR ESPECTROFOTOMETRIA UV Incompleto CON GRAFICADokument6 SeitenCURVA DE CALIBRACION CON ESTANDAR DE ACETAMINOFEN POR ESPECTROFOTOMETRIA UV Incompleto CON GRAFICAElizabeth Ortega ClavijoNoch keine Bewertungen
- Las Innovaciones en Cuestiones Gramaticales Del Diccionario Manual e Ilustrado de La Lengua Espaola de La Rae 0Dokument8 SeitenLas Innovaciones en Cuestiones Gramaticales Del Diccionario Manual e Ilustrado de La Lengua Espaola de La Rae 0LoboslasendaNoch keine Bewertungen
- Diccionario de BiologiaDokument32 SeitenDiccionario de BiologiaJosé Antonio Rivero GómezNoch keine Bewertungen
- Programa de CalibraciónDokument1 SeitePrograma de CalibraciónBENJAMÍN CHRISTIAN VALDEZ PAREJANoch keine Bewertungen
- Almacenamiento y Acondicionamiento de DM TerminadoDokument17 SeitenAlmacenamiento y Acondicionamiento de DM TerminadoElizabeth Ortega Clavijo0% (1)
- Ejemplos de MitosDokument1 SeiteEjemplos de MitosElizabeth Ortega ClavijoNoch keine Bewertungen
- Procesos y Métodos de Control en La EsterilizaciónDokument13 SeitenProcesos y Métodos de Control en La EsterilizaciónElizabeth Ortega ClavijoNoch keine Bewertungen
- Tecnovigia #13Dokument17 SeitenTecnovigia #13Elizabeth Ortega ClavijoNoch keine Bewertungen
- Envejecimiento cutáneo: causas, tipos e implicaciones clínicasDokument10 SeitenEnvejecimiento cutáneo: causas, tipos e implicaciones clínicasElizabeth Ortega ClavijoNoch keine Bewertungen
- EsterilizacionDokument6 SeitenEsterilizacionElizabeth Ortega ClavijoNoch keine Bewertungen
- Mision y ObjetivoDokument1 SeiteMision y ObjetivoElizabeth Ortega ClavijoNoch keine Bewertungen
- Eco SistemaDokument1 SeiteEco SistemaElizabeth Ortega ClavijoNoch keine Bewertungen
- Educación GuatemalaDokument10 SeitenEducación GuatemalaSantos Palencia100% (1)
- Caquexia OncologicaDokument6 SeitenCaquexia OncologicaLorenzo GiggsNoch keine Bewertungen
- Trabajo Investigacion AutismoDokument12 SeitenTrabajo Investigacion AutismoJose FariasNoch keine Bewertungen
- Cuestionario para Proveedores2022Dokument2 SeitenCuestionario para Proveedores2022Darwin Victor Rivera LLacsahuangaNoch keine Bewertungen
- Directorioreconocidos3ertrimestre19 PDFDokument9 SeitenDirectorioreconocidos3ertrimestre19 PDFAlejandro PalaciosNoch keine Bewertungen
- Guia PaiDokument3 SeitenGuia PaiAsh keptchupNoch keine Bewertungen
- El Servicio de Tutoria en Educacion Inicial Parte 1Dokument16 SeitenEl Servicio de Tutoria en Educacion Inicial Parte 1Juana Elisa Dioses Rizzi75% (4)
- Bacterias Benéficas en Animales 2Dokument27 SeitenBacterias Benéficas en Animales 2JuanGarcíaMedina50% (2)
- Tecnica de CervicometriaDokument8 SeitenTecnica de Cervicometrialuis navarreteNoch keine Bewertungen
- Clase 2 - 24 Sep. 13 - TGP PDFDokument17 SeitenClase 2 - 24 Sep. 13 - TGP PDFAndreass TrejoNoch keine Bewertungen
- Signos radiológicos de patologías pulmonaresDokument14 SeitenSignos radiológicos de patologías pulmonaresEmmanuel HernándezNoch keine Bewertungen
- Cistitis Hemorragica Lorenzo IgnacioDokument37 SeitenCistitis Hemorragica Lorenzo IgnacioYinno CustodioNoch keine Bewertungen
- I Examen Parcial Anatomia ResueltoDokument8 SeitenI Examen Parcial Anatomia Resueltotyrone_orozco100% (1)
- Funciones Enfermería RehabilitaciónDokument7 SeitenFunciones Enfermería RehabilitaciónSandii Ymin100% (1)
- Contaminacion Odorifera en MexicaliDokument20 SeitenContaminacion Odorifera en MexicaliErick VegaNoch keine Bewertungen
- Resumen - Proceso de Enfermería Paso A PasoDokument13 SeitenResumen - Proceso de Enfermería Paso A PasoLuis eduardo Vasquez rodriguezNoch keine Bewertungen
- Plan de Preparacion y Respuesta Ante Emergencias VialesDokument8 SeitenPlan de Preparacion y Respuesta Ante Emergencias VialesJuanNoch keine Bewertungen
- TP4 - Situación ProblemáticaDokument2 SeitenTP4 - Situación ProblemáticaVictorNoch keine Bewertungen
- Materiales PeligrososDokument57 SeitenMateriales PeligrososMarco Cuzco TejedaNoch keine Bewertungen
- Interfase HematogaseosaDokument4 SeitenInterfase HematogaseosaLaura Giménez100% (1)
- Las BacteriasDokument26 SeitenLas BacteriasOmilva RamirezNoch keine Bewertungen
- La NutriciónDokument6 SeitenLa NutriciónElizabeth CordovaNoch keine Bewertungen
- Jorge Gonzales - Tarea8Dokument9 SeitenJorge Gonzales - Tarea8víctor100% (3)
- McKay - 2017 - Manual Práctico de Terapia Dialéctico ConductualDokument344 SeitenMcKay - 2017 - Manual Práctico de Terapia Dialéctico ConductualBeeTcH0100% (6)
- EsterilizacionDokument24 SeitenEsterilizacionNicolasmoravasquezNoch keine Bewertungen
- Plan COVID-19 obras construcciónDokument46 SeitenPlan COVID-19 obras construcciónjoseph garciaNoch keine Bewertungen
- Los Costes de La Violencia Contra La InfanciaDokument48 SeitenLos Costes de La Violencia Contra La InfanciaMarvin FloresNoch keine Bewertungen
- Paso 4-ColaborativoDokument13 SeitenPaso 4-Colaborativobexy alvarezNoch keine Bewertungen
- Semana 29 2do Reflexionamos Sobre La Importancia de Cuidar Nuestra Salud PDFDokument14 SeitenSemana 29 2do Reflexionamos Sobre La Importancia de Cuidar Nuestra Salud PDFSoberon Guevara FlorNoch keine Bewertungen
- Mecanismo de La InflamaciónDokument6 SeitenMecanismo de La InflamaciónROSA PORTERO RODRIGUEZNoch keine Bewertungen