Beruflich Dokumente
Kultur Dokumente
Analisis
Hochgeladen von
Tacasayita0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
34 Ansichten5 SeitenEl documento describe las propiedades y reacciones químicas del cobalto y el níquel. El cobalto es un metal gris que se disuelve lentamente en ácidos diluidos calientes, formando compuestos cobaltosos. Las principales reacciones del ion cobaltoso incluyen la formación de precipitados de varios colores con reactivos como sulfuro de amonio, cianuro de potasio y tiocianato de amonio. El níquel es un metal blanco plateado que se disuelve en ácido nítrico diluido. Las principales reacciones
Originalbeschreibung:
Analisis de los minerales
Originaltitel
analisis[1]
Copyright
© © All Rights Reserved
Verfügbare Formate
DOCX, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenEl documento describe las propiedades y reacciones químicas del cobalto y el níquel. El cobalto es un metal gris que se disuelve lentamente en ácidos diluidos calientes, formando compuestos cobaltosos. Las principales reacciones del ion cobaltoso incluyen la formación de precipitados de varios colores con reactivos como sulfuro de amonio, cianuro de potasio y tiocianato de amonio. El níquel es un metal blanco plateado que se disuelve en ácido nítrico diluido. Las principales reacciones
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
34 Ansichten5 SeitenAnalisis
Hochgeladen von
TacasayitaEl documento describe las propiedades y reacciones químicas del cobalto y el níquel. El cobalto es un metal gris que se disuelve lentamente en ácidos diluidos calientes, formando compuestos cobaltosos. Las principales reacciones del ion cobaltoso incluyen la formación de precipitados de varios colores con reactivos como sulfuro de amonio, cianuro de potasio y tiocianato de amonio. El níquel es un metal blanco plateado que se disuelve en ácido nítrico diluido. Las principales reacciones
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 5
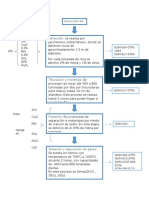
COBALTO Co
El cobalto es un metal magnético de color gris acerado. Se disuelve lentamente en ácido
sulfúrico o clorhídrico diluido en caliente y más rápidamente en ácido nitrico, formando
compuestos cobaltosos que provienen del óxido cobaltoso
REACCIONES DEL ION COBALTOSO Co:
1: Solución de hidroxhido de sodio: El hidróxido cobaltoso es fácilmente soluble en
soluciones concentradas de sales de amonio debido ala formación de sales complejas; por
tal motivo las soluciones de hidróxidos alcalinos no precipitan el hidróxido cobaltoso de
una solución amoniacal de sales de cobalto
2: Solución de hidróxido de amonio: Se obtiene un precipitado azul de sal básica como en
la reacción 1 . La solución amoniacal amarillo pardusca se transforma en roja por
exposición al aire y más rápidamente agregando peróxido de hidrógeno
3: Solucion de sulfuro de amonio: Se produce un precipitado negro de sulfuro de cobalto
CoS, en soluciones neutras o alcalinas, insoluble en exceso de reactivo, en ácido acético y
en ácido clorhídrico
4: Solución de cianuro de potasio: Se obtiene un precipitado pardo rojizo de cianuro
cobaltoso Co(CN)3 Soluble en exceso de reactivo para formar una solución parda que
contiene cobalto cianuro de potasio
5: Solución de nitrico de potasio: Cuando se agrega un exceso a una solución concentrada
de un sal de cobalto acidificada con ácido acético de un precipitado amarillo de cobalto
nítrico de potasio
6: Solución de tiocianato de amonio: Se produce una solución azul debido al ion
cobaltotiocianuro |Co(CNS)4| por agregado de una solución concentrada de NH4 CNS. Es
mejor agregar algunos cristales de la sal sólida a la solución en análisis. Si se agrega
alcohol amílico y la solución se agrita el color azul pasa a la capa alcohólica
7: Reactivo nitroso naftol:
Se produce un precipitado pardo rojizo de cobalto nitroso. El reactivo se prepara
disolviendo 1g de x-nitroso-B- nafton de agua.
8: Reactivo ácido rubeanico ( o ditio-oxamida ): en condiciones similares las sales de
níquel y cobre dan precipitaciones azul y negro respectivamente .Grandes cantidades
cantidades de sales de amonio reducen la sensibilidad.
Se coloca una gota de la solución en análisis sobre un papel de reacciones a la gota se lo
somete a los vapores de amoniaco y luego se agrega una gota de reactivo.
Ensayo por vía seca:
Todos los compuestos de cobalto calcinados sobre carbón con carbonato de sodio producen
perlas de cobalto grises de apariencia ligeramente metálica.
NIQUEL Ni
El níquel es un metal duro, blanco plateado; es dúctil, maleable y muy tenaz. Los ácidos
clorhídrico o sulfúrico diluidos o concentrados lo atacan lentamente; el ácido nítrico diluido
lo disuelve fácilmente; pero si es concentrado motiva su pasividad
REACCIONES DEL ION NIQUEL Ni:
1: Solución de hidróxido de sodio: Sé produce un precipitado verde de hidróxido
níqueloso Ni (OH)2. Insoluble en solución en exceso de reactivo. El precipitado se disuelve
en soluciones de hidróxido de amonio o en soluciones de sales de armonio formando
soluciones azul verdoso de iones complejos níquelosos amoniacales.
2: Solución de hidróxido de amonio: Se forma un precipitado verde de sal básica, Soluble
en exceso de reactivo formando compuestos complejos amoniacales de níquel
3: Solucion de sulfuro de amonio: En soluciones neutras se forma un precipitado negro de
sulfuro de níquel, NiS, escasamente Soluble en exceso de reactivo formando una solución
coloidal pardo obscura que pasa a través del papel de filtro. La presencia de una gran
cantidad de cloruro de amonio impide la formación de sol. El sulfuro de níquel es
prácticamente insoluble en ácido clorhídrico diluido frío de = 1,02
4: Sulfuro de hidrogeno: En solución neutra, el níquel precipita parcial y lentamente como
sulfuro de níquel ; no se produce precipitación en soluciones que contiene ácidos minerales
o mucho ácido Acético. Sin embargo, se produce una precipitación total en soluciones
alcalizadas con solución de hidróxido de amonio o en las que contiene un exceso de
acetado alcalino débilmente aciduladas con ácido acético
5: Solución de cianuro de potasio: se forma un precipitado verde de cianuro niqueloso .
Fácilmente soluble en exceso de reactivo formando la sal compleja niquelo cianuro de
potasio. Si esta solución se calienta con solución de hipodromito de sodio. El cianuro
complejo se descompone y se forma un precipitado negro o pardo
6: Solución de nítrico de potasio: No se produce precipitado en presencia de ácido acético
(diferencia con el cobalto)
7: Reactivo nitroso naftol: Se obtiene un precipitado pardo .Soluble en ácido clorhídrico
diluido (diferencia con el cobalto que da un precipitado pardo rojizo insoluble en ácido
clorhídrico diluido).
8: Reactivo dimetilglioxima: Se obtiene un precipitado rojo de níquel dimetilglioxima en
soluciones débilmente alcalizadas con solución de hidróxido de amonio o que contienen
acetato de sodio la precipitación se acelera por ebullición en soluciones diluida
9: Reactivo di furilglioxima:
En soluciones ligeramente amoniacal se forma un precipitado rojo se ponen algunas gotas
de solución en análisis ligeramente amoniacal en un micro tubo de ensayo y se agrega
algunas gotas del reactivo. Se forma una coloración o precipitado rojo.
En presencia de un tartrato en solución amoniacal la reacción no es afectada por plata,
cobre, hierro férrico, cromo o aluminio si hay cinc, debe agregarse cloruro de amonio; el
ion cobalto disminuye la sensibilidad y debe oxidarse con peroxidado de hidrogeno al
estado cobaltico el hierro ferroso interfiere, se debe oxidar y agregar solución de tartrato
alcalino antes de efectuar la reacción.
El reactivo es una solución de di furilglioxima al 10% en alcohol.
10: Reactivo ácido rubeanico: En soluciones amoniacales se produce un precipitado o
coloración azul o violeta interfieren en la reacción por lo que deben estar ausentes las sales
de cobre , cobalto y hierro.
Das könnte Ihnen auch gefallen
- El Manual Del Jabón Líquido Hecho a Mano: Guía completa para Crear Champú, Gel de Ducha, Perfumes y Mucho MásVon EverandEl Manual Del Jabón Líquido Hecho a Mano: Guía completa para Crear Champú, Gel de Ducha, Perfumes y Mucho MásNoch keine Bewertungen
- Identificacion de Iones y RadicalesDokument3 SeitenIdentificacion de Iones y RadicalesBeto RiveraNoch keine Bewertungen
- Primer Grupo de AnionesDokument10 SeitenPrimer Grupo de AnionesJohana Osorio QuispeNoch keine Bewertungen
- Cationes Del Primer Grupo AnalíticoDokument6 SeitenCationes Del Primer Grupo AnalíticoGZ OliverNoch keine Bewertungen
- Procedimento y ReaccionesDokument7 SeitenProcedimento y ReaccionesBraine BorgesNoch keine Bewertungen
- Práctica 5Dokument5 SeitenPráctica 5mariana contrerasNoch keine Bewertungen
- SEGUNDO GRUPO DE CATIONES CompletoDokument19 SeitenSEGUNDO GRUPO DE CATIONES CompletoaixalilenNoch keine Bewertungen
- Marco Teorico PlataDokument5 SeitenMarco Teorico PlataDuverly ChavezNoch keine Bewertungen
- Reacción de FelhingDokument3 SeitenReacción de FelhingDiana NavaNoch keine Bewertungen
- 3er Informe Analisis QuimicoDokument5 Seiten3er Informe Analisis QuimicoJean Claude Arenales ÑaupariNoch keine Bewertungen
- Analisis Directo de AnionesDokument41 SeitenAnalisis Directo de AnionesYhordannoQuirozNoch keine Bewertungen
- Práctica 1 Detección de Grupos FuncionalesDokument11 SeitenPráctica 1 Detección de Grupos FuncionalesRosangela PeraltaNoch keine Bewertungen
- 4º Laboratorio de Análisis Químico 05Dokument26 Seiten4º Laboratorio de Análisis Químico 05saulNoch keine Bewertungen
- Trabajo de AnionesDokument20 SeitenTrabajo de AnionesJefer AcuñaNoch keine Bewertungen
- Aporte Punto 1y2 Examen FinalDokument9 SeitenAporte Punto 1y2 Examen FinalEdwin López GutierrezNoch keine Bewertungen
- GUID - 9 es-ESDokument6 SeitenGUID - 9 es-ESSilvia Lucia Daza PachecoNoch keine Bewertungen
- Discusión Catión CobaltoDokument2 SeitenDiscusión Catión CobaltoEfraínNoch keine Bewertungen
- Informe 4 AQDokument14 SeitenInforme 4 AQBraysson J. GuevaraNoch keine Bewertungen
- Analisis 3Dokument22 SeitenAnalisis 3alonso5696Noch keine Bewertungen
- INFORME GRUPO 4 y 5 Parte 2Dokument9 SeitenINFORME GRUPO 4 y 5 Parte 2Camila Arisleidys QuezadaNoch keine Bewertungen
- Práctica 4 - Reactividad Del Grupo Carbonilo Reacción de CanizarroDokument20 SeitenPráctica 4 - Reactividad Del Grupo Carbonilo Reacción de CanizarroMittzii GodinezNoch keine Bewertungen
- Reactivo de FehlingDokument8 SeitenReactivo de FehlingEdith HSNoch keine Bewertungen
- Clasificacion de Los CationesDokument10 SeitenClasificacion de Los CationesBilly CordovaNoch keine Bewertungen
- Lab de Organica de Aldehidos y Cetonas CuestionarioDokument1 SeiteLab de Organica de Aldehidos y Cetonas CuestionarioSilvia Lucia Daza PachecoNoch keine Bewertungen
- ReactionsDokument3 SeitenReactionsDavid MéndezNoch keine Bewertungen
- Cationes Grupo IIDokument10 SeitenCationes Grupo IIEfraínNoch keine Bewertungen
- Black and White ReactionDokument3 SeitenBlack and White Reactiongriss1234567Noch keine Bewertungen
- Primer Grupo de Cationes Versin 2 161102184804Dokument40 SeitenPrimer Grupo de Cationes Versin 2 161102184804Luis Antonio ZambranoNoch keine Bewertungen
- Analisis de Identificacion de AnionesDokument9 SeitenAnalisis de Identificacion de AnionesYoel Barzola SierraltaNoch keine Bewertungen
- Informe de Laboratorio N.7Dokument11 SeitenInforme de Laboratorio N.7Tania PinargoteNoch keine Bewertungen
- Grupo Del ArsénicoDokument29 SeitenGrupo Del ArsénicoMartin Chafloque BarriosNoch keine Bewertungen
- Aldehídos y Cetonas (Ensayos)Dokument9 SeitenAldehídos y Cetonas (Ensayos)Alan Lionel CastielloNoch keine Bewertungen
- Marcha Analitica Grupo I Aniones N°5Dokument12 SeitenMarcha Analitica Grupo I Aniones N°5Jorge Armando Carlos Sixto100% (1)
- Marcha CationesDokument21 SeitenMarcha CationesAdriana BermudezNoch keine Bewertungen
- Discusión CalcioDokument2 SeitenDiscusión CalcioEfraínNoch keine Bewertungen
- Cadmio Analisis QuimicoDokument5 SeitenCadmio Analisis QuimicoMartin Chafloque BarriosNoch keine Bewertungen
- Q.A. - Clase 07 - A. Q. de AnionesDokument22 SeitenQ.A. - Clase 07 - A. Q. de AnionesNelson ArcosNoch keine Bewertungen
- Identificación de AnionesDokument6 SeitenIdentificación de AnionesDiegohool VásquezNoch keine Bewertungen
- Copulacion de Sales de DiazonioDokument6 SeitenCopulacion de Sales de Diazonio.:("*"BLacK BuLLeT"*"):.92% (13)
- Discusion Iones MetalicosDokument3 SeitenDiscusion Iones MetalicosOldemar GarciaNoch keine Bewertungen
- Anaranjado de MetiloDokument4 SeitenAnaranjado de MetiloAurelio LeonNoch keine Bewertungen
- Cetonas y Aldehidos ConclDokument3 SeitenCetonas y Aldehidos ConclRubén Rodríguez GonzálezNoch keine Bewertungen
- AntimonioDokument35 SeitenAntimonioJang Fernando Dong WooNoch keine Bewertungen
- Practica 5Dokument2 SeitenPractica 5Erick GiovaniNoch keine Bewertungen
- DIAZOTACIONDokument8 SeitenDIAZOTACIONAlexis VelaNoch keine Bewertungen
- Química Inorgánica Practico #8Dokument4 SeitenQuímica Inorgánica Practico #8Maruja Del Pópolo GrzonaNoch keine Bewertungen
- Tarea #1. Identificacion de Grupos FuncionalesDokument8 SeitenTarea #1. Identificacion de Grupos FuncionalesDeivis GutierrezNoch keine Bewertungen
- Oxidación Con PeriodatoDokument5 SeitenOxidación Con PeriodatoCynthia Karina Hernández RodríguezNoch keine Bewertungen
- Antimonio Informacion CompletaDokument22 SeitenAntimonio Informacion CompletaJang Fernando Dong WooNoch keine Bewertungen
- Marcha Analitica Grupo II Aniones N°6Dokument15 SeitenMarcha Analitica Grupo II Aniones N°6Jorge Armando Carlos Sixto100% (1)
- Informe 2 Cationes y AnionesDokument8 SeitenInforme 2 Cationes y AnionescatalinacoNoch keine Bewertungen
- Tabla de Reacciones ComparativasDokument13 SeitenTabla de Reacciones ComparativasGiovanni GuzmanNoch keine Bewertungen
- Preguntas Lab 7Dokument3 SeitenPreguntas Lab 7Juan David Cruz LopezNoch keine Bewertungen
- Reacciones de Los Carbonatos CO3Dokument6 SeitenReacciones de Los Carbonatos CO3guadalupefernanda2020Noch keine Bewertungen
- Labo 4 TerminadoDokument22 SeitenLabo 4 TerminadoMilagros BacaNoch keine Bewertungen
- Pregunta 1Dokument2 SeitenPregunta 1Gabriela CondoriNoch keine Bewertungen
- Determinacion de Cloro Activo en LavandinaDokument9 SeitenDeterminacion de Cloro Activo en LavandinaMario Ramiro Humerez Diaz100% (1)
- 4to Informe de Laboratorio de Química Inorgánica (UNMSM)Dokument19 Seiten4to Informe de Laboratorio de Química Inorgánica (UNMSM)Fernando Sánchez100% (1)
- Taller 9° Nomenclatura 2023Dokument2 SeitenTaller 9° Nomenclatura 2023mariana diaz charryNoch keine Bewertungen
- Tabla AceroDokument1 SeiteTabla AceroAdrián Jofré ÁlvarezNoch keine Bewertungen
- Extraccion Zinc y CupritaDokument5 SeitenExtraccion Zinc y Cupritacoreano63Noch keine Bewertungen
- EJERCICIOSDokument9 SeitenEJERCICIOSluisdapinzon100% (1)
- Aritmetica - Analisis de Los Numeos y Sus AplicacionesDokument36 SeitenAritmetica - Analisis de Los Numeos y Sus AplicacionesJosue Arroyo100% (1)
- 6872 PDFDokument143 Seiten6872 PDFRolando Hurtado ChungaNoch keine Bewertungen
- Práctica 1 ElectrometalurgiaDokument6 SeitenPráctica 1 ElectrometalurgiaJonathan BautistaNoch keine Bewertungen
- Aleaciones Ferrosas y No Ferrosas - Tratamientos TermicosDokument5 SeitenAleaciones Ferrosas y No Ferrosas - Tratamientos TermicosRayder CavanillasNoch keine Bewertungen
- Ensayo Por Vía SecaDokument16 SeitenEnsayo Por Vía Secafrank100% (1)
- ArenaDokument2 SeitenArenaLesly LeyvaNoch keine Bewertungen
- Colegio Integrado Santa TeresitaDokument2 SeitenColegio Integrado Santa TeresitacolisanteNoch keine Bewertungen
- Proceso Constructivo de LosasDokument4 SeitenProceso Constructivo de LosasKathleen JamesNoch keine Bewertungen
- Tecnologia de Beneficio en MineriaDokument20 SeitenTecnologia de Beneficio en MineriaSamir Vilca NavarroNoch keine Bewertungen
- Unidad 1 Teoría Atómico-Molecular Ejercicios PropuestosDokument7 SeitenUnidad 1 Teoría Atómico-Molecular Ejercicios PropuestossilviagarciasepulvedNoch keine Bewertungen
- Azúcares Reductores - Análisis de AlimentosDokument3 SeitenAzúcares Reductores - Análisis de AlimentosNoel MoriNoch keine Bewertungen
- Cemento ANEXOSDokument5 SeitenCemento ANEXOSAlex ClarosNoch keine Bewertungen
- Curso Básico de Tecnología Del Concreto ANA - TORREDokument131 SeitenCurso Básico de Tecnología Del Concreto ANA - TORREDanny ReynaNoch keine Bewertungen
- Tema ReservasDokument48 SeitenTema ReservasDavid GrandaNoch keine Bewertungen
- Dureza Del AguaDokument2 SeitenDureza Del AguaJuMolCaNoch keine Bewertungen
- Franja Sedimentaria Mesozoica de La Cordillera OcidentalDokument9 SeitenFranja Sedimentaria Mesozoica de La Cordillera OcidentalVanne Azañero Vargas0% (1)
- Tema 6 Procesos de Formacion de Depositos MineralesDokument19 SeitenTema 6 Procesos de Formacion de Depositos MineralespablomilanezNoch keine Bewertungen
- NomenclaturaDokument52 SeitenNomenclaturaAmilcar Alonzo0% (1)
- 105 Ejemplos de Formulacion Inorganica BINARIOSDokument6 Seiten105 Ejemplos de Formulacion Inorganica BINARIOSAdriana AragortNoch keine Bewertungen
- Alteración Hidrotermal Asociada A Yacimientos Tipo Pórfido Cuprífero y Epitermales de AuDokument5 SeitenAlteración Hidrotermal Asociada A Yacimientos Tipo Pórfido Cuprífero y Epitermales de AuMarcos JaureguiNoch keine Bewertungen
- Ventajas de Los Termometros BimetalicosDokument18 SeitenVentajas de Los Termometros BimetalicosRoyder Santos Luera DominguezNoch keine Bewertungen
- Discontinuidades en El Metal Base y de La Soldadura FinalDokument8 SeitenDiscontinuidades en El Metal Base y de La Soldadura FinalFrank Merello PortocarreroNoch keine Bewertungen
- Mineralogia en Ingles 2Dokument8 SeitenMineralogia en Ingles 2castorcitayuniNoch keine Bewertungen
- Terminologia IngenierilDokument6 SeitenTerminologia IngenierilErickChávezNoch keine Bewertungen
- Sistema Combinado Con LosaceroDokument22 SeitenSistema Combinado Con LosaceroAbigail AlejandraNoch keine Bewertungen
- Proyecto SubterraneoDokument41 SeitenProyecto SubterraneoVictor Bravo Mamani100% (2)