Beruflich Dokumente
Kultur Dokumente
Modelos Atomicos
Hochgeladen von
Duyujoju Gor AguOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Modelos Atomicos
Hochgeladen von
Duyujoju Gor AguCopyright:
Verfügbare Formate
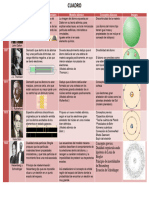
Cuadro comparativo de los modelos
Materia: Quimica I Alumna: Yuliana Carolina Grajales Gordillo 1°F
CIENTIFICO DIBUJO TEORIA ATOMICA MODELO ATOMICO ANALOGIA DIFERENCIA ENTRE
ELLOS
Es una teoría sobre la Este innovador modelo Para alumnos que Thomson creía que los
Thompson estructura atómica atómico usó la amplia aún no cursaron electrones se
propuesta en 1904 por evidencia obtenida electricidad y encontraban
Thomson, quien gracias al estudio de los magnetismo, la dentro de la parte
descubrió el electrón rayos catódicos a lo largo experiencia cotidiana positiva
en 1897, pocos años de la segunda mitad del más cercana es el
antes del siglo XIX. tubo fluorescente
descubrimiento del ante una diferencia
protón y del neutrón. de potencial
Es un modelo clásico En este modelo los La teoría de las El modelo de Bohr
Bohr del átomo, pero fue el electrones giran en órbitas cuantificadas, establece que los
primer modelo atómico órbitas circulares que en la teoría electrones entorno al
en el que se introduce alrededor del núcleo, mecánica cuántica núcleo se encuentran
una cuantización a ocupando la órbita de consiste en las en niveles bien
partir de ciertos menor energía posible, o características que, definidos de energía
postulados. la órbita más cercana en torno al núcleo
posible al núcleo. atómico
El modelo atómico de Los elementos están Las moléculas de una Los átomos del mismo
Dalton1 fue el primer formados por partículas misma sustancia son elemento son iguales
modelo atómico con discretas, diminutas e iguales en todos sus tanto en su masa como
Dalton bases científicas, indivisibles, llamadas aspectos y distintas a en el resto de sus
propuesto entre 1803 y átomos, que no se alteran las de otras propiedades
1807 por John Dalton. en los cambios químicos. sustancias
Es un modelo atómico Sugiere que la carga el átomo de cualquier El modelo de
o teoría sobre la positiva del átomo está elemento se Rutherford solo
estructura interna del concentrada en un núcleo compone de un describe al átomo con
Rutherford átomo propuesto por el estacionario de gran núcleo diminuto en el un núcleo y entorno a él
químico y físico masa, mientras que los que se reúne toda la se encuentran girando
británico-neozelandés electrones negativos se carga eléctrica los electrones en
Ernest Rutherford2 mueven en órbitas positiva y casi toda la orbitas
alrededor del núcleo. masa y de electrones
con carga negativa
que giran alrededor
de este núcleo
El modelo atómico de funcionaba muy bien para el En 1916, Arnold Sommerfeld, En 1916, Arnold Sommerfeld, con la
con la ayuda de la teoría de la ayuda de la teoría de la relatividad
Sommerfeld es átomo de hidrógeno, sin relatividad de Albert Einstein, de Albert Einstein, hizo las
básicamente es una embargo, en los espectros hizo las siguientes siguientes modificaciones al modelo
realizados para átomos de modificaciones al modelo de de Bohr:
generalización Bohr: Los electrones se mueven alrededor
otros elementos se Los electrones se mueven del núcleo, en órbitas circulares o
Sommerfeld relativista del modelo observaba que electrones de alrededor del núcleo, en órbitas elípticas.
atómico de Bohr. un mismo nivel energético circulares o elípticas. A partir del segundo nivel
A partir del segundo nivel energético existen uno o más
tenían distinta energía, energético existen uno o más subniveles en el mismo nivel.
mostrando que existía un subniveles en el mismo nivel. El electrón es una corriente
error en el modelo. El electrón es una corriente eléctrica minúscula.
eléctrica minúscula. En consecuencia, el modelo atómico
En consecuencia, el modelo de Sommerfeld es una
atómico de Sommerfeld es una generalización del modelo atómico
generalización del modelo de Bohr desde el punto de vista
atómico de Bohr desde el punto relativista, aunque no pudo
de vista relativista, aunque no demostrar las formas de emisión de
pudo demostrar las formas de las órbitas elípticas, solo descartó su
emisión de las órbitas elípticas, forma circular.
solo descartó su forma circular.
Das könnte Ihnen auch gefallen
- Fichero lúdico preescolar con juegos alineados a competenciasDokument114 SeitenFichero lúdico preescolar con juegos alineados a competenciasLluvia Ricardo Hernandez75% (4)
- Cuadro Comparativos de Los Modelos AtomicosDokument1 SeiteCuadro Comparativos de Los Modelos AtomicosSamuel Fernando Delgado67% (3)
- Modelos atómicos línea tiempoDokument2 SeitenModelos atómicos línea tiempoLeidy Yohana Bayona Florez86% (7)
- Educadorcito - Fichero Ludico 1.0 Primaria PDFDokument142 SeitenEducadorcito - Fichero Ludico 1.0 Primaria PDFDuyujoju Gor Agu100% (4)
- 810 Juegos EF PDFDokument304 Seiten810 Juegos EF PDFFelipe Escamilla Hdez86% (7)
- Parte TermodinámicaDokument15 SeitenParte TermodinámicaaleinNoch keine Bewertungen
- Modelos Atomicos 2Dokument3 SeitenModelos Atomicos 2Jhoe Henrriquez0% (1)
- Actividad - 2 - Tabla Modelos - AtomicoDokument4 SeitenActividad - 2 - Tabla Modelos - AtomicoJuan de Dios Marín EscamillaNoch keine Bewertungen
- Teoria AtomicaDokument3 SeitenTeoria AtomicaNeheyler MecatrónicoNoch keine Bewertungen
- Modelos Del AtomoDokument2 SeitenModelos Del Atomocamiv14ygNoch keine Bewertungen
- Modelos AtómicosDokument10 SeitenModelos AtómicosCristian BravoNoch keine Bewertungen
- Teorías atómicas desde Dalton hasta el modelo actualDokument31 SeitenTeorías atómicas desde Dalton hasta el modelo actualberta mejiaNoch keine Bewertungen
- Modelos atómicos comparativosDokument2 SeitenModelos atómicos comparativosAndrea GonzalezNoch keine Bewertungen
- LMy TDokument6 SeitenLMy Tlu pnNoch keine Bewertungen
- Linea de Tiempo-Yurisell Nieto-LicFísica-QuímicaGeneralADokument2 SeitenLinea de Tiempo-Yurisell Nieto-LicFísica-QuímicaGeneralAYurisell NietoNoch keine Bewertungen
- Cuadro Comparativo de Los Modelos AtómicosDokument6 SeitenCuadro Comparativo de Los Modelos AtómicosJesús Alexander MejíazNoch keine Bewertungen
- Fusión NuclearDokument30 SeitenFusión NuclearTrapGameNoch keine Bewertungen
- Modelos AtómicosDokument5 SeitenModelos AtómicosTrapGameNoch keine Bewertungen
- TEORÍA ATÓMICA (Parte 1)Dokument4 SeitenTEORÍA ATÓMICA (Parte 1)Neheyler MecatrónicoNoch keine Bewertungen
- Estructura Atomica II - QuimicaDokument4 SeitenEstructura Atomica II - QuimicaBrinny VelazcoNoch keine Bewertungen
- Modelos Atomicos para Grado Decimo 4 Mayo de 2020Dokument20 SeitenModelos Atomicos para Grado Decimo 4 Mayo de 2020Johana De La HozNoch keine Bewertungen
- Solucion QuimicaDokument4 SeitenSolucion Quimicadaniel giron0% (1)
- Repaso Modelos AtómicosDokument4 SeitenRepaso Modelos AtómicosNatalia Arias Figueroa100% (1)
- Atomos y Modelos AtomicosDokument4 SeitenAtomos y Modelos AtomicosIgnacio Nuñez FuentesNoch keine Bewertungen
- Historia Del AtomoDokument15 SeitenHistoria Del Atomoisaac luna cañete100% (1)
- Resumen QuimicaDokument51 SeitenResumen QuimicaVale GárateNoch keine Bewertungen
- Cuadro Comparativo de Los Modelos AtomicosDokument1 SeiteCuadro Comparativo de Los Modelos Atomicoslautarobre10Noch keine Bewertungen
- Modelos atómicos históricosDokument2 SeitenModelos atómicos históricosGab BrielNoch keine Bewertungen
- Química PREDokument4 SeitenQuímica PREVictor Huerta RojasNoch keine Bewertungen
- Modelos AtomicosDokument4 SeitenModelos Atomicosjuan david saavedra silvaNoch keine Bewertungen
- Evolución de los modelos atómicos desde Demócrito hasta el modelo atómico actualDokument4 SeitenEvolución de los modelos atómicos desde Demócrito hasta el modelo atómico actualEsperanza López MosquedaNoch keine Bewertungen
- Ciencias 3Dokument4 SeitenCiencias 3Sebastian Cuello OlivaresNoch keine Bewertungen
- Modelos atómicos: evolución históricaDokument1 SeiteModelos atómicos: evolución históricaPerez AlhanNoch keine Bewertungen
- Quimica Basica para Ciencias de La Salud Abq Clase 2 2019 I - Wv-AbqDokument60 SeitenQuimica Basica para Ciencias de La Salud Abq Clase 2 2019 I - Wv-Abqgabriel mNoch keine Bewertungen
- Presentacion Power Point Episodio 4 IIDokument24 SeitenPresentacion Power Point Episodio 4 IIMaría Eugenia García CarralNoch keine Bewertungen
- Cronograma de Los AtomosDokument6 SeitenCronograma de Los Atomoskatiagelvis100% (5)
- Los Modelos Atomicos y Su HistoriaDokument5 SeitenLos Modelos Atomicos y Su HistoriaKennia Rivera GuapulemaNoch keine Bewertungen
- El Átomo_ su historia y estructuraDokument8 SeitenEl Átomo_ su historia y estructuraEmilio RaschiaNoch keine Bewertungen
- Modelo AtomicoDokument8 SeitenModelo AtomicoOctavio Felipe Mendez MorenoNoch keine Bewertungen
- Actividades de QuimicaDokument7 SeitenActividades de Quimicairvingfeel0409swNoch keine Bewertungen
- 2. Estructura atómicaDokument8 Seiten2. Estructura atómicaWilmar SalcedoNoch keine Bewertungen
- Quimica - 4 ToDokument5 SeitenQuimica - 4 ToVictor Huerta RojasNoch keine Bewertungen
- GUIA 1 QUIMICA 1º Medio A y CDokument8 SeitenGUIA 1 QUIMICA 1º Medio A y Cyessemomo86Noch keine Bewertungen
- Estructura AtomicaDokument30 SeitenEstructura Atomicaanya gascaNoch keine Bewertungen
- Actividades Componente Químico. (Autoguardado)Dokument14 SeitenActividades Componente Químico. (Autoguardado)Maria Fernanda Prasca Ruiz0% (1)
- Modelo atómico cuánticoDokument8 SeitenModelo atómico cuánticoBryan Alejandro Sandoval GarciaNoch keine Bewertungen
- Unidad Educativa Si Miao Wei Hua QuimicaaDokument10 SeitenUnidad Educativa Si Miao Wei Hua QuimicaaMelissa FigueroaNoch keine Bewertungen
- Química 2 Guia 1Dokument16 SeitenQuímica 2 Guia 1Alexander GustavoNoch keine Bewertungen
- Integrantes Química IDokument5 SeitenIntegrantes Química IJasmine GutierrezNoch keine Bewertungen
- Modelos atómicos históricos desde Dalton hasta SchrödingerDokument2 SeitenModelos atómicos históricos desde Dalton hasta SchrödingerToy Mangle FazversNoch keine Bewertungen
- Modelos Atomicos Mas ImportantesDokument10 SeitenModelos Atomicos Mas ImportantesMariaElizabeth14Noch keine Bewertungen
- Presentación1 Linea de TiempoDokument1 SeitePresentación1 Linea de Tiempoluis zavala (luisito)Noch keine Bewertungen
- Guia Avanzada Modelos Atomicos NTDokument4 SeitenGuia Avanzada Modelos Atomicos NTFrancisca OlivaresNoch keine Bewertungen
- Modelos atómicos a través de la historiaDokument9 SeitenModelos atómicos a través de la historiaSebastian GuzmanNoch keine Bewertungen
- Experimentos de ÁtomosDokument3 SeitenExperimentos de ÁtomosViviana LascanoNoch keine Bewertungen
- 4.1.1 y 4.1.2 Modelos-AtomicosDokument34 Seiten4.1.1 y 4.1.2 Modelos-AtomicosjimezasNoch keine Bewertungen
- Modelos atómicos evoluciónDokument2 SeitenModelos atómicos evoluciónJesusNoch keine Bewertungen
- 8° CienciasDokument4 Seiten8° CienciasKarina Arancibia VeasNoch keine Bewertungen
- Los Modelos Atómicos.Dokument1 SeiteLos Modelos Atómicos.Bennington EfrénNoch keine Bewertungen
- Línea de Tiempo: Modelos AtómicosDokument1 SeiteLínea de Tiempo: Modelos AtómicosMisael Ruiz Gutiérrez100% (2)
- Anexo No 2 Modelos AtómicosDokument4 SeitenAnexo No 2 Modelos AtómicosLuz Nelly Maya OrtizNoch keine Bewertungen
- Modelos Atomicos. Tp. Vidarte PatriciaDokument11 SeitenModelos Atomicos. Tp. Vidarte Patriciapatricia vidarteNoch keine Bewertungen
- Tarea BioquímicaDokument6 SeitenTarea BioquímicaIvanna Salazar SosaNoch keine Bewertungen
- Evaluacion Educacion Fisica PreescolarDokument35 SeitenEvaluacion Educacion Fisica Preescolarrafael_palacioss100% (4)
- 02 Juegos Deportivos Cooperativos CorrerDokument9 Seiten02 Juegos Deportivos Cooperativos CorrerJhossMan Schelvieck SánchezNoch keine Bewertungen
- 1° Preescolar Unidad 3 - RubricaDokument2 Seiten1° Preescolar Unidad 3 - RubricaKarina LopezNoch keine Bewertungen
- KuegosDokument13 SeitenKuegosDuyujoju Gor AguNoch keine Bewertungen
- PETEDokument144 SeitenPETEulisesm2103Noch keine Bewertungen
- Componentes Del SIPDokument25 SeitenComponentes Del SIPjessica cristelNoch keine Bewertungen
- Informe de Ley de Hooke y Modulo de YoungDokument8 SeitenInforme de Ley de Hooke y Modulo de YoungGiovany GomajoaNoch keine Bewertungen
- SINTESIS III PERIODO 6°. Leyes de NewtonDokument8 SeitenSINTESIS III PERIODO 6°. Leyes de NewtonLUCIA OLIVEROSNoch keine Bewertungen
- Movimiento RectilineoDokument6 SeitenMovimiento RectilineoAlex MaldonadoNoch keine Bewertungen
- TQ2 Bach IIINDokument5 SeitenTQ2 Bach IIINStephen YoungNoch keine Bewertungen
- JustificacionDokument13 SeitenJustificacionJhoanCruzRiosNoch keine Bewertungen
- TALLER FouresDokument6 SeitenTALLER FouresAlejandra MorenoNoch keine Bewertungen
- Tesis CordovaDokument60 SeitenTesis CordovaALEXANDER 2CCNoch keine Bewertungen
- Informe 3 ..Filosofia de Los Puentes en El PeruDokument14 SeitenInforme 3 ..Filosofia de Los Puentes en El Peruruth karina aguirre mendietaNoch keine Bewertungen
- Válvulas de Expansión Funcionamiento y SelecciónDokument13 SeitenVálvulas de Expansión Funcionamiento y SelecciónbarbaraNoch keine Bewertungen
- EspectrofotometriaDokument18 SeitenEspectrofotometriaMarcela Zamorano RNoch keine Bewertungen
- Los Instrumentos y Medidores para Nuestro Conocimiento.Dokument8 SeitenLos Instrumentos y Medidores para Nuestro Conocimiento.Yeymi Franchesca Hernandez Parada100% (1)
- Trabajo Seguridad SoldaduraDokument387 SeitenTrabajo Seguridad SoldaduraBobby bobbyNoch keine Bewertungen
- Espejo ConcavoDokument5 SeitenEspejo ConcavoRodrigo Márquez ContrerasNoch keine Bewertungen
- Resultados A Las 6 Horas de ConsumoDokument19 SeitenResultados A Las 6 Horas de ConsumoLekyar ZepolNoch keine Bewertungen
- Medición viscosidad fluidosDokument5 SeitenMedición viscosidad fluidosEzequiel Fat CastroNoch keine Bewertungen
- Guia de Transferencia de Masa Por DifusionDokument4 SeitenGuia de Transferencia de Masa Por DifusionDaniel G. Simón M.Noch keine Bewertungen
- Pre Wiener 2021: Física Aplicada A La MedicinaDokument28 SeitenPre Wiener 2021: Física Aplicada A La MedicinaJikeyNoch keine Bewertungen
- DESPIEZE GSH27 BOSCH Esquema + Listado PiezasDokument7 SeitenDESPIEZE GSH27 BOSCH Esquema + Listado Piezasmanuel barberoNoch keine Bewertungen
- Trabajo SenatiDokument12 SeitenTrabajo SenatiAll VelaNoch keine Bewertungen
- ClimatologiaDokument42 SeitenClimatologiayonatanNoch keine Bewertungen
- Catálisis Enzimática PDFDokument6 SeitenCatálisis Enzimática PDFClaudia RadaNoch keine Bewertungen
- Dedicatoria y FisicaDokument2 SeitenDedicatoria y FisicaDamián AlexanderNoch keine Bewertungen
- Flexion ResisDokument14 SeitenFlexion ResisMATIASNoch keine Bewertungen
- Janny SeccionesDokument26 SeitenJanny Seccionesfranz rojas machadoNoch keine Bewertungen
- Informe de CalorimetriaDokument11 SeitenInforme de CalorimetriaYorka Yeivin Arce Gutierrez50% (2)
- FICHA TECNICA TIPO PEDESTAL TRIFASICO 1000 KVA PROLECDokument2 SeitenFICHA TECNICA TIPO PEDESTAL TRIFASICO 1000 KVA PROLECoscar monroyNoch keine Bewertungen
- 00224460945im05s11003278silabo de Termodinamica 2020 IDokument12 Seiten00224460945im05s11003278silabo de Termodinamica 2020 IJorgeEd Torres HuamánNoch keine Bewertungen
- Modulo VI - Estado Gaseoso de La MateriaDokument25 SeitenModulo VI - Estado Gaseoso de La MateriaThomas ShelbyNoch keine Bewertungen