Beruflich Dokumente
Kultur Dokumente
Primer Taller Fisicoquímica
Hochgeladen von
Gustavo Contreras Otalvaro0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
165 Ansichten3 SeitenEste documento presenta una serie de 11 problemas relacionados con conceptos termodinámicos como gases ideales, ecuación de estado de Van der Waals, trabajo, calor y procesos cíclicos. Los problemas cubren temas como la determinación de expresiones para la compressibilidad y expansibilidad de gases ideales, cálculo de trabajo en procesos de expansión y compresión de gases, y cálculo de cantidades termodinámicas como calor, trabajo, energía interna y entalpía para diferentes procesos y ciclos termodinámicos.
Originalbeschreibung:
taller resuelto
Originaltitel
Primer Taller Fisicoquímica (1)
Copyright
© © All Rights Reserved
Verfügbare Formate
DOCX, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenEste documento presenta una serie de 11 problemas relacionados con conceptos termodinámicos como gases ideales, ecuación de estado de Van der Waals, trabajo, calor y procesos cíclicos. Los problemas cubren temas como la determinación de expresiones para la compressibilidad y expansibilidad de gases ideales, cálculo de trabajo en procesos de expansión y compresión de gases, y cálculo de cantidades termodinámicas como calor, trabajo, energía interna y entalpía para diferentes procesos y ciclos termodinámicos.
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
165 Ansichten3 SeitenPrimer Taller Fisicoquímica
Hochgeladen von
Gustavo Contreras OtalvaroEste documento presenta una serie de 11 problemas relacionados con conceptos termodinámicos como gases ideales, ecuación de estado de Van der Waals, trabajo, calor y procesos cíclicos. Los problemas cubren temas como la determinación de expresiones para la compressibilidad y expansibilidad de gases ideales, cálculo de trabajo en procesos de expansión y compresión de gases, y cálculo de cantidades termodinámicas como calor, trabajo, energía interna y entalpía para diferentes procesos y ciclos termodinámicos.
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 3
UNIVERSIDAD DE CALDAS
FISICOQUÍMICA
TALLER FISICOQUÍMICA
1. Si = (1/V)(V/T)P determinar la expresión de para un gas ideal.
2. Si =-(1/V)( V/P)T determinar la expresión de para un gas ideal.
3. El comportamiento del gas butano se ajusta, dentro de ciertos límites, a la
ecuación de estado de Van der Waals
(P + n2a/V2)(V – nb) = nRT
siendo en este caso a = 14.5 y b = 0.122 .
Cuales son las unidades de a y b si T esta en K y la P en atm.
Calcule el trabajo realizado por un mol de gas butano, considerándolo como un gas
de Van der Waals, al expansionarse cuasiestáticamente desde 2 L hasta 3 L a la
temperatura constante de T= 27°C. Compare con el resultado que daría la ecuación
de los gases ideales.
4. Para la ecuación de Van der Waals determinar:
( P/V)T y ( 2P/V2)T
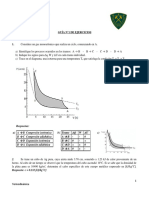
5. Un gas se expande desde I hasta F, como se indica en la figura. Calcule el trabajo
realizado en las trayectorias IAF, IBF. Compare los trabajos y que puede concluir.
Suponga proceso cuasiestático.
6. Una muestra de un gas ideal de 1 mol se lleva a cabo a través de un proceso
termodinámico cíclico como se muestra en la figura. El ciclo consta de tres partes:
Una expansión isotérmica a-b
Una compresión isobárica
Un aumento de presión a volumen constante.
Si T= 300K Pa = 5 atm , Pb = Pc = 1 atm. Determine el trabajo realizado por el
gas durante el proceso
7. Una muestra de gas se expande al doble de su volumen original de 1 m3 en un
proceso cuasiestático para el cual P= V2, con = 5 atm/m6 . Cuanto trabajo realizó
el gas en la expansión.
8. Un mol de gas ideal hace un trabajo de 3000 J sobre los alrededores al expandirse
isotérmicamente a una presión final de 1 atm y a un volumen final de 25 L.
Determine el volumen inicial
La temperatura del gas
9. Calcular el trabajo vinculado a la expansión isotérmica de 0.45 moles de un gas
ideal inicialmente a 273 K y 10 atm, cuando:
Se expande contra una presión externa de 1 atm ( hasta igualar la presión
externa)
Se expande en dos etapas, una contra una presión externa de 5 atm y otra
contra una presión externa de 1 atm.
Se expande en varias etapas con un V de 1 L, hasta un volumen final de
10 L
La expansión es reversible y llega hasta un volumen de 10 L.
10. Un trozo de metal de 50 g se encuentra inicialmente a 200 ºC y se sumerge en un
calorímetro que contiene 0,5 Kg de agua a 20ºC. Después de un tiempo
determinado la temperatura se equilibra en 22,4 ºC. Calcular el calor específico
del metal y el calor ganado por el agua. Calor específico del agua 4186 J/Kg ºC.
11. Para el agua Lf= 3,33x105 J/Kg y Lv =22,6x105 J/Kg. Calcular la cantidad de calor
necesaria para transformar un gramo de hielo de -30 ºC hasta 120 ºC. calor
especifico de hielo 2090 J/Kg ºC. calor especifico del vapor 2000 J/Kg ºC
1. Un gas ideal de coeficiente adiabático γ = 1.4 con un volumen específico inicial de
0.008 m3/mol se somete a un calentamiento isocórico que hace variar su presión entre
2.65 bar y 4.20bar. Seguidamente el gas se expande adiabáticamente hasta un
volumen adecuado, y por último se somete a una compresión isotermica hasta que
recupera su volumen específico inicial.
A) Determine presión, volumen y temperatura de cada estado
B) Determine Q, W, ΔU, ΔH para cada etapa y para el ciclo completo.
2. 3 moles de un gas monoatómico con Cv,m = 3/2R , realizando el ciclo reversible
ABCD de la figura. Si el volumen del gas en el estado C es el doble del volumen del
gas en el estado B, y la temperatura en A 20 ᴼC ( No suponer volúmenes)
Calcular las variables desconocidas en cada vértice del ciclo.
Determine Q, W, ΔU, ΔH para cada etapa y para el ciclo completo.
10-41.57
Das könnte Ihnen auch gefallen
- FseyndrxuDokument4 SeitenFseyndrxuMiguel SaavedraNoch keine Bewertungen
- Taller 1 PDFDokument10 SeitenTaller 1 PDFMonica OramasNoch keine Bewertungen
- ProbtermoDokument3 SeitenProbtermoroncada-series.0rNoch keine Bewertungen
- TermodinamicaDokument4 SeitenTermodinamicaJimmy Erick Luque MamaniNoch keine Bewertungen
- Taller 1Dokument10 SeitenTaller 1Juan Camilo DicueNoch keine Bewertungen
- Guia 1 Fscoquimica PDFDokument3 SeitenGuia 1 Fscoquimica PDFjuanannaNoch keine Bewertungen
- Guía de Ejercicios Tema 3Dokument4 SeitenGuía de Ejercicios Tema 3Kleidder ZacariasNoch keine Bewertungen
- Guia de Ejercicios 9Dokument1 SeiteGuia de Ejercicios 9SÁENZ ANDAGUA LUIS MIGUELNoch keine Bewertungen
- 1o LeyDokument4 Seiten1o LeyneedformaxNoch keine Bewertungen
- 5ta Practica DirigidaDokument1 Seite5ta Practica DirigidaFranc AguilarNoch keine Bewertungen
- Guia Numero 4Dokument7 SeitenGuia Numero 4eutectic19920% (1)
- Primera Ley de La TermodinamicaDokument2 SeitenPrimera Ley de La Termodinamicajesus orlando peñaloza contrerasNoch keine Bewertungen
- 5ta Practica DirigidaDokument1 Seite5ta Practica DirigidaJpiero :vNoch keine Bewertungen
- Actividad3 PDFDokument2 SeitenActividad3 PDFAimy Espinoza MendozaNoch keine Bewertungen
- 006629420Dokument4 Seiten006629420Jesús JacksonNoch keine Bewertungen
- Problemas Termodinámica 2015Dokument12 SeitenProblemas Termodinámica 2015Jose DanielNoch keine Bewertungen
- 1ra Ley Termodinàmica. Octubre 2016 - Marzo 2017Dokument3 Seiten1ra Ley Termodinàmica. Octubre 2016 - Marzo 2017Wendy Dávila ArteagaNoch keine Bewertungen
- Solucionario Ejercicios de FisicoQuimicaDokument1 SeiteSolucionario Ejercicios de FisicoQuimicaJesús NequisNoch keine Bewertungen
- Taller 1Dokument10 SeitenTaller 1Monica Oramas0% (2)
- Problemas de 1° Ley de La TermodinamicaDokument3 SeitenProblemas de 1° Ley de La TermodinamicaKevin Caceres CruzNoch keine Bewertungen
- Guia 1 Primera Ley GasesDokument7 SeitenGuia 1 Primera Ley GasesGeraldineNoch keine Bewertungen
- Primera ParcialDokument12 SeitenPrimera ParcialCRISTHIAN NUÑEZ LIMACHENoch keine Bewertungen
- Termodinamica PROBLEMARIO UNIDAD IDokument2 SeitenTermodinamica PROBLEMARIO UNIDAD IMiguel A. Aguilar VeraNoch keine Bewertungen
- Problemas Propuestos para El Segundo ExamenDokument5 SeitenProblemas Propuestos para El Segundo ExamenVictor V IeNoch keine Bewertungen
- FISICADokument2 SeitenFISICAJeison Steven Gutierrez VegaNoch keine Bewertungen
- 02 - Gases y TransformacionesDokument2 Seiten02 - Gases y TransformacionesfacundoNoch keine Bewertungen
- MetodologiaDokument1 SeiteMetodologiaLUCERO100% (1)
- 201428417031711017010201166749Dokument2 Seiten201428417031711017010201166749Martin Pachas ParionaNoch keine Bewertungen
- Gua N1 Termodinmica 2015Dokument9 SeitenGua N1 Termodinmica 2015Elías Raphael Rubilar BugueñoNoch keine Bewertungen
- Ejercicios Termodinamica BasicaDokument13 SeitenEjercicios Termodinamica BasicaNicolas Vasquez36% (11)
- Discusión #4Dokument4 SeitenDiscusión #4Diana Gabriela MedinaNoch keine Bewertungen
- Taller Primera LeyDokument1 SeiteTaller Primera LeyJohanMorenoNoch keine Bewertungen
- Discusion 4Dokument4 SeitenDiscusion 4elbetoavila100% (1)
- Examen Tipo TermodinamicaDokument3 SeitenExamen Tipo TermodinamicaJafet AtNoch keine Bewertungen
- Quimica Física2Dokument22 SeitenQuimica Física2Luis Galarreta LedesmaNoch keine Bewertungen
- Guía de TermodinámicaDokument9 SeitenGuía de TermodinámicaJavier CortésNoch keine Bewertungen
- 2da Ley ENTROPIADokument3 Seiten2da Ley ENTROPIAStefany Elizabeth Crisostomo QuispeNoch keine Bewertungen
- Quimica ProblemasDokument6 SeitenQuimica ProblemasDiana RHNoch keine Bewertungen
- Problemas Tema 2Dokument2 SeitenProblemas Tema 2José Rafael GuillénNoch keine Bewertungen
- 01 Ejercicios IntroduccionTermodinamica IDokument4 Seiten01 Ejercicios IntroduccionTermodinamica IJulissa Guzman67% (3)
- Ejercicios Primera Ley de La TermodinamicaDokument4 SeitenEjercicios Primera Ley de La TermodinamicaCamilo Buitrago0% (1)
- Ejercicios de La Segunda Ley de La Termodinamica Entropia PDFDokument2 SeitenEjercicios de La Segunda Ley de La Termodinamica Entropia PDFLORENZO MARIANO RODRIGUEZ GONZALESNoch keine Bewertungen
- Termodinamica Ejercicios 3Dokument2 SeitenTermodinamica Ejercicios 3Edwin RamonNoch keine Bewertungen
- Guía Fisicoquímica IDokument3 SeitenGuía Fisicoquímica ITania GachusNoch keine Bewertungen
- Trabajo - Termodinamica PDFDokument2 SeitenTrabajo - Termodinamica PDFExamenesPorWhatsappNoch keine Bewertungen
- 9-Seminario Termo 2018-2Dokument2 Seiten9-Seminario Termo 2018-2Edgar Alberto Palomino HuamaniNoch keine Bewertungen
- Serie de Problemas #1 Termodinamica IIDokument4 SeitenSerie de Problemas #1 Termodinamica IIFrank C. Flores100% (1)
- Problemas Bis 2013Dokument3 SeitenProblemas Bis 2013Emanuel TejadaNoch keine Bewertungen
- Ejercicios W y Q. Primera Ley 2020-IDokument7 SeitenEjercicios W y Q. Primera Ley 2020-IOleggValVilNoch keine Bewertungen
- Física 2 - Guía 7 - 1er Principio TermoDokument4 SeitenFísica 2 - Guía 7 - 1er Principio TermoTamara FigueroaNoch keine Bewertungen
- Guía 1 PDFDokument3 SeitenGuía 1 PDFDaniel Andres Roa UmañaNoch keine Bewertungen
- Ingeniería química. Soluciones a los problemas del tomo IVon EverandIngeniería química. Soluciones a los problemas del tomo INoch keine Bewertungen
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesVon EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesNoch keine Bewertungen
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSVon EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSBewertung: 4.5 von 5 Sternen4.5/5 (7)
- Problemas resueltos de Hidráulica de CanalesVon EverandProblemas resueltos de Hidráulica de CanalesBewertung: 4.5 von 5 Sternen4.5/5 (7)
- Tabla 1. Algunos Grupos Funcionales Presentes en Productos ComercialesDokument2 SeitenTabla 1. Algunos Grupos Funcionales Presentes en Productos ComercialesGustavo Contreras OtalvaroNoch keine Bewertungen
- Informe de Lab. Analitica Concentracion de Hipoclorito de SodioDokument4 SeitenInforme de Lab. Analitica Concentracion de Hipoclorito de SodioGustavo Contreras OtalvaroNoch keine Bewertungen
- Tabla 1. Algunos Grupos Funcionales Presentes en Productos ComercialesDokument2 SeitenTabla 1. Algunos Grupos Funcionales Presentes en Productos ComercialesGustavo Contreras OtalvaroNoch keine Bewertungen
- Apuntes de Hidrologia e HidrogeologiaDokument76 SeitenApuntes de Hidrologia e HidrogeologiaMarco Antonio Cabrera Peniche100% (1)
- Concepto de Pedagogia Flor Adelia TorresDokument1 SeiteConcepto de Pedagogia Flor Adelia TorresGustavo Contreras OtalvaroNoch keine Bewertungen
- Taller Bioenergetica - 2021 Gustavo ContrerasDokument3 SeitenTaller Bioenergetica - 2021 Gustavo ContrerasGustavo Contreras OtalvaroNoch keine Bewertungen
- Ciencia, Hombre y MundoDokument2 SeitenCiencia, Hombre y MundoGustavo Contreras OtalvaroNoch keine Bewertungen
- Acta de Reunion 29 de Octubre TECCEN Y EVADDokument1 SeiteActa de Reunion 29 de Octubre TECCEN Y EVADGustavo Contreras OtalvaroNoch keine Bewertungen
- Unidad Didactica CTSDokument6 SeitenUnidad Didactica CTSGustavo Contreras Otalvaro100% (1)
- Ejercicios Estadistica y BioestadisticaDokument36 SeitenEjercicios Estadistica y BioestadisticaGustavo Contreras OtalvaroNoch keine Bewertungen
- El Gráfico de GranDokument3 SeitenEl Gráfico de GranGustavo Contreras Otalvaro100% (1)
- Análisis de Las Orientaciones de ClaseDokument11 SeitenAnálisis de Las Orientaciones de ClaseGustavo Contreras OtalvaroNoch keine Bewertungen
- Taller 2-EntropiaDokument6 SeitenTaller 2-EntropiaDaniel NoreñaNoch keine Bewertungen
- Tema - Concepto de PH - Acidez, Basicidad y NeutralizaciónDokument4 SeitenTema - Concepto de PH - Acidez, Basicidad y NeutralizaciónGustavo Contreras OtalvaroNoch keine Bewertungen
- Taller Termoquímica y FasesDokument9 SeitenTaller Termoquímica y FasesGustavo Contreras OtalvaroNoch keine Bewertungen
- Esquema Sobre El Escrito - SemilleroDokument2 SeitenEsquema Sobre El Escrito - SemilleroGustavo Contreras OtalvaroNoch keine Bewertungen
- Valoracion Del Cloro Activo en Una MuestDokument7 SeitenValoracion Del Cloro Activo en Una MuestGuillermo GuerreroNoch keine Bewertungen
- Practicas 4TO FinalDokument13 SeitenPracticas 4TO FinalToto83% (6)
- Tarea 5 Introduccion A La Seguridad IndustrialDokument11 SeitenTarea 5 Introduccion A La Seguridad IndustrialErick MeillonNoch keine Bewertungen
- Pseudo PresionesDokument32 SeitenPseudo PresionesJerick Andre Rodriguez MottaNoch keine Bewertungen
- Meca (Practica 1 Tablas)Dokument8 SeitenMeca (Practica 1 Tablas)Alex SánchezNoch keine Bewertungen
- Tema 4. Control Del Punto de Rocío Del Gas NaturalDokument54 SeitenTema 4. Control Del Punto de Rocío Del Gas NaturalKelly Johanna Cubillos QuirozNoch keine Bewertungen
- Generación de VaporDokument25 SeitenGeneración de Vaporpis305salNoch keine Bewertungen
- Clase 3. Leyes de Los GasesDokument15 SeitenClase 3. Leyes de Los GasesedisonNoch keine Bewertungen
- CUESTIONARIO PREVIO PRACTICA #4 Uriarte Ortiz Enrique YahirDokument5 SeitenCUESTIONARIO PREVIO PRACTICA #4 Uriarte Ortiz Enrique YahirYayo UrNoch keine Bewertungen
- Ter U1 A5e1Dokument4 SeitenTer U1 A5e1Brenda Diaz SierraNoch keine Bewertungen
- Problemas Quimica (Termodinamica)Dokument30 SeitenProblemas Quimica (Termodinamica)Daniel SolarNoch keine Bewertungen
- Propiedades ColigativasDokument14 SeitenPropiedades ColigativasLupizz ScNoch keine Bewertungen
- Humedad AplicacionesDokument39 SeitenHumedad AplicacionesFio MNoch keine Bewertungen
- Generadores de Vapor, Evaporadores y SecadoresDokument15 SeitenGeneradores de Vapor, Evaporadores y Secadoresfrancisco hernandezNoch keine Bewertungen
- Fiscalización Tanques de AlmacenamientoDokument46 SeitenFiscalización Tanques de AlmacenamientoDiever ArcosNoch keine Bewertungen
- Capitulo 3 Libro de TermodinámicaDokument33 SeitenCapitulo 3 Libro de TermodinámicaRangel Gordillo Dulce CarolinaNoch keine Bewertungen
- Tipos de SecadoresDokument12 SeitenTipos de SecadoresDreigon Martinez100% (1)
- Disoluciones IdealesDokument10 SeitenDisoluciones IdealesCesar Augusto Torres LinaresNoch keine Bewertungen
- Gases Lab 2-2020Dokument26 SeitenGases Lab 2-2020Alex UbagoNoch keine Bewertungen
- Informe Primera PracticaDokument10 SeitenInforme Primera PracticaSebastian Felipe ArguelloNoch keine Bewertungen
- Trabajo VentiladoresDokument4 SeitenTrabajo VentiladoresSegundo Romelio Coronel GavidiaNoch keine Bewertungen
- Cuestionario TransporteDokument7 SeitenCuestionario TransporteLilian Solvy Mila NuñezNoch keine Bewertungen
- Introducción A La Tabla PeriódicaDokument3 SeitenIntroducción A La Tabla PeriódicaJorge Gonzalo Maslucan ChicanaNoch keine Bewertungen
- Técnicas Del SumilladoDokument13 SeitenTécnicas Del SumilladoSebastian Zaraza RojasNoch keine Bewertungen
- EFECTOS DE LA LAMPARA DE PLASMA ArreglosDokument26 SeitenEFECTOS DE LA LAMPARA DE PLASMA ArreglosGennie CNoch keine Bewertungen
- Tabla Propiedades de FluidosDokument3 SeitenTabla Propiedades de FluidosMedalitNoch keine Bewertungen
- Balance de Cantidad de MovimientoDokument11 SeitenBalance de Cantidad de MovimientoBenjamín GarnicaNoch keine Bewertungen
- Trabajo Quimica - Daniel CamposDokument10 SeitenTrabajo Quimica - Daniel CamposDaniel Campos VienaNoch keine Bewertungen
- Problemas Resueltos Tema IIDokument15 SeitenProblemas Resueltos Tema IIPaulina AlcocerNoch keine Bewertungen
- Determinación de Coeficiente de PoissonDokument7 SeitenDeterminación de Coeficiente de PoissonCristhian Vargas100% (2)
- MD - FactibilidadDokument7 SeitenMD - Factibilidadmaria aponteNoch keine Bewertungen