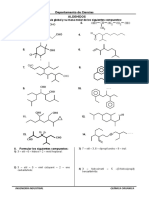
Beruflich Dokumente
Kultur Dokumente
REDX
Hochgeladen von
Maria Remigio mendozaCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
REDX
Hochgeladen von
Maria Remigio mendozaCopyright:
Verfügbare Formate
Reducci�n-oxidaci�n
Ir a la navegaci�nIr a la b�squeda
La pila Cu-Ag, un ejemplo de una reacci�n r�dox.
Pedazo de metal oxidado (corro�do)
Se denomina reacci�n de reducci�n-oxidaci�n, de �xido-reducci�n o, simplemente como
reacci�n r�dox, a toda reacci�n qu�mica en la que uno o m�s electrones se
transfieren entre los reactivos, provocando un cambio en sus estados de
oxidaci�n.1?
Para que exista una reacci�n de reducci�n-oxidaci�n, en el sistema debe haber un
elemento que ceda electrones, y otro que los acepte:
El agente oxidante es aquel elemento qu�mico que tiende a captar esos electrones,
quedando con un estado de oxidaci�n inferior al que ten�a, es decir, siendo
reducido.
El agente reductor es aquel elemento qu�mico que suministra electrones de su
estructura qu�mica al medio, aumentando su estado de oxidaci�n, es decir, siendo
oxidado.2?
Cuando un elemento qu�mico reductor cede electrones al medio, se convierte en un
elemento oxidado, y la relaci�n que guarda con su precursor queda establecida
mediante lo que se llama un �par r�dox�. An�logamente, se dice que, cuando un
elemento qu�mico capta electrones del medio, este se convierte en un elemento
reducido, e igualmente forma un par r�dox con su precursor oxidado. Cuando una
especie puede oxidarse, y a la vez reducirse, se le denomina anfolito, y al proceso
de la oxidaci�n-reducci�n de esta especie se le llama anfolizaci�n.
�ndice
1 Principio de electroneutralidad
1.1 Oxidaci�n
1.2 Reducci�n
2 N�mero de oxidaci�n
2.1 Reglas para asignar el n�mero de oxidaci�n
3 Ajuste de ecuaciones
3.1 Medio �cido
3.2 Medio b�sico
4 Aplicaciones
5 Oxidaciones y reducciones biol�gicas
6 Combusti�n
7 Consecuencias
8 Referencias
9 V�ase tambi�n
10 Enlaces externos
Principio de electroneutralidad
El principio de electroneutralidad de Pauling corresponde a un m�todo de
aproximaci�n para estimar la carga en mol�culas o iones complejos; este principio
supone que la carga siempre se distribuye en valores cercanos a 0 (es decir, -1, 0,
+1).
Dentro de una reacci�n global r�dox, se da una serie de reacciones particulares
llamadas semirreacciones o reacciones parciales.
Semirreacci�n de reducci�n: {\displaystyle {\ce {2 e^- + Cu^2+ -> Cu}}}
{\displaystyle {\ce {2 e^- + Cu^2+ -> Cu}}}
Semirreacci�n de oxidaci�n: {\displaystyle {\ce {Fe -> Fe^2+ + 2 e^-}}}
{\displaystyle {\ce {Fe -> Fe^2+ + 2 e^-}}}
o m�s com�nmente, tambi�n llamada ecuaci�n general:
{\displaystyle {\ce {Fe + Cu^2+ -> Fe^2+ + Cu}}}{\displaystyle {\ce {Fe + Cu^2+ ->
Fe^2+ + Cu}}}
La tendencia a reducir u oxidar a otros elementos qu�micos se cuantifica mediante
el potencial de reducci�n, tambi�n llamado potencial r�dox.
Una titulaci�n r�dox es aquella en la que un indicador qu�mico indica el cambio en
el porcentaje de la reacci�n r�dox mediante el viraje de color entre el oxidante y
el reductor.
Das könnte Ihnen auch gefallen
- HT 07 - AldehídosDokument2 SeitenHT 07 - AldehídosJonathan MurgaNoch keine Bewertungen
- Alto Horno - AlumnoDokument16 SeitenAlto Horno - AlumnoJESUS FRANCISCO DUARTENoch keine Bewertungen
- Oxidación de frutas y verduras con limón y agua oxigenadaDokument3 SeitenOxidación de frutas y verduras con limón y agua oxigenadaJuan Daniel Rojas LozaNoch keine Bewertungen
- Repaso III NomencDokument3 SeitenRepaso III NomencJosue RRamos AArtica0% (2)
- Tesis Alto Horno Est-Termodinamico PDFDokument54 SeitenTesis Alto Horno Est-Termodinamico PDFFernando CaballeroNoch keine Bewertungen
- Quinona PDFDokument3 SeitenQuinona PDFLeonelNoch keine Bewertungen
- Agua Hidrogenada para Tus CélulasDokument13 SeitenAgua Hidrogenada para Tus CélulasLidia LidiaNoch keine Bewertungen
- 2do Informe Lab OrgDokument8 Seiten2do Informe Lab OrgMilagrosAntoniettaNoch keine Bewertungen
- Informe Nº2 (Obtencion Del Hidrogeno)Dokument9 SeitenInforme Nº2 (Obtencion Del Hidrogeno)Franco Paniagua NicolasNoch keine Bewertungen
- Polímeros ConductoresDokument3 SeitenPolímeros ConductoresamvelandiaNoch keine Bewertungen
- Guia de Practica 2011Dokument93 SeitenGuia de Practica 2011Corin Boice TelloNoch keine Bewertungen
- Referencia Bibliográfica Aptitud Académica y ConocimientoDokument8 SeitenReferencia Bibliográfica Aptitud Académica y ConocimientoJose Armando Sernaq'ue MoryNoch keine Bewertungen
- Instrucciones para Equilibrar Las Ecuaciones RedoxDokument4 SeitenInstrucciones para Equilibrar Las Ecuaciones RedoxDaniel PadillaNoch keine Bewertungen
- VandenBussche syngas2MeOHDokument10 SeitenVandenBussche syngas2MeOHVladimir Ramirez TolaNoch keine Bewertungen
- Taller BalanceoDokument1 SeiteTaller BalanceoVanessa LedesmaNoch keine Bewertungen
- Practica de QuimicaDokument32 SeitenPractica de QuimicaDennis Guillen MoyaNoch keine Bewertungen
- Compuestos Organicos e InorganicosDokument27 SeitenCompuestos Organicos e Inorganicosmarosmeiden123Noch keine Bewertungen
- Conceptos Basicos 1 V01 - PARTE 2Dokument40 SeitenConceptos Basicos 1 V01 - PARTE 2Valentina PalacinNoch keine Bewertungen
- Unidad 3 - Procesos Electrolíticos para La Obtención de MetalesDokument63 SeitenUnidad 3 - Procesos Electrolíticos para La Obtención de MetalesJeral HernándezNoch keine Bewertungen
- Accede A Apuntes, Guías, Libros y Más de Tu Carrera: Enzimas 8 PagDokument9 SeitenAccede A Apuntes, Guías, Libros y Más de Tu Carrera: Enzimas 8 PagVIOLETA ELIZABETH SANCHEZ CASTRONoch keine Bewertungen
- Guía de Química General para Curso Propedéutico de la Facultad de QuímicaDokument34 SeitenGuía de Química General para Curso Propedéutico de la Facultad de QuímicaIvan Gomez GuerreroNoch keine Bewertungen
- Concentracion ElectricaDokument16 SeitenConcentracion ElectricaLuisFernandoRomeroNoch keine Bewertungen
- Temas Selectos de Química 2 ResumenDokument23 SeitenTemas Selectos de Química 2 ResumenMiguel Angel López Navarrete100% (1)
- Semana 12 Qui IndusDokument21 SeitenSemana 12 Qui IndusAndree Cortez PerezNoch keine Bewertungen
- Te Dqui 1036 s2 - 2021 EstudiantesDokument2 SeitenTe Dqui 1036 s2 - 2021 EstudiantesJuan Ignacio Almonacid USSNoch keine Bewertungen
- SIDERURGIA FinalDokument63 SeitenSIDERURGIA FinalAllison JuarezNoch keine Bewertungen
- Control de Calidad de Los Materiales TermoplásticosDokument7 SeitenControl de Calidad de Los Materiales TermoplásticosCeciliaNoch keine Bewertungen
- Yacimientos Hipogenicos y Supergenicos IMPRIMIRDokument5 SeitenYacimientos Hipogenicos y Supergenicos IMPRIMIRalicia mariaNoch keine Bewertungen
- Métodos químicosDokument10 SeitenMétodos químicosepic boyNoch keine Bewertungen