Beruflich Dokumente
Kultur Dokumente
Coca 23
Hochgeladen von
Apaza Suyo Edson0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
17 Ansichten2 Seitenejercicios propuestos
Originaltitel
coca 23
Copyright
© © All Rights Reserved
Verfügbare Formate
DOCX, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenejercicios propuestos
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
17 Ansichten2 SeitenCoca 23
Hochgeladen von
Apaza Suyo Edsonejercicios propuestos
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 2
2.
1- La transformación reversible del estaño gris en estaño blanco ocurre a 13°C (286 K) y 1atm, el
calor de transformación es de 500 cal/mol (2092 J/mol). Calcule la variación de entropía.
𝑐𝑎𝑙
𝑆𝑛(𝑔𝑟𝑖𝑠) → 𝑆𝑛(𝑏𝑙𝑎𝑛𝑐𝑜) ∆𝐻𝑐° = 500 𝑚𝑜𝑙
∆𝑆 𝑠𝑖𝑠𝑡𝑒𝑚𝑎 = 𝐶𝑎𝑙𝑜𝑟 𝑎𝑏𝑠𝑜𝑟𝑏𝑖𝑑𝑜 𝑝𝑜𝑟 𝑒𝑙 𝑠𝑖𝑠𝑡𝑒𝑚𝑎 𝑡𝑒𝑚𝑝𝑒𝑟𝑎𝑡𝑢𝑟𝑎 𝑑𝑒 𝑓𝑢𝑠𝑖𝑜𝑛
𝑐𝑎𝑙
500
𝑚𝑜𝑙 = 1.748 𝑐𝑎𝑙 /°𝑘
286°𝐾 𝑚𝑜𝑙
∆𝑆 𝑒𝑛𝑡𝑜𝑟𝑛𝑜 = 𝐶𝑎𝑙𝑜𝑟 𝑑𝑒𝑠𝑝𝑟𝑒𝑛𝑑𝑖𝑑𝑜 𝑝𝑜𝑟 𝑒𝑙 𝑒𝑛𝑡𝑜𝑟𝑛𝑜 𝑑𝑒 𝑙𝑎 𝑡𝑒𝑚𝑝𝑒𝑟𝑎𝑡𝑢𝑟𝑎 𝑑𝑒 𝑓𝑢𝑠𝑖𝑜𝑛
𝑐𝑎𝑙
−500
𝑚𝑜𝑙 = −1.748 𝑐𝑎𝑙 /°𝑘
286°𝐾 𝑚𝑜𝑙
𝑉𝑎𝑟𝑖𝑜𝑛 𝑡𝑜𝑡𝑎𝑙 𝑑𝑒 𝑙𝑎 𝑒𝑛𝑡𝑟𝑜𝑝𝑖𝑎 𝑑𝑒 𝑙𝑎 𝑟𝑒𝑎𝑐𝑐𝑖𝑜𝑛
∆𝑆𝑟 = ∆𝑆 𝑠𝑖𝑠𝑡𝑒𝑚𝑎 + ∆𝑆 𝑒𝑛𝑡𝑜𝑟𝑛𝑜
= 1.748 + (−1.748)
=0
2.8 comente los resultados:
a) Calculo de ∆𝐺°1000°𝐾 de la reducción del oxido :
2 < 𝑀𝑜𝑂3 > +6(𝐻₂) = 2 < 𝑀𝑜 > + 6(𝐻₂𝑂)
∆𝐺° 1000°𝐾 = ∆𝐺°1000𝐾(𝐻₂𝑂) − ∆𝐺°1000𝐾 < 𝑀𝑜𝑂3 >
= 6(−45.5) − 2 − (−120) = −33 𝐾𝑐𝑎𝑙
𝐾𝑐𝑎𝑙
= −33 𝑚𝑜𝑙𝑒𝑠 𝑑𝑒 𝑀𝑜
2
𝐾𝑐𝑎𝑙
= −16.5 < 𝑀𝑜 >
𝑚𝑜𝑙
b) Calculo de ∆𝐺°1000°𝐾 de la reducción del óxido crómico
2 < 𝐶𝑟 2 𝑂3 > +6(𝐻 2 𝑂)
∆𝐺° 1000°𝐾 = 6∆𝐺°1000𝐾(𝐻₂𝑂) − 2∆𝐺°1000𝐾 < 𝐶𝑟 2 𝑂3 >
6(−45.5) − 2 − (−205.5)
∆𝐺° 1000°𝐾 = 138 𝐾𝑐𝑎𝑙
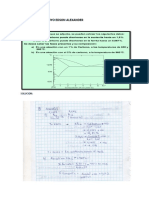
2.12 Determine la temperatura por encima y debajo de la cual la reducción del MgO por el Al
deviene termodinámicamente factible a 1atm (101.325 N/m²).
1
2(𝐴𝑙) + (𝑂2 ) =< 𝐴𝑙2𝑂3 >
2
∆𝐺° = −401.500 + 75.91 𝑇 𝑐𝑎𝑙(−1679.876 + 32 )79 𝑇 𝐽)
(𝑀𝑔) = (𝑂2 ) =< 𝑀𝑔𝑂 >
∆𝐺° = −174.750 + 49.09 𝑇𝑐𝑎𝑙 (−231.154 + 205.39 𝑇 𝑗)
La reacción es:
3 < 𝑀𝑔𝑂 > +2 < 𝐴𝑙 >=< 𝐴𝑙2𝑂3 > +3 < 𝑀𝑔𝑂 >
∆𝐺𝑇° = ∆𝐺° < 𝐴𝑙2𝑂3 > 3∆𝐺 < 𝑀𝑜𝑂3 >
= (−401.500 + 76.91𝑇) − 38(−174.750 + 49.09𝑇)
= 122.750 − 70.36𝑇
Calculo de la T de equilibrio= (∆𝐺 = 0)
122.750 − 70.36𝑇 = 0 → 𝑇 = 1749.6 − 273
𝑇 = 1471.6 °𝐶
La reduccion será a partir de esta T°
Das könnte Ihnen auch gefallen
- All You Can Eat by Shane McKenzie (Español)Dokument110 SeitenAll You Can Eat by Shane McKenzie (Español)erwin onofre67% (3)
- 2 Trabajo NeoDokument3 Seiten2 Trabajo NeoAxel Aguirre100% (1)
- Misiones Sec Und Arias Xenoblade ChroniclesDokument440 SeitenMisiones Sec Und Arias Xenoblade ChroniclesRobertpg7100% (11)
- P.C. #2 - Análisis VectorialDokument6 SeitenP.C. #2 - Análisis VectorialApaza Suyo EdsonNoch keine Bewertungen
- Procesamiento - Semana 14Dokument59 SeitenProcesamiento - Semana 14Apaza Suyo EdsonNoch keine Bewertungen
- Innovacion Expo 5 Grupo 1Dokument14 SeitenInnovacion Expo 5 Grupo 1Apaza Suyo EdsonNoch keine Bewertungen
- Procesamiento - Semana 13Dokument54 SeitenProcesamiento - Semana 13Apaza Suyo EdsonNoch keine Bewertungen
- Innovación Trabajo 1 Grupo ApazaDokument2 SeitenInnovación Trabajo 1 Grupo ApazaApaza Suyo EdsonNoch keine Bewertungen
- Evaluación Clase 3Dokument1 SeiteEvaluación Clase 3Apaza Suyo EdsonNoch keine Bewertungen
- 858-Texto Del Artículo-1876-2-10-20200713Dokument10 Seiten858-Texto Del Artículo-1876-2-10-20200713Angel Torres VilcaNoch keine Bewertungen
- Cuestionario Semana 9Dokument6 SeitenCuestionario Semana 9Apaza Suyo EdsonNoch keine Bewertungen
- Examen 4to Modulo Microscopia ApazaDokument4 SeitenExamen 4to Modulo Microscopia ApazaApaza Suyo EdsonNoch keine Bewertungen
- Prueba Metalografica ApazaDokument7 SeitenPrueba Metalografica ApazaApaza Suyo EdsonNoch keine Bewertungen
- Berilio y Cobre ApazaDokument10 SeitenBerilio y Cobre ApazaApaza Suyo EdsonNoch keine Bewertungen
- Velezmoro BiorreDokument8 SeitenVelezmoro BiorreApaza Suyo EdsonNoch keine Bewertungen
- APAZA SUYO, EDSON ALEXANDER Examen IV UnidadDokument3 SeitenAPAZA SUYO, EDSON ALEXANDER Examen IV UnidadApaza Suyo EdsonNoch keine Bewertungen
- Terc - Eval.conm - Clasif.min.2020-I Apaza SuyyoDokument2 SeitenTerc - Eval.conm - Clasif.min.2020-I Apaza SuyyoApaza Suyo EdsonNoch keine Bewertungen
- Electrica ApazaDokument8 SeitenElectrica ApazaApaza Suyo EdsonNoch keine Bewertungen
- Apaza PPT MetafisicaDokument14 SeitenApaza PPT MetafisicaApaza Suyo EdsonNoch keine Bewertungen
- Apaza Mi SempaiDokument3 SeitenApaza Mi SempaiApaza Suyo EdsonNoch keine Bewertungen
- Apaza Mi SempaiDokument3 SeitenApaza Mi SempaiApaza Suyo EdsonNoch keine Bewertungen
- Terc - Eval.conm - Clasif.min.2020-I Apaza SuyyoDokument2 SeitenTerc - Eval.conm - Clasif.min.2020-I Apaza SuyyoApaza Suyo EdsonNoch keine Bewertungen
- Apaza Mi SempaiDokument3 SeitenApaza Mi SempaiApaza Suyo EdsonNoch keine Bewertungen
- DIAGRAMAS DE ELLINGHAM APAZA SUYO v2Dokument7 SeitenDIAGRAMAS DE ELLINGHAM APAZA SUYO v2Apaza Suyo EdsonNoch keine Bewertungen
- INSPECCIÓN VISUAL - APAZA SUYO EDSON VDokument7 SeitenINSPECCIÓN VISUAL - APAZA SUYO EDSON VApaza Suyo EdsonNoch keine Bewertungen
- Electrica ApazaDokument8 SeitenElectrica ApazaApaza Suyo EdsonNoch keine Bewertungen
- Innovacion Expo 5 Grupo 1Dokument14 SeitenInnovacion Expo 5 Grupo 1Apaza Suyo EdsonNoch keine Bewertungen
- Examen Metafisica II Apaza Suyo Edson AlexanderDokument5 SeitenExamen Metafisica II Apaza Suyo Edson AlexanderApaza Suyo EdsonNoch keine Bewertungen
- Tp5 Proteinas Resumen de Metodos de Purificacion de Proteinas Cromatografia TratamientoDokument9 SeitenTp5 Proteinas Resumen de Metodos de Purificacion de Proteinas Cromatografia TratamientoApaza Suyo EdsonNoch keine Bewertungen
- Resolucion Segunda Eval - Conm.2020-I Apaza SuyoDokument1 SeiteResolucion Segunda Eval - Conm.2020-I Apaza SuyoApaza Suyo EdsonNoch keine Bewertungen
- Tp5 Proteinas Resumen de Metodos de Purificacion de Proteinas Cromatografia TratamientoDokument9 SeitenTp5 Proteinas Resumen de Metodos de Purificacion de Proteinas Cromatografia TratamientoApaza Suyo EdsonNoch keine Bewertungen
- Resumen Video Tajo Abierto Apaza Suyo Edson Alexander v1Dokument5 SeitenResumen Video Tajo Abierto Apaza Suyo Edson Alexander v1Apaza Suyo EdsonNoch keine Bewertungen
- Resolucion Segunda Eval - Conm.2020-I Apaza SuyoDokument1 SeiteResolucion Segunda Eval - Conm.2020-I Apaza SuyoApaza Suyo EdsonNoch keine Bewertungen
- Ensayo Triaxial Consolidado No Drenado (CU) .: IntroduccionDokument3 SeitenEnsayo Triaxial Consolidado No Drenado (CU) .: IntroduccionwilliamNoch keine Bewertungen
- Parcial - Escenario 4 - SEGUNDO BLOQUE-TEORICO - PRACTICO - ERGONOMIA - (GRUPO1) PDFDokument9 SeitenParcial - Escenario 4 - SEGUNDO BLOQUE-TEORICO - PRACTICO - ERGONOMIA - (GRUPO1) PDFGina Paola LopezNoch keine Bewertungen
- Documento ASA Hummel Interpreting Genesis OneDokument13 SeitenDocumento ASA Hummel Interpreting Genesis OneWilmer ZarragaNoch keine Bewertungen
- Plan de Negocio I PARTE - Uva Red GlobeDokument35 SeitenPlan de Negocio I PARTE - Uva Red GlobeEdwin ArroyoNoch keine Bewertungen
- Fundiciones 130327144615 Phpapp02Dokument98 SeitenFundiciones 130327144615 Phpapp02Pedrin Cha OlivosNoch keine Bewertungen
- INFORME FINAL TareaDokument14 SeitenINFORME FINAL TareaEnell Navarro AcostaNoch keine Bewertungen
- 2 SEM Presentación de PowerPointDokument26 Seiten2 SEM Presentación de PowerPointJosé Fernando José FernandoNoch keine Bewertungen
- Funciones VectorialesDokument18 SeitenFunciones VectorialesElvimar YajureNoch keine Bewertungen
- Articulo Hipomineralizacion Inciso MolarDokument6 SeitenArticulo Hipomineralizacion Inciso MolarClaudia Garnica TrujilloNoch keine Bewertungen
- Metrados de CargasDokument11 SeitenMetrados de CargasShirley VasquezNoch keine Bewertungen
- Instant ISOFT ON Ficha TecnicaDokument1 SeiteInstant ISOFT ON Ficha TecnicaSantos Gonzales RuizNoch keine Bewertungen
- Landó y Haene - 1996 - Carpintero Blanco (Melanerpes Candidus) en La ProvDokument3 SeitenLandó y Haene - 1996 - Carpintero Blanco (Melanerpes Candidus) en La ProvJuan UrrutiaNoch keine Bewertungen
- Situacion Actual de La Produccion de Cambur en El Estado AraguaDokument42 SeitenSituacion Actual de La Produccion de Cambur en El Estado AraguaTomasVNoch keine Bewertungen
- La Cultura Fe y RazónDokument10 SeitenLa Cultura Fe y RazónEdgar Alberto Patiño Carmona100% (2)
- Exploracion Fisica Del Recien NacidoDokument2 SeitenExploracion Fisica Del Recien NacidoMariel López NoguedaNoch keine Bewertungen
- Monografía de San Miguel SigüiláDokument2 SeitenMonografía de San Miguel SigüiláJorge MolinaNoch keine Bewertungen
- Generador de Niebla Protect 2200i Protect 1100i Protect 600iDokument27 SeitenGenerador de Niebla Protect 2200i Protect 1100i Protect 600iJose Maria CamberoNoch keine Bewertungen
- El Tratamiento No Invasivo Denominado CriolipólisisDokument1 SeiteEl Tratamiento No Invasivo Denominado CriolipólisisNadia ReineroNoch keine Bewertungen
- Unidad 5 Gorgona y Malpelo - María José LambisDokument23 SeitenUnidad 5 Gorgona y Malpelo - María José LambisDiego A. Bernal B.0% (1)
- Alfonso - Hernandez - Actividad2 AgostoDokument14 SeitenAlfonso - Hernandez - Actividad2 AgostopacoxD :vNoch keine Bewertungen
- Cálculo de PrimasDokument14 SeitenCálculo de PrimasIsmael BPNoch keine Bewertungen
- La BrujulaDokument42 SeitenLa BrujulaFrancisco David Medrano RiveraNoch keine Bewertungen
- 21-22 Tema 3 El Pensamiento de Platón ApuntesDokument15 Seiten21-22 Tema 3 El Pensamiento de Platón ApuntesmcristinaNoch keine Bewertungen
- Proyecto de investigación-EDNA BAQUERODokument25 SeitenProyecto de investigación-EDNA BAQUEROCesar Luis SERRANO CAMPOSNoch keine Bewertungen
- EfedewDokument5 SeitenEfedewMario T.CNoch keine Bewertungen
- Cuenca Del Lago de MaracaiboDokument8 SeitenCuenca Del Lago de Maracaibokenner paterninaNoch keine Bewertungen
- MorfofisiologiaDokument13 SeitenMorfofisiologia¡Hey Soy Patto100% (2)