Beruflich Dokumente
Kultur Dokumente
COLÁGENO
Hochgeladen von
edgarCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
COLÁGENO
Hochgeladen von
edgarCopyright:
Verfügbare Formate
COLÁGENO
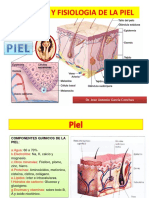
El colágeno es una molécula proteica o proteína que forma fibras, las fibras colágenas. Estas se
encuentran en todos los animales. Son secretadas por las células del tejido conjuntivo como
los fibroblastos, así como por otros tipos celulares. Es el componente más abundante de la piel y de
los huesos, cubriendo un 25 % de la masa total de proteínas en los mamíferos.
Características fisicoquímica
Las fibras colágenas son flexibles, pero ofrecen gran resistencia a la tracción. El punto de rotura de
las fibras colágenas de los tendones humanos se alcanza con una fuerza de varios cientos
de kilogramos por centímetro cuadrado. A esta tensión solamente se han alargado un pequeño
porcentaje de su longitud original.
Cuando el colágeno se desnaturaliza por ebullición y se deja enfriar, manteniéndolo en una solución
acuosa, se convierte en una sustancia muy conocida, la gelatina.
SÍNTESIS DEL COLÁGENO
La fase previa a la formación de colágeno es intracelular: series de tres aminoácidos se ensamblan
en tándem formando cadenas de polipéptidos, llamadas cadenas α (alfa), separadas entre sí a través
de puentes de hidrógeno intramoleculares.
Estas cadenas son muy ricas en prolina, lisina y glicina, fundamentales en la formación de la
superhélice. La hidroxiprolina constituye alrededor de un 10 a 12 % de todos los residuos
aminoacídicos del colágeno, dependiendo dicho porcentaje del tipo de colágeno. La forma química
más abundante de la hidroxiprolina que forma parte del colágeno es la 4-trans-OH-L-prolina. Cada
cadena tiene un peso molecular de alrededor de 100 000 Da y es levógira (gira hacia la izquierda).
Tres de estas cadenas alfa (no hélices alfa) se ensamblan para formar una molécula de procolágeno
en forma de triple espiral que se secreta al espacio extracelular donde se transforma en
tropocolágeno, un colágeno ya maduro. Este monómero mide alrededor de 300 nanómetros de
largo y 1,4 nm de diámetro. Las tres cadenas se enrollan y se fijan mediante enlaces transversales
para formar una triple hélice dextrógira con una distancia entre las vueltas de 8,6 nanómetros.
La triple hélice se mantiene unida entre sí debido a puentes de hidrógeno, que afectan
aproximadamente a 2/3 de cada cadena alfa. Además, los tropocolágenos se unen entre sí por
medio de enlaces entre algunos aminoácidos específicos (como por ejemplo la lisina), llamados
"crosslinkings" o entrecruzamientos, que favorecen la consolidación de las fibrillas de colágeno.
En el espacio extracelular varias moléculas de tropocolágeno se asocian a través de enlaces
entrecruzados formando fibrillas y fibras. Una vez transportada fuera de la célula se produce el
fenómeno de alineación y maduración de las moléculas a tropocolágeno en un proceso denominado
fibrogénesis. Esta maduración no consiste sino en el fortalecimiento de los cruces intermoleculares
y de ello dependen directamente las características mecánicas de cada tejido conjuntivo.1
FORMACIÓN DEL COLÁGENO
Cada una de las cadenas polipeptídicas es sintetizada por los ribosomas unidos a la membrana
del retículo endoplásmico y luego son traslocadas al lumen del mismo en forma de grandes
precursores (procadenas α), presentando aminoácidos adicionales en los extremos amino y
carboxilo terminales. En el retículo endoplásmico los residuos de prolina y lisina son hidroxilados
para luego algunos ser glucosilados en el aparato de Golgi; parece ser que estas hidroxilaciones son
útiles para la formación de puentes de hidrógeno intercatenarios que ayudan a la estabilidad de la
superhélice.
Tras su secreción, los propéptidos de las moléculas de procolágeno son degradados
mediante proteasas convirtiéndolas en moléculas de tropocolágeno asociándose en el espacio
extracelular formando las fibrillas de colágeno.
La formación de fibrillas está dirigida, en parte, por la tendencia de las moléculas de procolágeno a
autoensamblarse mediante enlaces covalentes entre los residuos de lisina, formando un
empaquetamiento escalonado y periódico de las moléculas de colágeno individuales en la fibrilla.
DEFECTOS EN LA SÍNTESIS DE COLÁGENO
Las siguientes enfermedades están causadas por defectos en la correcta síntesis del colágeno que
conducen a alteraciones en su estructura.
Síndrome de Ehlers-Danlos. Se trata de un grupo de al menos 10 enfermedades que tienen en
común síntomas de debilidad estructural en el tejido conjuntivo, relacionados con fragilidad e
hiperextensibilidad de la piel y con la hipermovilidad en la articulaciones.2
Osteogénesis imperfecta. Es un grupo de cuatro enfermedades que se caracterizan por fracturas
múltiples que dan lugar a deformaciones óseas.2
Escorbuto. El escorbuto es una avitaminosis causada por un déficit de vitamina C (ácido ascórbico)
en la dieta que causa una disminución en la síntesis de hidroxiprolina debido a que la prolil
hidroxilasa requiere ácido ascórbico. La hidroxiprolina proporciona átomos adicionales capaces de
formar puentes de hidrógeno que estabilizan la triple hélice de colágeno.2
Síndrome del cuerno occipital o cutis laxa. Una deficiencia en la actividad de la lisil oxidasa da lugar
a defectos en la formación de enlaces cruzados que originan una piel laxa y blanda y a la aparición
durante la adolescencia de cuernos occipitales óseos.2
Distrofia muscular congénita de Ullrich. Enfermedad congénita grave que provoca debilidad
muscular por déficit del colágeno VI.3
FUNCIÓN
Las fibras de colágeno forman estructuras que resisten las fuerzas de tracción. Su diámetro en los
diferentes tejidos es muy variable y su organización también; en la piel de los mamíferos están
organizadas como cestos de mimbre, lo que permite la oposición a las tracciones ejercidas desde
múltiples direcciones. En los tendones lo están en haces paralelos que se alinean a lo largo del eje
principal de tracción. En el tejido óseo adulto y en la córnea se disponen en láminas delgadas y
superpuestas, paralelas entre sí, mientras las fibras forman ángulo recto con las de las capas
adyacentes.
Las células interactúan con la matriz extracelular tanto mecánica como químicamente, lo que
produce notables efectos sobre la arquitectura tisular. Así, distintas fuerzas actúan sobre las fibrillas
de colágeno que se han secretado, ejerciendo tracciones y desplazamientos sobre ellas, lo que
provoca su compactación y su estiramiento.
Das könnte Ihnen auch gefallen
- ColágenoDokument3 SeitenColágenoVICTOR ARAVENANoch keine Bewertungen
- Biosíntesis Del TropocolágenoDokument1 SeiteBiosíntesis Del TropocolágenoErick Herrera Teran100% (1)
- TIPOS de ColagenoDokument3 SeitenTIPOS de ColagenoLandero Rodríguez Aldo MaximilianoNoch keine Bewertungen
- Colágeno y ElastinaDokument4 SeitenColágeno y ElastinaElizabeth Rodríguez LatininaNoch keine Bewertungen
- Los Desmosomas Son Estructuras Celulares Que Mantienen Adheridas A Células Vecinas PDFDokument9 SeitenLos Desmosomas Son Estructuras Celulares Que Mantienen Adheridas A Células Vecinas PDFLeonardo Padilla SolísNoch keine Bewertungen
- Generalidades de Tejido AdiposoDokument26 SeitenGeneralidades de Tejido AdiposoThelma Irene Avitia Ramìrez100% (1)
- Bioquimica ColagenoDokument21 SeitenBioquimica ColagenoGabby IdrovoNoch keine Bewertungen
- Vademecum Laboratorio ZineDokument21 SeitenVademecum Laboratorio ZineBelen Sosa100% (1)
- Glándula SebáceaDokument4 SeitenGlándula SebáceaJamir NaranjoNoch keine Bewertungen
- Colágeno y ElastinaDokument6 SeitenColágeno y ElastinaSole Karyna100% (1)
- 8 Introducción A MetabolismoDokument18 Seiten8 Introducción A MetabolismoJasna ZovakNoch keine Bewertungen
- ColágenoDokument27 SeitenColágenoDaniela RomosNoch keine Bewertungen
- Qué Es Exactamente La QueratinaDokument6 SeitenQué Es Exactamente La QueratinaMaria ChNoch keine Bewertungen
- TesisDokument45 SeitenTesisGabriel SemajNoch keine Bewertungen
- EXPOSICION Matriz ExtracelularDokument38 SeitenEXPOSICION Matriz ExtracelularJuan Pablo Ramirez GutierrezNoch keine Bewertungen
- CelulitisDokument2 SeitenCelulitismaria acostaNoch keine Bewertungen
- APARATOLOGIADokument3 SeitenAPARATOLOGIAGabriela HerreraNoch keine Bewertungen
- 174 Embriologia de La EpidermisDokument27 Seiten174 Embriologia de La EpidermisCarmen Gloria Gajardo HerreraNoch keine Bewertungen
- Tejido Adiposo PDF Clasificacion AnatomiaDokument7 SeitenTejido Adiposo PDF Clasificacion AnatomiaVikttoria Di DrtNoch keine Bewertungen
- Manual Hidrofacial 7 en 1Dokument15 SeitenManual Hidrofacial 7 en 1Electronica Analogica Y DigitalNoch keine Bewertungen
- 3 Matriz ExtracelularDokument18 Seiten3 Matriz ExtracelularTony VillacortaNoch keine Bewertungen
- Cosmética AntiarrugasDokument4 SeitenCosmética AntiarrugasCristina Torrecilla AlisteNoch keine Bewertungen
- Piel perfecta dermatología estètica extrema curso completo paso a paso: Cuida tu piel perfecta dermatología estètica de la piel extrema curso completo paso a pasoVon EverandPiel perfecta dermatología estètica extrema curso completo paso a paso: Cuida tu piel perfecta dermatología estètica de la piel extrema curso completo paso a pasoNoch keine Bewertungen
- Bioquimica - ColagenoDokument18 SeitenBioquimica - ColagenoEstefaniaNoch keine Bewertungen
- Nutricion Celular Con IontoforesisDokument13 SeitenNutricion Celular Con IontoforesisMaria AcostaNoch keine Bewertungen
- Sistema EndocrinoDokument12 SeitenSistema EndocrinoKimmi LoayzaNoch keine Bewertungen
- LA PIEL Dra - Jenniffer ChaconDokument10 SeitenLA PIEL Dra - Jenniffer ChaconKarla BuinitzkyNoch keine Bewertungen
- Célula AdiposaDokument1 SeiteCélula AdiposaCarla Silvana Alvarado CostaNoch keine Bewertungen
- Anatomía de La Piel ApuntesDokument3 SeitenAnatomía de La Piel ApuntesAlejandra BustosNoch keine Bewertungen
- Dermis Epidermis HipodermisDokument6 SeitenDermis Epidermis HipodermisRiChard Oc GomNoch keine Bewertungen
- Exposicion Tejido ConectivoDokument33 SeitenExposicion Tejido ConectivoRaul Ortega100% (1)
- Cambios en La Piel de Embarazadas PDFDokument8 SeitenCambios en La Piel de Embarazadas PDFYuri Yoel Rodriguez RojasNoch keine Bewertungen
- CELULITIS R.Ferradas SintesisDokument9 SeitenCELULITIS R.Ferradas SintesisVikttoria Di DrtNoch keine Bewertungen
- Proteinas FibrosasDokument13 SeitenProteinas FibrosasdianaNoch keine Bewertungen
- Que Son Las EnzimasDokument12 SeitenQue Son Las EnzimasManuel Alejandro Suarez RobletoNoch keine Bewertungen
- Permeabilidad CutaneaDokument35 SeitenPermeabilidad Cutanealevis bolivar100% (1)
- Tarea 2Dokument8 SeitenTarea 2Omar A. RinconNoch keine Bewertungen
- Piel y Termorregulación PDFDokument60 SeitenPiel y Termorregulación PDFRosannaCedolinNoch keine Bewertungen
- Piel Gruesa y Delgada HistologiaDokument22 SeitenPiel Gruesa y Delgada HistologiadavidNoch keine Bewertungen
- Anatomia y Fisiologia de La PielDokument70 SeitenAnatomia y Fisiologia de La Pielwinstonmaldonado16100% (6)
- Matrix Extracelular y Membrana BasalDokument52 SeitenMatrix Extracelular y Membrana BasalMariaLourdesGarciaNoch keine Bewertungen
- 3-Anatomia de La Piel-Curso de SuturasDokument55 Seiten3-Anatomia de La Piel-Curso de SuturasVianel VenturaNoch keine Bewertungen
- 4 Anatomia y Fisiologia de La PielDokument20 Seiten4 Anatomia y Fisiologia de La PielconchasmedNoch keine Bewertungen
- Capas de La Piel.Dokument2 SeitenCapas de La Piel.Susana HerreraNoch keine Bewertungen
- Principios ActivosDokument2 SeitenPrincipios ActivosAngie Flores100% (1)
- Las Células y Su Contexto SocialDokument27 SeitenLas Células y Su Contexto SocialRocio Rosas LópezNoch keine Bewertungen
- Formulas 2Dokument12 SeitenFormulas 2Plasticos CapriNoch keine Bewertungen
- Estructura de La PielDokument5 SeitenEstructura de La PielCarlos R. Navarrete CortezNoch keine Bewertungen
- Composicion Quimica de La Piel PDFDokument56 SeitenComposicion Quimica de La Piel PDFEditar En La Vida100% (1)
- PielDokument3 SeitenPielOmar GtzNoch keine Bewertungen
- Las 3 Capas de La PielDokument5 SeitenLas 3 Capas de La Pielsandra porrasNoch keine Bewertungen
- MetioninaDokument2 SeitenMetioninaNicol DuranNoch keine Bewertungen
- Desarrollo y Estructura de La PielDokument14 SeitenDesarrollo y Estructura de La PielAlba Noemi MorenoNoch keine Bewertungen
- Tema 2 PielDokument37 SeitenTema 2 PielAngela Navarro Michel100% (1)
- TEMA 6 Anatomia de La EpidermisDokument16 SeitenTEMA 6 Anatomia de La EpidermisMaría Alejandra Aznate HernándezNoch keine Bewertungen
- AdipogenesisDokument2 SeitenAdipogenesisVerónica Di Nino HernandezNoch keine Bewertungen
- Estetopatologías (Capas de La Piel)Dokument24 SeitenEstetopatologías (Capas de La Piel)Leticia ZavaletaNoch keine Bewertungen
- Química de LípidosDokument38 SeitenQuímica de LípidosJIMMY HUMBERTO IZA IZANoch keine Bewertungen
- Musculos VoluntariosDokument2 SeitenMusculos VoluntariossandraNoch keine Bewertungen
- Tegumentos - PielDokument103 SeitenTegumentos - PielValentina VallejoNoch keine Bewertungen
- Silabas Tonicas - Miss Sandra PDFDokument2 SeitenSilabas Tonicas - Miss Sandra PDFedgarNoch keine Bewertungen
- Vision y Mision CataDokument2 SeitenVision y Mision CataedgarNoch keine Bewertungen
- Informe 02 Microsoft FlowDokument5 SeitenInforme 02 Microsoft FlowedgarNoch keine Bewertungen
- Bioelectricidad UsmpDokument42 SeitenBioelectricidad UsmpedgarNoch keine Bewertungen
- Guía de Seminario SPI 2019-IIDokument21 SeitenGuía de Seminario SPI 2019-IIedgarNoch keine Bewertungen
- Alcohol DeshidrogenasaDokument1 SeiteAlcohol DeshidrogenasaedgarNoch keine Bewertungen
- Seminario Fisica Tension Superficial y Presion AlveolarDokument21 SeitenSeminario Fisica Tension Superficial y Presion AlveolaredgarNoch keine Bewertungen
- Instituto Tecnologico de ComitancilloDokument16 SeitenInstituto Tecnologico de ComitancilloKELLY PEREZNoch keine Bewertungen
- AaDokument77 SeitenAaANGIE ARLETTE HIDALGO APAZANoch keine Bewertungen
- PLAQUETASDokument47 SeitenPLAQUETASsofiaNoch keine Bewertungen
- Tema 3Dokument53 SeitenTema 3luis rodriguezNoch keine Bewertungen
- Metabolismo de Los LípidosDokument16 SeitenMetabolismo de Los LípidosHEALTH CARE AMBULANCIAS S.A.S.Noch keine Bewertungen
- Rosas Hernández Valeria, CuestionarioDokument5 SeitenRosas Hernández Valeria, CuestionarioVale ZanahoriasNoch keine Bewertungen
- InfografíaDokument1 SeiteInfografíaArianna ErazoNoch keine Bewertungen
- Academia - BIOLOGÍA - RESPIRACIÓN CELULAR - SEMESTRAL SM - OFICIAL 1Dokument10 SeitenAcademia - BIOLOGÍA - RESPIRACIÓN CELULAR - SEMESTRAL SM - OFICIAL 1lucioNoch keine Bewertungen
- Replicación de ADNDokument3 SeitenReplicación de ADNNICOLNoch keine Bewertungen
- Aminoacidos y PeptidosDokument22 SeitenAminoacidos y PeptidosNoelia Alfonsina Montero VacaNoch keine Bewertungen
- Clase 09 - Respiracion CelularDokument34 SeitenClase 09 - Respiracion CelularLivia NinaNoch keine Bewertungen
- Ayuno ProlongadoDokument5 SeitenAyuno ProlongadogussysfrisoNoch keine Bewertungen
- Características Ultraestructurales y Morfología de Los VirusDokument26 SeitenCaracterísticas Ultraestructurales y Morfología de Los VirusNayely Miguel100% (1)
- Evaluacion de La Capacidad Fermentativa de Las LevadurasDokument15 SeitenEvaluacion de La Capacidad Fermentativa de Las LevadurasManuel Lozada GaytanNoch keine Bewertungen
- Print Quiz - Enzimas (Biología - Preguntas y Respuestas)Dokument3 SeitenPrint Quiz - Enzimas (Biología - Preguntas y Respuestas)Robby RobitzhitoNoch keine Bewertungen
- 03 Metabolismo de Los LípidosDokument3 Seiten03 Metabolismo de Los LípidosRosali CabreraNoch keine Bewertungen
- Glucólisis y Oxidación Del PiruvatoDokument32 SeitenGlucólisis y Oxidación Del PiruvatoCarlosAntonioMaldonadoNoch keine Bewertungen
- Practica 3 - Desnaturalizando ProteinasDokument11 SeitenPractica 3 - Desnaturalizando ProteinasOscar Eduardo Cotto Yepez0% (1)
- Copia de NUTRICION05092022Dokument84 SeitenCopia de NUTRICION05092022mari vNoch keine Bewertungen
- Glosario de Introducción A La Genètica MolecularDokument2 SeitenGlosario de Introducción A La Genètica MolecularLisseth Carolina Loayza FeijoóNoch keine Bewertungen
- 3 Replicación y Mecanismos de Reparación Del ADN (2021 PS) - Clase 3Dokument173 Seiten3 Replicación y Mecanismos de Reparación Del ADN (2021 PS) - Clase 3KATALINA IGNACIA AZÓCARNoch keine Bewertungen
- Cinética EnzimáticaDokument14 SeitenCinética EnzimáticaSERGIO GUERRERONoch keine Bewertungen
- Informe Practica 3. FisicoquimicaDokument6 SeitenInforme Practica 3. Fisicoquimicabryan smithNoch keine Bewertungen
- Si AG de La Reacción ADokument14 SeitenSi AG de La Reacción AVíctor Buendía AyllónNoch keine Bewertungen
- Respuestas Consolida 2 Semana 2Dokument3 SeitenRespuestas Consolida 2 Semana 2Ignacio GonzálezNoch keine Bewertungen
- Cuestionario de La Célula-HistologíaDokument2 SeitenCuestionario de La Célula-HistologíaSr LizerniyerNoch keine Bewertungen
- Acidos NucleicosDokument57 SeitenAcidos NucleicosMilagros AguilarNoch keine Bewertungen
- La Membrana PlasmáticaDokument2 SeitenLa Membrana PlasmáticaAngel RodriguezNoch keine Bewertungen
- Calcio, Fósforo, Magnesio y Vitamina D en La Producción de EquinosDokument46 SeitenCalcio, Fósforo, Magnesio y Vitamina D en La Producción de EquinosRuben Madariaga100% (2)
- Protocolodeaplicaciónmesoterapia Byo SenDokument7 SeitenProtocolodeaplicaciónmesoterapia Byo SendaphneNoch keine Bewertungen