Beruflich Dokumente
Kultur Dokumente
Inhibición Enzimática de La Deshidrogenada Succiníca Del Hígado
Hochgeladen von
Eliecer Gonzalez0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
583 Ansichten5 SeitenEste documento describe un experimento para determinar la capacidad inhibidora de diferentes inhibidores enzimáticos sobre la deshidrogenasa succínica del hígado de pollo. Se utilizaron malonato de sodio, azida de sodio y cianuro de sodio como inhibidores. Los resultados mostraron que el malonato inhibió más la enzima, aunque teóricamente el cianuro es más efectivo. También se observó que elevar la temperatura redujo más la actividad enzimática que mantenerla a temperatura ambiente.
Originalbeschreibung:
inhibicion enzimatica de la deshidrogenasa succinica del higado
Copyright
© © All Rights Reserved
Verfügbare Formate
DOCX, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenEste documento describe un experimento para determinar la capacidad inhibidora de diferentes inhibidores enzimáticos sobre la deshidrogenasa succínica del hígado de pollo. Se utilizaron malonato de sodio, azida de sodio y cianuro de sodio como inhibidores. Los resultados mostraron que el malonato inhibió más la enzima, aunque teóricamente el cianuro es más efectivo. También se observó que elevar la temperatura redujo más la actividad enzimática que mantenerla a temperatura ambiente.
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
583 Ansichten5 SeitenInhibición Enzimática de La Deshidrogenada Succiníca Del Hígado
Hochgeladen von
Eliecer GonzalezEste documento describe un experimento para determinar la capacidad inhibidora de diferentes inhibidores enzimáticos sobre la deshidrogenasa succínica del hígado de pollo. Se utilizaron malonato de sodio, azida de sodio y cianuro de sodio como inhibidores. Los resultados mostraron que el malonato inhibió más la enzima, aunque teóricamente el cianuro es más efectivo. También se observó que elevar la temperatura redujo más la actividad enzimática que mantenerla a temperatura ambiente.
Copyright:
© All Rights Reserved
Verfügbare Formate
Als DOCX, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 5
UNIVERSIDAD AUTÓNOMA DE CHIRIQUÍ INHIBICIÓN ENZIMÁTICA DE LA
DESHIDROGENASA SUCCINÍCA DEL
FACULTAD DE CIENCIAS NATURALES Y
HÍGADO
EXACTAS
Resumen
ESCUELA DE QUÍMICA Esta experiencia se realizó con la finalidad de
determinar la capacidad inhibidora que
presentan los diferentes tipos de inhibidores, en
este caso se utilizó malonato de sodio, azida de
sodio y cianuro de sodio. La enzima en estudio
INFORME DE LABORATORIO fue la deshidrogenasa succínica, es una enzima
INHIBICIÓN ENZIMÁTICA DE LA que se encuentra asociado a la membrana
DESHIDROGENASA SUCCINÍCA DEL interna de la mitocondria; en este laboratorio la
HÍGADO fuente de mitocondrias fue el hígado de pollo. El
sustrato en este caso es el succinato de sodio
0.2M. Se dispusieron de seis tubos de ensayo
en los cuales se agregó la misma cantidad de
homogenizado (enzima), amortiguador y azul de
metileno variando entonces sustrato, agua
PRESENTADO POR
destilada agregada y los inhibidores de azida,
SHARON CUBAS malonato y cianuro de sodio. En los tubos que
contenían los inhibidores de malonato, azida y
(4-782-2072)
cianuro de sodio se obtuvo un tiempo de
decoloración de 15.00, 15.18 y >15.30 minutos
respectivamente y para los tubos que no
ESTEBAN ARJONA
contenía sustrato, y que contenían el
(4-779-2316) homogenizado a temperatura ambiente y a 52°C
se obtuvo que en el primer caso no se observó
cambios en la coloración; en el segundo caso se
observó una decoloración a los 11.25 minutos y
por último en el caso del homogenizado a 52°C
se obtuvo un tiempo de 10.58 minutos. Con los
PROFESORA resultados se infiere que el inhibidor que
Mgtra. ALBERTINA MONTENEGRO presentó mejor inhibición de la actividad
enzimática experimentalmente fue el malonato,
sin embargo teóricamente se sabe que el
cianuro es un inhibidor altamente efectivo. Por
otro lado se observó el efecto que ejerce la
temperatura sobre la actividad enzimática,
debido que se observó una mayor disminución
de la actividad al someter el homogenizado a
23 DE MAYO DE 2017 una temperatura de 52°C comparado al
homogenizado que se encontraba a temperatura
ambiente. Podemos concluir que la activad
enzimática puede verse afectada en una
disminución de sus funciones enzimáticas, de metileno que al cambiar su estado redox pasa
debido al efecto de pH, temperatura y también de coloreado a incoloro o viceversa. (González,
podrá verse afecta por la presencia de 2010) explica que la coloración de la oxidación y
inhibidores. reducción del azul de metileno al cambiar su
estado redox.
Objetivos Acción de los inhibidores
Analizar la importancia de los inhibidores Los inhibidores son sustancias que impiden la
enzimáticos. actividad de las enzimas por combinarse con
Resaltar el mecanismo de inhibición enzimática radicales indispensables para el funcionamiento
sobre la deshidrogenasa succínica. enzimático o por ser agentes desnaturalizantes.
Explicar el mecanismo de acción de los El inhibidor posee una estructura similar a la del
inhibidores empleados. sustrato y compite por situarse en el sitio del
sustrato para formar un complejo enzima-
Introducción inhibidor, disociable, dificultando la formación
Una oxidorreductasa es una enzima que cataliza del complejo enzima-sustrato y por lo tanto la
la transferencia de electrones desde una actividad enzimática. La enzima no tiene acción
molécula donante (el agente reductor) a otra sobre el inhibidor, ni el inhibidor competitivo
aceptora (el agente oxidante). Según desnaturaliza a la enzima; sólo impide su
(González, 2010) nos dice que las enzimas función. (Alvarado, 2013).
oxidorreductasas catalizan reacciones de
oxidorreducción, es decir, transferencia de Ejemplo de ello es la Deshidrogenasa succínica
hidrógeno (H) o electrones (e-) de un sustrato a en presencia de succinato y de un aceptor de
otro, según la reacción general: hidrógenos adecuado, convierte el succinato en
fumarato y reduce simultáneamente el aceptor
de H.
Factores que afectan a la actividad enzimática
Diferentes factores ambientales pueden afectar
a la actividad enzimática. Como lo son el pH, la
Figura 1. Reacción general para de óxido reducción temperatura y la presencia de inhibidores.
de la succinato deshidrogenasa.
Materiales y reactivos
De acuerdo con (Sierra, 2013) dice que las Solución amortiguadora de fosfato monobásico
células de la gran mayorías de los organismos de sodio 0.1M de pH 7.4, agua destilada,
vivos llevan a cabo un conjunto de reacciones malonato de sodio 0.1M, succinato de sodio
de óxido reducción mediante la cual la gran 0.2M, azida de sodio 0.1M, cianuro de sodio
cantidad de energía liberada a través de la 0.1M, hígado fresco, acetona, gradillas, tubos de
degradación de moléculas orgánicas es ensayo, licuadora, vasos químicos (100-250ml),
almacenada en moléculas de alto nivel varillas de vidrio, micropipetas Labmate de
energético (ATP). La succinato deshidrogenasa 100/1000 µL, baño termostático.
es una enzima clasificada dentro del grupo de
las oxidorreductasas, cataliza una reacción muy Procedimiento
importante en el metabolismo oxidativo de la I. Se cortó una porción de 50 g de hígado fresco
célula: la conversión del succinato en fumarato. en trozos pequeños y se homogenizó en una
Esta enzima se localiza en eucariontes en la licuadora con 100 mL de agua destilada.
II. Se midió 40 mL del homogenizado y se diluyó
membrana mitocondrial interna. El H2 cedido
hasta 200mL de agua destilada. Se agitó la
por el succinato puede ser transferido del mezcla vigorosamente.
FADH2 a un colorante susceptible como el azul
III. Se dispusieron de 6 tubos de ensayo en los oxidorreductasas, cataliza una reacción muy
cuales se les añadió las siguientes cantidades importante en el metabolismo oxidativo de la
de reactivos en mL, como se muestra a célula: la conversión del succinato en fumarato.
continuación: Esta enzima se localiza en eucariontes en la
Tubo 1 2 3 4 5 6 membrana mitocondrial interna. El H2 cedido por
Amortiguador 0.5 0.5 0.5 0.5 0.5 0.5
el succinato puede ser transferido del FADH2 a
Sustrato 0.0 0.5 0.5 0.5 0.5 0.5
Agua un colorante susceptible como el azul de
1.0 0.5 0.5 0.0 0.0 0.0 metileno que al cambiar su estado redox pasa
destilada
Azul de de coloreado a incoloro o viceversa.
1.0 1.0 1.0 1.0 1.0 1.0
metileno
Malonato de
- - - 0.5 - -
sodio
Azida de sodio - - - - 0.5 -
Cianuro de
- - - - - 0.5
sodio
homogenizado 1.0 1.0 1.0 1.0 1.0 1.0
IV. El homogenizado se agregó de último. El
homogenizado correspondiente al tubo 3 se
calentó previamente a una temperatura de 52°C
por 15 minutos. Figura 3. Reacción entre la succinato
deshidrogenasa y el azul de metileno.
V. Todos los tubos se agitaron y se les adicionó
5 gotas de aceite mineral a cada uno (para evitar En los resultado del tubo 1 como podemos
interferencia ocasiona por el oxígeno del aire).
observar no hubo reacción ya que no contenía
sustrato además de que era nuestra sustancia
VI. Se pusieron posteriormente los tubos en un
baño de agua a temperatura de 36°C, se blanco por lo tanto no hubo inhibición. Por lo
observaron los cambios en los diferentes tubos tanto no pudo realizar su conversión de
y se registró el tiempo en que se decoloraban. succinato a fumarato.
En el tubo 2 podemos observar una
Resultados y discusión
Cuadro 1. Datos obtenidos en el tiempo de decoloración el cual nos indica que hubo
decoloración de cada tubo de ensayo. inhibición la cual se dio al cabo 11.25min, los
que nos señala que succinato deshidrogenada
pudo realizar la conversión de succinato a
fumarato. Según (Walla, 2000). esto se logra
removiendo 2H+ y 2 electrones del succinato
para formar fumarato y la coenzima reducida
(FADH2), en este caso la enzima
deshidrogenada succínica reduce al azul de
metileno, ya que este actúa como aceptor y el
azul de metileno reducido es incoloro.
En el tubo 3 podemos observar una
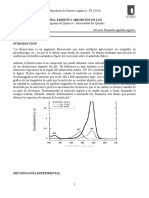
Figura 2. Decoloración de la enzima deshidrogenasa decoloración por lo tanto nos asegura que hubo
succínica, por efecto de temperatura e inhibidores. inhibición la cual se dio al cabo de 10.58
minutos, cabe señalar que esta reacción fue la
La succinato deshidrogenasa es una enzima más rápida debido a que se le agrega calor
clasificada dentro del grupo de las calentándolo previamente a temperatura de
520C lo cual un aumento de la temperatura Y por último en el tubo 6 se observó que no hubo
provoca un aumento en la velocidad de una decoloración por lo tanto no hubo actividad
reacción. Se utiliza azul de metileno porque es inhibidora en el tiempo estipulado. Sin embargo
un indicador redox apropiado para estas el cianuro es un inhibidor más efectivo según
funcione. Se trata de una sustancia de color azul (Stryer, 2003). Se puede deducir que no hubo
en su forma oxidada, que al aparecer átomos de una actividad inhibidora debido a que no se le
hidrógenos del sustrato originan la forma leuco, dejo reaccionar por más tiempo. La función del
la cual es incolora (Marks, 2006). cianuro como inhibidor es actuar sobre el Hemo
a3 de la citocromooxidasa impidiendo su
En el tubo 4 hubo inhibición debido a que hubo
interacción con el oxígeno.
una decoloración al cabo de 15 min. El malonato
es un inhibidor de la respiración celular, porque Conclusiones:
se une al sitio activo de la succinato Por medio de la reacción de oxidación
deshidrogenasa en el ciclo del ácido cítrico, pero producida entre la deshidrogenasa y el azul
no reacciona, compitiendo con el succinato. En de metileno, que es un indicador redox
la reacción de fosforilación oxidativa, el apropiado para homogenizados de tejidos,
malonato es un inhibidor del complejo II que, se pudo evidenciar la actividad enzimática
nuevamente, contiene succinato que presenta la deshidrogenasa succínica
deshidrogenasa. El malonato es un inhibidor frente al efecto de la temperatura y a la
presencia de sustancias inhibidoras como el
competitivo de la deshidrogenasa succínica, de
malonato, azida y cianuro de sodio.
tal manera que la presencia de malonato detiene
Podemos concluir que la actividad
el ciclo de Krebs. La reacción que cataliza la
enzimática es de gran importancia debido a
enzima es la de deshidrogenar al succinato para que estudia la velocidad de las reacciones
producir fumarato y FADH2. Detener el ciclo de catalizadas por enzimas. Por lo que nos
Krebs implica parar la cadena respiratoria y por proporcionan información directa acerca del
lo tanto la maquinaria de producción de ATP. mecanismo de la reacción catalítica y de la
especificidad del enzima.
Cuando ocurre la inhibición de una enzima que
Inferimos que la velocidad de reacción
se encuentra dentro de una determinada vía
observada en la reacción de oxidación del
metabólica, el sustrato de la enzima tiende a azul de metileno y la deshidrogenasa
acumularse, ya que no puede ser transformado succínica es la velocidad máxima de
en un producto, (Gonzales, 2010). reacción, es decir, la velocidad en que se da
En el tubo 5 se observa una decoloración al cabo la aparición de los productos o la
desaparición de los reactivos.
de 15.18 min lo cual no indica que hubo reacción
A través de los mecanismo de la acción
o inhibición. Las azidas afectan a la cadena
enzimática se puede aceleran la obtención
respiratoria. Son substancias que se enlazan a del equilibrio en un tiempo menor como
alguno de los componentes de la cadena de también la reacción ocurre de acuerdo al
transporte de electrones bloqueando su número de moléculas con suficiente energía
capacidad para cambiar de una forma reversible cinética y adecuada orientación para
desde la forma oxidada a la forma reducida y sobrepasar la energía de activación de la
viceversa. reacción.
Esta inhibición resulta en una acumulación de Bibliografía:
los componentes en sus formas reducidas antes -Alvarado, S. (2013). Bioquímica II. Recuperado
del punto de inhibición, y la presencia de las el 21 de mayo de 2017 de
formas oxidadas de los componentes de la http://quimicosfarmacobiologos.bligoo.com.mx/
Cadena de Transporte de Electrones después media/users/10/523320/files/51871/Ma.
del punto de inhibición.
-González, J. (2010). Clasificación de las
enzimas. Recuperado el 21 de mayo de 2017 de:
http://www.ehu.eus/biomoleculas/enzimas/enz1
3.htm#c1
-González, M. (2010). Química. Indicador redox.
Recuperado el 07 de noviembre de 2015 de:
http://quimica.laguia2000.com/conceptos-
basicos/indicador-redox.
-Marks, R., Collen S. & Lieberman, M. (2006).
BIOQUIMICA BASICA. Un enfoque clínico.
España: Mcgraw-hills. Interamericana.
-Sierra, K. (2013). Actividad enzimática.
Recuperado el 21 de mayo de 2017 de
http://www.medicina.uat.edu.mx/bioquimica/enz
imas/Enzimas_y_coenzimas2.html
-Stryer, L. (2003). Bioquímica. México: Ed.
Reverté.
-Walla, M. Marchuk, D. (2000). Activated
enzymatic: Identificacion de alfa-amilasa salival.
2aed. España: Lancet.
Das könnte Ihnen auch gefallen
- Lab 7. INHIBICIÓN ENZIMÁTICA DE LA DESHIDROGENADA SUCCINÍCA DEL HÍGADODokument5 SeitenLab 7. INHIBICIÓN ENZIMÁTICA DE LA DESHIDROGENADA SUCCINÍCA DEL HÍGADOEliecer GonzalezNoch keine Bewertungen
- Lab 9. Deshidrogenasa Del Hígado.Dokument5 SeitenLab 9. Deshidrogenasa Del Hígado.Sharon Dayan Cubas0% (1)
- Antecedentes 2Dokument3 SeitenAntecedentes 2Julio Cesar FeruizNoch keine Bewertungen
- Practica 3 Fermentacion EtanolicaDokument6 SeitenPractica 3 Fermentacion EtanolicaVanessa RomeroNoch keine Bewertungen
- Aislamiento de Glucogeno..Dokument4 SeitenAislamiento de Glucogeno..Yaney Yulei BrownNoch keine Bewertungen
- Gemacion de LevadurasDokument6 SeitenGemacion de LevadurasMay YotmoreNoch keine Bewertungen
- Informe Sintesis de Cloruro de TerbutiloDokument4 SeitenInforme Sintesis de Cloruro de TerbutiloDario75% (4)
- Practica 6. Determinacion Del Coeficiente de Particion Del Salicilato de SodioDokument6 SeitenPractica 6. Determinacion Del Coeficiente de Particion Del Salicilato de SodioKevin Alexis Madrigal HernandezNoch keine Bewertungen
- Sintesis de Acido BenzoicoDokument4 SeitenSintesis de Acido BenzoicocarolinaNoch keine Bewertungen
- Práctica 2 Sintesis de BenzalacetofenonaDokument2 SeitenPráctica 2 Sintesis de BenzalacetofenonaJason Téllez AndradeNoch keine Bewertungen
- Informe de Laboratorio 2 CorregidoDokument7 SeitenInforme de Laboratorio 2 CorregidoDome VásconezNoch keine Bewertungen
- Práctica 7 - Extracción y Análisis de Líídos de Yema de HuevoDokument13 SeitenPráctica 7 - Extracción y Análisis de Líídos de Yema de HuevoUsui TakumiNoch keine Bewertungen
- ¿Se Puede Detectar La Prescencia de Azucares Reductores Por La Reaccion de TrommerDokument1 Seite¿Se Puede Detectar La Prescencia de Azucares Reductores Por La Reaccion de TrommerSheila CruzNoch keine Bewertungen
- Practica de Formación de OsazonasDokument10 SeitenPractica de Formación de OsazonasPabloNoch keine Bewertungen
- BenzoínaDokument13 SeitenBenzoínadany_289Noch keine Bewertungen
- Aldehidos y CetonasDokument25 SeitenAldehidos y CetonasBrayan RodriguezNoch keine Bewertungen
- Ejercicio para El Parcial de Quimica OrgánicaDokument3 SeitenEjercicio para El Parcial de Quimica OrgánicaAutumn Falls0% (1)
- PRACTICA 7 CuestionarioDokument6 SeitenPRACTICA 7 CuestionarioALEJANDRO ALVARADONoch keine Bewertungen
- Aldehidos-Y-Cetonas-Informe 7...Dokument13 SeitenAldehidos-Y-Cetonas-Informe 7...Cristian BallaNoch keine Bewertungen
- Info 1Dokument1 SeiteInfo 1Kassandra Balbuena MadridNoch keine Bewertungen
- Informe Resultados. Cuantitativa Carbohidratos FINALDokument4 SeitenInforme Resultados. Cuantitativa Carbohidratos FINALANDRÉS STEVEN ÁLVAREZ GONZÁLEZNoch keine Bewertungen
- Practica 3 BioorganDokument6 SeitenPractica 3 BioorganIrene FarmerNoch keine Bewertungen
- Hidrolisis de Sacarosa y Reconocimiento de PolisacaridosDokument11 SeitenHidrolisis de Sacarosa y Reconocimiento de PolisacaridosCARLOS GREGORIO PADILLA PAJOYNoch keine Bewertungen
- MediosDokument6 SeitenMediosDenisse MotaNoch keine Bewertungen
- Prueba de LugolDokument2 SeitenPrueba de LugolSEBASTIAN SANCHEZ RAMIREZNoch keine Bewertungen
- Practicas METABOLISMO MICROBIANODokument10 SeitenPracticas METABOLISMO MICROBIANOarmandoNoch keine Bewertungen
- Reacciones de Sustitución Nucleofilica SN Síntesis de Cloruro de Terc-ButiloDokument8 SeitenReacciones de Sustitución Nucleofilica SN Síntesis de Cloruro de Terc-ButiloJonathan ReyesNoch keine Bewertungen
- Observación de Grupos Microbianos. Cuestionario 1 Laboratorio de Microbiología BUAPDokument4 SeitenObservación de Grupos Microbianos. Cuestionario 1 Laboratorio de Microbiología BUAPK AngelicaNoch keine Bewertungen
- Lab CarbohidratosDokument13 SeitenLab CarbohidratosMarianella MendozaNoch keine Bewertungen
- Sintesis de SudanDokument3 SeitenSintesis de Sudanlia100% (1)
- Epoxidos Informe 4 FaltaDokument26 SeitenEpoxidos Informe 4 FaltaLuis Blanco PiñellaNoch keine Bewertungen
- Reduccion de La VainillinaDokument2 SeitenReduccion de La VainillinaMishel MijaresNoch keine Bewertungen
- Aislamiento BioquimicaDokument1 SeiteAislamiento BioquimicaFernando EztNoch keine Bewertungen
- Informe Aislamiento de Glucógeno, Hidrólisis e Identificación de GlucosaDokument6 SeitenInforme Aislamiento de Glucógeno, Hidrólisis e Identificación de GlucosaJose Alfredo SanchezNoch keine Bewertungen
- Diagrama Flujo Acido BencilicoDokument2 SeitenDiagrama Flujo Acido BencilicoJose Emmanuel ChemaNoch keine Bewertungen
- Práctica 10 Determinación Cualitativa de Glucósidos Cianogénicos en LeguminosasDokument5 SeitenPráctica 10 Determinación Cualitativa de Glucósidos Cianogénicos en LeguminosasJavier AnguianoNoch keine Bewertungen
- Practica 2Dokument4 SeitenPractica 2IvanNoch keine Bewertungen
- Determinación de Solubilidad Del Ácido Benzoico y Su Entalpía de DisoluciónDokument22 SeitenDeterminación de Solubilidad Del Ácido Benzoico y Su Entalpía de DisoluciónDamaris Naidu Jimenez AldanaNoch keine Bewertungen
- Síntesis de DibenzalacetonaDokument5 SeitenSíntesis de DibenzalacetonaDaniela Rios100% (1)
- Informe de CarbohidratosDokument13 SeitenInforme de Carbohidratosyenny lorena trujillo trujilloNoch keine Bewertungen
- Informe FurfuralDokument9 SeitenInforme FurfuralPaola Serena Galean AyardeNoch keine Bewertungen
- Transposicion BencilicaDokument22 SeitenTransposicion BencilicaItzen Martinez0% (3)
- Investigación Previa Obtención de Hidantoinas OrgánicaDokument8 SeitenInvestigación Previa Obtención de Hidantoinas OrgánicaDaniel Romano100% (1)
- Obtencion de ColesterolDokument5 SeitenObtencion de ColesterolJaime SanNoch keine Bewertungen
- Reporte Práctica 9-Síntesis de Fenolftaleína y Tinción de Diferentes FibrasDokument11 SeitenReporte Práctica 9-Síntesis de Fenolftaleína y Tinción de Diferentes FibrasAndy AldamaNoch keine Bewertungen
- Practica 2 - Síntesis de Ácido PícricoDokument14 SeitenPractica 2 - Síntesis de Ácido Pícricokatya monserrat cocolepsi fortizNoch keine Bewertungen
- Cartel 7 Bioquimica BUAPDokument1 SeiteCartel 7 Bioquimica BUAPChincoyaFNoch keine Bewertungen
- Laboratorio I de Quimica OrganicaDokument26 SeitenLaboratorio I de Quimica OrganicaAnonymous tBqihZNoch keine Bewertungen
- 8 Informe de Laboratorio - Síntesis de FluoresceínaDokument7 Seiten8 Informe de Laboratorio - Síntesis de FluoresceínaLaura TrujilloNoch keine Bewertungen
- Practica 14Dokument4 SeitenPractica 14Pau FlurscheimNoch keine Bewertungen
- Manual de Practicas de Organica IIDokument42 SeitenManual de Practicas de Organica IIEverardo Zamudio Hernandez67% (3)
- La Columna de Wino Grad SkyDokument23 SeitenLa Columna de Wino Grad SkyIxel Ga100% (1)
- AlmidónDokument15 SeitenAlmidónNathalia MojicaNoch keine Bewertungen
- Síntesis de DibenzalacetonaDokument8 SeitenSíntesis de DibenzalacetonaLalo AguerrilaNoch keine Bewertungen
- Reporte 14 Colorantes AzóicosDokument2 SeitenReporte 14 Colorantes AzóicosAlejandro Lara LabarriosNoch keine Bewertungen
- Previo BenciloDokument6 SeitenPrevio BenciloHeber Daniel Andrade Rivera100% (1)
- Carbohidratos y Acidos OrganicosDokument5 SeitenCarbohidratos y Acidos OrganicosLalo Tolentino100% (1)
- Inhibición Enzimática de La Deshidrogenada Succínica Del HígadoDokument4 SeitenInhibición Enzimática de La Deshidrogenada Succínica Del HígadoEibar AcostaNoch keine Bewertungen
- Reporte de Practica, Bioquimica.Dokument8 SeitenReporte de Practica, Bioquimica.Carlos Eli San JuanNoch keine Bewertungen
- Bioquímica P6Dokument9 SeitenBioquímica P6Angélica JiménezNoch keine Bewertungen
- Pruebas Cualitativas para Aminoacidos y Proteinas-1Dokument12 SeitenPruebas Cualitativas para Aminoacidos y Proteinas-1Eliecer Gonzalez100% (2)
- DicromatometriaDokument5 SeitenDicromatometriaEliecer GonzalezNoch keine Bewertungen
- Extracciòn y Aislamiento Por Destilaciòn 2Dokument7 SeitenExtracciòn y Aislamiento Por Destilaciòn 2Eliecer GonzalezNoch keine Bewertungen
- Propiedades ColigativasDokument7 SeitenPropiedades ColigativasEliecer GonzalezNoch keine Bewertungen
- Síntesis Del BenzopinacolDokument4 SeitenSíntesis Del BenzopinacolEliecer GonzalezNoch keine Bewertungen
- Calorimetria MiaDokument6 SeitenCalorimetria MiaEliecer GonzalezNoch keine Bewertungen
- Extracción y Aislamiento de Compuestos Orgánicos Mediante Destilación Por Arrastre Con Vapor Destilación FraccionadaDokument7 SeitenExtracción y Aislamiento de Compuestos Orgánicos Mediante Destilación Por Arrastre Con Vapor Destilación FraccionadaEliecer GonzalezNoch keine Bewertungen
- Exposición QuímicaDokument7 SeitenExposición QuímicaDayana SierraNoch keine Bewertungen
- Guía Química 02-11Dokument4 SeitenGuía Química 02-11poli2254Noch keine Bewertungen
- Reporte de LaboratorioDokument6 SeitenReporte de LaboratorioGuadalupe TorresNoch keine Bewertungen
- COMPLEJOS (Ing Ambiental)Dokument28 SeitenCOMPLEJOS (Ing Ambiental)Francisca Belen VillafrancaNoch keine Bewertungen
- Informe Final Proceso MermeladaDokument40 SeitenInforme Final Proceso MermeladaRigoNoch keine Bewertungen
- Informe PracticaDokument22 SeitenInforme PracticaBeimar Dennis Blanco GuzmanNoch keine Bewertungen
- MSDS Ervin Amasteel - Granalla de AceroDokument6 SeitenMSDS Ervin Amasteel - Granalla de AceroGianmarco RevelloNoch keine Bewertungen
- CCNN - 1 ESO - MEC - Adaptacion Curricular PDFDokument13 SeitenCCNN - 1 ESO - MEC - Adaptacion Curricular PDFCarmen Peña ValtueñaNoch keine Bewertungen
- ImgDokument5 SeitenImgEdna FélixNoch keine Bewertungen
- La Nutrición de Las PlantasDokument2 SeitenLa Nutrición de Las PlantasEMILAY75Noch keine Bewertungen
- AlohaDokument7 SeitenAlohaJunior TorrejónNoch keine Bewertungen
- 0003 - Especificaciones Tecnicas - ArquitecturaDokument42 Seiten0003 - Especificaciones Tecnicas - ArquitecturaMA MacedoNoch keine Bewertungen
- Conceptos Fundamentales de YacimientosDokument67 SeitenConceptos Fundamentales de YacimientosKabir Pacheco100% (1)
- Tabla Métodos Integrados - Química AnalíticaDokument21 SeitenTabla Métodos Integrados - Química AnalíticaRocío StamponeNoch keine Bewertungen
- Calorimetría DomiciliariaDokument1 SeiteCalorimetría DomiciliariaAldo GeldresNoch keine Bewertungen
- Propiedades Extensivas e IntensivasDokument3 SeitenPropiedades Extensivas e IntensivasJosue Ramirez RamirezNoch keine Bewertungen
- Arthur Powell - El Doble EtericoDokument85 SeitenArthur Powell - El Doble Etericomerypelaez100% (3)
- Tarea SolucionesDokument3 SeitenTarea SolucionesFran J LpNoch keine Bewertungen
- Presentacion AgroquimicosDokument22 SeitenPresentacion AgroquimicosVíctor Manuel Pérez OrtizNoch keine Bewertungen
- XpsDokument22 SeitenXpsEver Perez100% (1)
- Ensayos EspecialesDokument32 SeitenEnsayos EspecialesOscar CopzNoch keine Bewertungen
- Etiquetas y Fibras TextilesDokument15 SeitenEtiquetas y Fibras TextilesDAOMalagaNoch keine Bewertungen
- Ficha Técnica - PegasoDokument2 SeitenFicha Técnica - PegasoCesar Diaz Rojas100% (1)
- Manicura Tomo2Dokument0 SeitenManicura Tomo2Adriana Valencia100% (2)
- MicrodosisDokument17 SeitenMicrodosisNGilberto Sanchez100% (1)
- Química Orgánica (II)Dokument81 SeitenQuímica Orgánica (II)Gaby YepezNoch keine Bewertungen
- Las Funciones Que Cumplen Las Celdas de Flotación SonDokument9 SeitenLas Funciones Que Cumplen Las Celdas de Flotación SonMayra RiosNoch keine Bewertungen
- Ley de OhmDokument9 SeitenLey de OhmBruno Blas LauraNoch keine Bewertungen
- Informe de Prueba HidraulicaDokument5 SeitenInforme de Prueba HidraulicaPTC money100% (2)
- 2010 Isco ProceedingDokument530 Seiten2010 Isco ProceedingDaniel Hernan Muñoz RoblesNoch keine Bewertungen