Beruflich Dokumente
Kultur Dokumente
Sintesis Del Butanal A Partir de Butan-2-Ol
Hochgeladen von
MicaelOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Sintesis Del Butanal A Partir de Butan-2-Ol
Hochgeladen von
MicaelCopyright:
Verfügbare Formate
Universidad ICESI
Síntesis y caracterización de butiraldehído a partir de la oxidación de butan-1-ol
Montoya Kamila1, Sánchez Brayan2
Laboratorio de Química Orgánica II, Departamento de Ciencias Químicas, Facultad de Ciencias Naturales, Química Farmacéutica, Universidad Icesi, República de Colombia.
Infoartículo Resumen
Entrega: 21 de noviembre 2019 Se realizó la síntesis del butiraldehído a partir del butan-1-ol y una mezcla sulfocrómica agregada gota a gota en
agitación sin superar los 100 de temperatura. Se obtuvo un resultado de 3,0322 g de butiraldehído sintetizado y un
Palabras claves: porcentaje de rendimiento igual a 59,2%, también se halló el punto de fusión del 2,4-dinitrofenilhidrazona el cual
Síntesis fue 109-114 y se analizaron los diferentes espectros tanto del mencionado anteriormente como del producto
Butiraldehído sintetizado. Se concluyó que la oxidación del butan-1-ol junto con la mezcla crómica funciona de manera eficiente
Oxidación para la formación de butiraldehído.
Rendimiento
1. Introducción
Los alcoholes son compuestos orgánicos que contienen grupos hidroxilo
(-OH) y se sintetizan a través de una gran variedad de métodos,
adicionalmente, el grupo hidroxilo puede transformarse en muchos
otros grupos funcionales. Por estas razones, los alcoholes son
intermediarios sintéticos versátiles.1
Además, se debe de tener en cuenta su estructura, ya que cada alcohol Figura 1. Clasificación de alcoholes de acuerdo a su carbono carbinol.
se puede clasificar de acuerdo con el tipo de átomo de carbono carbinol
(el que está enlazado al grupo —OH) que presente, pues pueden ser Como fue mencionado, los alcoholes tienen diversas reacciones, entre ellas,
primarios, secundarios o terciarios como se muestra en la figura 1. Por la oxidación de este grupo funcional. Esta oxidación se reconoce por
ende, la reactividad de los hidroxilos depende de su estructura.1 Por disminuir la cantidad de enlaces C-H y aumentar la activad de enlaces C-O.2
ejemplo al oxidar alcoholes primarios se obtienen aldehídos, mientras Los alcoholes primarios se pueden oxidar a cetonas y seguidamente a ácidos
que la oxidación de alcoholes secundarios forma cetonas, un alcohol carboxílicos, los alcoholes secundarios se pueden oxidar a cetonas mientras
terciario no tienen hidrógeno (alfa) de modo que no es oxidado (sin que los alcoholes terciarios no pueden oxidarse sin romper los enlaces
embargo, un agente ácido puede deshidratarlo a un alqueno y luego carbono-carbono.1
oxidarlo).
Al inicio los alcoholes primarios se oxidan a aldehídos con el ácido 2 Resultados y análisis
crómico y otros reactivos que contengan cromo; no obstante, la reacción
no se detiene en el aldehído. Más bien el aldehído se sigue oxidando y
forma un ácido carboxílico. Debido a la toxicidad de los reactivos a base
de cromo, se han encontrado otros métodos para oxidar a los alcoholes.
Uno de los que más se usa es la llamada oxidación de Swerm.
Figura 1. Síntesis de butiraldehído a partir del butan-1-ol y una
mezcla sulfocrómica.
* Correspondencia del autor
1 Tany-montoya@hotmail.com (M Kamila)
2 brayan245201@gmail.com ( S. Brayan)
El mecanismo de reacción para la formación del butiraldehído se mala medición, exceso en la adición de reactivos o por el contrario que
encuentra en anexos. se añadió poco. Se debe tener en cuenta que no se realizó la
cristalización, ya que tiene como ventaja la purificación de una
sustancia, en este caso del butiraldehído, aunque esto implica recurrir al
Tabla 1. Información de los compuestos utilizados en la figura uso de más tiempo, factor limitado en esta práctica. Posteriormente se
1 para la síntesis de butiraldehído. procedió a tomar el punto de fusión de la hidrazona y se obtuvo un
porcentaje de 7,02 % aunque no fue alto, una de las fuentes posibles de
Entrada 1 2 3
error radicó en que no se dejó secar la muestra en el horno, posiblemente
quedó rastros de agua afectando el resultado final.
Nombre de Butan-1-ol Mezcla Butiraldehído
compuesto sulfocrómica Se realizó una prueba cualitativa para saber si la sustancia obtenida era
un aldehído o una cetona, dando positivo para un aldehído, ya que
Peso molecular 74,12 -- 72,11 ocurrió la formación de un espejo de plata, una reacción de oxidación.
(g/mol)
2.2 Análisis espectroscópico del Butanal
Densidad (g/mL) 0,8098 -- --
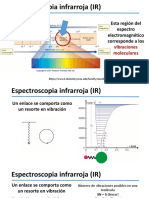
Las vibraciones del espectro infrarrojo dan información sobre los grupos
Masa (g) -- -- 3,0322 funcionales que forman parte de una molécula, en este caso, del butanal:
de 1680-1750 cm-1, hay una señal que representa el enlace doble entre el
Volumen (mL) 6,5 30 -- C y el O, esta señal presenta una intensidad fuerte debido a las
interacciones entre estos dos elementos, posteriormente se observa se
% rendimiento -- -- 59,2 puede identificar una banda con una intensidad muy fuerte entre 2600-
2950 cm-1 que indica las frecuencias de vibración de estiramiento del
carbono (unido con el doble enlace a oxígeno ) con el hidrógeno alfa .
El rendimiento teórico se halló como se muestra en la ecuación 2 En el espectro de RMN 1H se pueden identificar la clase de hidrógenos
presentes en la molécula. La molécula de lugar a un triplete con tres
hidrógenos deslocalizados los cuales representan al metilo CH3. Luego,
0,8098 𝑔 𝐶4 𝐻10 𝑂 1 𝑚𝑜𝑙 𝐶4 𝐻10 𝑂 1 𝑚𝑜𝑙 𝐶4 𝐻8 𝑂 72,11 𝑔 𝐶4 𝐻8 𝑂
6,5 𝑚𝐿 𝐶4 𝐻10 𝑂 ×
1 𝑚𝐿 𝐶4 𝐻10 𝑂
×
74,12 𝑔 𝐶4 𝐻10 𝑂
×
1 𝑚𝑜𝑙 𝐶4 𝐻10 𝑂
×
1 𝑚𝑜𝑙 𝐶4 𝐻8 𝑂
= se puede ver un desplazamiento en 1,64 que da lugar a un multiplete
5,12 𝑔 𝐶4 𝐻8 𝑂 Ec. (2) por los hidrógenos vecinos que posee, presentan 2 hidrógenos
deslocalizado los cuales representan al CH2. En el desplazamiento 2,37
Posterior a ello, se encontró el rendimiento experimental en donde el se tiene un cuarteto con dos hidrógenos deslocalizados los cuales
peso del beaker fue de 31,0705 g y el peso del beaker junto con el representan a un CH2. En el desplazamiento 9,7 da lugar a un triplete
butiraldehído fue igual a 34,1027 g. Es decir, que al realizar la diferencia con un hidrógeno desacoplado, correspondiente a la interacción del
se obtuvo los gramos de butiraldehído experimental hidrógeno unido con el carbono-oxígeno.
34,1027 g - 31,0705 g = 3,0322 g 𝐶4 𝐻8 𝑂 En el espectro de RMN 13C se tienen 3 señales principales, la señal en
13,71 (ppm) se refiere al metilo presente en al compuesto,
Se realizó el porcentaje de rendimiento del butanal según la ecuación 3 posteriormente una señal en 43,82 (ppm) se refiere al CH2 presente en
el compuesto, y por último una señal en 202,8 (ppm) se refiere al carbono
𝑉𝑎𝑙𝑜𝑟 𝑒𝑥𝑝𝑒𝑟𝑖𝑚𝑒𝑛𝑡𝑎𝑙 presente en el grupo carbonilo.
% rendimiento = × 100 Ec. (3)
𝑣𝑎𝑙𝑜𝑟 𝑡𝑒𝑜𝑟𝑖𝑐𝑜
3,0322 𝑔
2.3 Análisis espectroscópico del 2,4-dinitrofenilhidrazona
% rendimiento = × 100 = 59,2%
5,12 𝑔
En el espectro RMN 1H se puede identificar la clase de hidrógenos
presentes en la molécula. La molécula da señales en 0,98 (ppm) el cual
Por otro lado, se obtuvo el porcentaje de error de la 2,4- representa a un triplete con tres hidrógenos deslocalizados los cuales
dinitrofenilhidrazona por medio de la ecuación 4 representan a un R-CH3. En la señal 1,61 (ppm) representa a un
multiplete con dos hidrógenos desacoplados correspondiente a un R-
CH2. Una señal en 2,11 (ppm) representa a un cuarteto con dos
% error =
𝑉𝑎𝑙𝑜𝑟 𝑡𝑒𝑜𝑟𝑖𝑐𝑜−𝑉𝑎𝑙𝑜𝑟 𝑒𝑥𝑝𝑒𝑟𝑖𝑚𝑒𝑛𝑡𝑎𝑙
× 100 Ec. (4) hidrógenos desacoplados correspondiente a un R-CH2. Una señal en
𝑣𝑎𝑙𝑜𝑟 𝑡𝑒𝑜𝑟𝑖𝑐𝑜
6,97 (ppm) correspondiente a un doblete y aun hidrógeno desacoplado
R-CH y por último una señal en 11,61 (ppm) representa a un singlete con
un hidrógeno desacoplado R-CH.
122−114
% error = × 100= 7,02%
114
3 Experimental
3,1 General
En esta práctica se adaptó un sistema de destilación fraccionada en
donde se usó butan-1-ol (1) y mezcla sulfocrómica (2) para la síntesis del
butiraldehído (3), además se requirió secar el producto obtenido
utilizando sulfato de sodio anhidro. Se realizaron pruebas cualitativas
en donde se usó hidróxido de sodio al 10%, nitrato de plata al 10% e
Figura 2. Reacción entre butanal y la hidrazina hidróxido de amonio al 10% para la prueba de Tollens y para la otra
prueba cualitativa se necesitó del reactivo de 2,4-dinitrofenilhidrazina
y se realizó una recristalización del producto obtenido verificando su
Se observó que el porcentaje de rendimiento obtenido en esta práctica síntesis mediante la toma del punto de fusión .Este se midió con un
no fue el esperado respecto al valor teórico, factores como el tiempo en aparato digital denominado fusiómetro de marca ELECTROTHERMAL.
la destilación pudo desviar los resultados de ésta, ya que no se dejó el Todos los reactivos y solventes empleados fueron provenientes de
tiempo necesario para que la reacción entre el butanol y la mezcla Sigma Aldrich (casa matriz)
sulfocrómica se diera por completo. Factores sistemáticos, como una
Referencias
3,2 Síntesis de butanal a partir de butan-2-ol
Se colocó un balón de tres bocas sobre una plancha de 1. Wade, L.G (2016). Química orgánica volúmen I, 7ª edición. Editorial Pearson,
2016; pp 121-165.
calentamiento, en este balón se encontraba adicionado 6,5 mL
de butan-1-ol y se adaptó un sistema de destilación fraccionada 2. Bruice, P.Y (2008). Química orgánica, 5ª edición. Editorial Pearson, 2008 ;
con una columna Vigreux en una boca y en la otra se insertó 447-450.
un embudo de adición que contenía 30 mL de la mezcla
3. Spectral Database for Organic compounds SDBS. Espectros del
sulfocrómica. Se calentó el balón a 200 oC y se agregó gota a gota butiraldehído. [En línea]. Japon.
la mezcla crómica para que reaccionara con el butan-1-ol dejándolo
calentar sin que la columna superara los 100 oC por un periodo de 15
minutos y se recolectó el destilado en un matraz sumergido en hielo. Se
transfirió el destilado a un embudo de separación para obtener la fase
orgánica que contenía el butanal, posteriormente se secó el aldehído con
una pequeña cantidad de sulfato de sodio anhidro y por último se pesó
el producto obtenido el cual fue 3,0322 g de butiraldehído.
3,3 Pruebas cualitativas
3.3.1 Prueba de Tollens
Se realizó adicionando 0,25 mL de hidróxido de sodio al 10% (NaOH)
y 0,25 mL de nitrato de plata al 10% (AgNO3) a un tubo de ensayo,
donde se formó un precipitado oscuro de hidróxido de plata (AgOH)
y de nitrato de sodio (NaNO3). Luego, se disolvió este precipitado con
hidróxido de amonio (NH4OH) al 10%. Por último, se adicionó una
pequeña muestra del aldehído sintetizado dando paso a la formación
de un espejo de plata
3.3.2. Preparación del derivado de 2,4-dinitrofenilhidrazina
Esta prueba consistió, en agregar 0,5 mL de aldehído sintetizado a 2 mL
de reactivo de 2,4-dinitrofenilhidracina donde formó una solución
naranja/amarillo con un precipitado del mismo color. Posteriormente,
se filtró al vacío y se purificó por recristalización en etanol para luego
realizar un segundo filtrado al vacío, dejarlo secar en el horno y por
último determinar su punto de fusión experimental el cual fue 109 oC -
114 oC.
3.4 Butiraldehído
RMN 1H (ppm) 9.764 (J=7 Hz, 1H, triplete, H-1); RMN 1H
(ppm) 2.37 (J=0 Hz, 2H, cuarteto, H-2); RMN 1H (ppm) 1.64 (
J=0 Hz, 2H, multiplete, H-3); RMN 1H (ppm) 0.97 (J=7 Hz, 3H,
triplete, H-4); RMN 13C (ppm) 13.71, 15.95, 45.82, 202.80; HRMS
calculado [M+H]+:155.3, encontrado 155.6.IR 1730-1720 [cm-1]
Tensión en enlace C=O . IR 2820-2720 [cm-1] Tensión enlace C-H
3.5 2,4-Dinitrofenilhidrazona
RMN 1H (ppm) 0,98 (J=12 Hz, 3H, triplete, H-3); RMN 1H
(ppm) 1,61 (J=7 Hz, 2H, sexteto, H-2); RMN 1H (ppm) 2,11 ( J=7
Hz, 2H, cuarteto, H-2); RMN 1H (ppm) 6.97 (J=7 Hz, 1H, doblete,
H-1); ); RMN 1H (ppm) 8,83 (J=0 Hz, 1H, singlete, H-1) ); RMN
1H (ppm) 11,61 (J=0 Hz, 1H, singlete, H-1.
Conclusiones
Se observó que la prueba de Tollens es útil para saber si un compuesto
es un aldehído o una cetona, en esta práctica fue útil porque se hizo
necesario identificar si el producto obtenido era un aldehído.
Se observó la importancia de que la reacción entre el butanol y la mezcla
sulfocrómica se diera por completo, ya que se produjo un porcentaje de
rendimiento bajo, comparado con el valor teórico. Además de las
implicaciones que se tuvo luego al no realizar una cristalización, con el
fin de purificar la muestra.
Anexos ( VA EN HOJA APARTE, UNA SOLA COLUMNA)
Anexo 1. Espectro RMN 1H del butanal
Anexo 2. Espectro RMN 13C del butanal
Anexo 3. IR del butanal
Anexo 4. Espectro de masas del butanal
Anexo 5. Butanal
Anexo 6. 2,4-dinitrofenilhidrazona
Anexo 7. Espectro RMN 1H del 2,4-dinitrofenilhidrazona
Anexo 8: mecanismo de reacción de butanol a butanal
Das könnte Ihnen auch gefallen
- Comparacion de CondesacionesDokument2 SeitenComparacion de CondesacionesNATALIA RODRIGUEZ ARIAS100% (1)
- Informe de Síntesis Del ButanalDokument11 SeitenInforme de Síntesis Del ButanalIsabella MartinezNoch keine Bewertungen
- Final Informe 2 OrganicaDokument7 SeitenFinal Informe 2 OrganicaIsabella ArboledaNoch keine Bewertungen
- Equivalencia Entre Calor y Trabajo Eléctrico PDFDokument6 SeitenEquivalencia Entre Calor y Trabajo Eléctrico PDFMaría del Mar Varela VasquzNoch keine Bewertungen
- PRÁCTICA 2. Síntesis de Hexan-2-Ol 1.1Dokument34 SeitenPRÁCTICA 2. Síntesis de Hexan-2-Ol 1.1Isabella Giraldo100% (2)
- Practica 4 Condensación de Claisen-Schmidt. Obtencion de DibenzalacetonaDokument18 SeitenPractica 4 Condensación de Claisen-Schmidt. Obtencion de DibenzalacetonaLizeth Paola TellezNoch keine Bewertungen
- Informe 2 B NerolinaDokument3 SeitenInforme 2 B NerolinaVictor PerezNoch keine Bewertungen
- CICLOHEXANONADokument6 SeitenCICLOHEXANONAcarolm1p50% (2)
- B NerolinaDokument10 SeitenB NerolinaDiana MoedanoNoch keine Bewertungen
- Informe 4organica2 DibenzalacetonaDokument17 SeitenInforme 4organica2 DibenzalacetonaLionel Fressi50% (6)
- Ácido FenoxiaceticoDokument2 SeitenÁcido FenoxiaceticoGammaCSNoch keine Bewertungen
- Humanidades Abandonarse A La PasionDokument2 SeitenHumanidades Abandonarse A La PasionMicaelNoch keine Bewertungen
- Práctica 3 Reacciones de Adición Electrofílica Síntesis de Hexan-2-OlDokument9 SeitenPráctica 3 Reacciones de Adición Electrofílica Síntesis de Hexan-2-OlMiguel RojasNoch keine Bewertungen
- Practica 4 Reaccion de ReduccionDokument4 SeitenPractica 4 Reaccion de ReduccionHumberto Flores LealNoch keine Bewertungen
- Reporte Ácido FenoxiáceticoDokument3 SeitenReporte Ácido FenoxiáceticotertbutilNoch keine Bewertungen
- Informe 5 FisicoDokument4 SeitenInforme 5 FisicoAnonymous 3loLV5tu100% (1)
- Reporte Benzoína Bencilo Acido BencilicoDokument3 SeitenReporte Benzoína Bencilo Acido BencilicoAlan0% (1)
- Informe 4. Condensacion de Claisen-Schmidt y KnoevenagelDokument8 SeitenInforme 4. Condensacion de Claisen-Schmidt y KnoevenagelDiego Molina RoaNoch keine Bewertungen
- Reporte Bromuro de N-ButiloDokument4 SeitenReporte Bromuro de N-ButiloEduardo Hernández HuertaNoch keine Bewertungen
- Practica 4 Sintesis de Alcohol Bencilico y Acido BenzoicoDokument5 SeitenPractica 4 Sintesis de Alcohol Bencilico y Acido BenzoicoLiz RivasNoch keine Bewertungen
- Acetilación de La Anilina. Informe 4 DefinitivoDokument2 SeitenAcetilación de La Anilina. Informe 4 DefinitivoSHARON OSSA CABALLERO100% (1)
- Formación y Acoplamiento de Sales de DiazonioDokument6 SeitenFormación y Acoplamiento de Sales de Diazonioalmuchis12Noch keine Bewertungen
- Práctica 2 Sintesis de DibenzalacetonaDokument3 SeitenPráctica 2 Sintesis de DibenzalacetonaSaul RuizNoch keine Bewertungen
- Informe 7 Preparación de 3-CarbetoxicumarinaDokument11 SeitenInforme 7 Preparación de 3-CarbetoxicumarinaDani SantoyoNoch keine Bewertungen
- Obtención de M - NitroanilinaDokument2 SeitenObtención de M - NitroanilinaAlfonso ARNoch keine Bewertungen
- Preparación y Análisis Del Complejo Cloruro de Pentaaminclorocobalto (III) TerminadoDokument4 SeitenPreparación y Análisis Del Complejo Cloruro de Pentaaminclorocobalto (III) TerminadoSamuel Fernando DelgadoNoch keine Bewertungen
- Síntesis de Ácido AdípicoDokument3 SeitenSíntesis de Ácido AdípicoGänon Abraham0% (1)
- BenzoínaDokument13 SeitenBenzoínadany_289Noch keine Bewertungen
- Etil Tritil ÉterDokument5 SeitenEtil Tritil ÉterKevin David AlvarezNoch keine Bewertungen
- AspirinaDokument7 SeitenAspirinaFernanda GómezNoch keine Bewertungen
- Sintesis de DibenzalAcetonaDokument9 SeitenSintesis de DibenzalAcetonaAndrea Rodriguez100% (1)
- Reporte Práctica 4-Síntesis de 2.3-DifenilquinoxalinaDokument10 SeitenReporte Práctica 4-Síntesis de 2.3-DifenilquinoxalinaAndy AldamaNoch keine Bewertungen
- Práctica 7 Preguntas PreviasDokument9 SeitenPráctica 7 Preguntas PreviasLaura PintaNoch keine Bewertungen
- Cuantificación Del Grado de Pureza Del Ácido AcéticoDokument9 SeitenCuantificación Del Grado de Pureza Del Ácido AcéticoFernanda GómezNoch keine Bewertungen
- Práctica 8 Acoplamiento de Sales de DiazonioDokument8 SeitenPráctica 8 Acoplamiento de Sales de DiazonioErnesto ZavalaNoch keine Bewertungen
- Curvas de Titulación Ácido-Base y Determinación de La Constante de Aceidez de Un ÁcidoDokument11 SeitenCurvas de Titulación Ácido-Base y Determinación de La Constante de Aceidez de Un ÁcidoDavid Colorado VegaNoch keine Bewertungen
- Practica 3 Fermentacion EtanolicaDokument6 SeitenPractica 3 Fermentacion EtanolicaVanessa RomeroNoch keine Bewertungen
- Dibenzalacetona PracticaDokument4 SeitenDibenzalacetona PracticaBrayan Efrain Orozco SoteloNoch keine Bewertungen
- Práctica 7 SÍNTESIS DE PIRIMIDINASDokument2 SeitenPráctica 7 SÍNTESIS DE PIRIMIDINASVanya MenesesNoch keine Bewertungen
- Obtención de DibenzalacetonaDokument11 SeitenObtención de DibenzalacetonaKaz Melo100% (1)
- Trazabilidad QuimicaDokument4 SeitenTrazabilidad Quimicafrancisco123.xNoch keine Bewertungen
- AnalisisDokument10 SeitenAnalisisLina VidalNoch keine Bewertungen
- Cinamaldehido 2Dokument6 SeitenCinamaldehido 2Yuli SanchezNoch keine Bewertungen
- Práctica 7. Síntesis de CiclohexenoDokument3 SeitenPráctica 7. Síntesis de CiclohexenoRoberto Viramontes25% (4)
- Sintesis de SudanDokument3 SeitenSintesis de Sudanlia100% (1)
- Práctica 4. Síntesis de (E) 2,6-Dibenciliden-Ciclohexanona Usando Condensación AldólicaDokument3 SeitenPráctica 4. Síntesis de (E) 2,6-Dibenciliden-Ciclohexanona Usando Condensación AldólicaYeimy Andrea Ocampo GilNoch keine Bewertungen
- Informe 5 Sal de Mohr Grupo 2Dokument5 SeitenInforme 5 Sal de Mohr Grupo 2OSCAR DANIEL ARREDONDO GAÑANNoch keine Bewertungen
- Preguta de CarbohidratoDokument3 SeitenPreguta de Carbohidratojhon fernando100% (1)
- Obtención de Aldehídos y Cetonas Por Oxidación de Alcoholes ReporteDokument8 SeitenObtención de Aldehídos y Cetonas Por Oxidación de Alcoholes ReporteErnesto ZavalaNoch keine Bewertungen
- PRÁCTICA No. 4: OBTENCIÓN DE 5,5-DIFENILHIDANTOINADokument7 SeitenPRÁCTICA No. 4: OBTENCIÓN DE 5,5-DIFENILHIDANTOINADiana HMNoch keine Bewertungen
- Informe de Condensación AldolicaDokument15 SeitenInforme de Condensación AldolicaIsabella Villanueva GallegoNoch keine Bewertungen
- Fenolftaleina y Fluoresceina Informe CorregidoDokument6 SeitenFenolftaleina y Fluoresceina Informe CorregidoJuan PabloNoch keine Bewertungen
- Sintesis de ParanitroanilinaDokument2 SeitenSintesis de ParanitroanilinaYara Hernandez0% (1)
- Informe de Isomerización Del Acido MaleicoDokument5 SeitenInforme de Isomerización Del Acido Maleicoluis viucheNoch keine Bewertungen
- Ácido CinámicoDokument4 SeitenÁcido CinámicoLore ORtiizz100% (1)
- Condensacion de ClaisenDokument7 SeitenCondensacion de ClaisenMaria RuizNoch keine Bewertungen
- Seminario Sintesis de Acido HipúricoDokument10 SeitenSeminario Sintesis de Acido Hipúricospaceroes100% (1)
- Analitica Experimental 1 Practica 2Dokument3 SeitenAnalitica Experimental 1 Practica 2Fer AlonsoNoch keine Bewertungen
- M Nitroanilina 1Dokument5 SeitenM Nitroanilina 1Diana MoedanoNoch keine Bewertungen
- Sintesis Del Butanal A Partir de Butan-2-OlDokument10 SeitenSintesis Del Butanal A Partir de Butan-2-OlMicaelNoch keine Bewertungen
- Inf. Practica 4 Cetonas y AldehidosDokument5 SeitenInf. Practica 4 Cetonas y AldehidoscportelariosNoch keine Bewertungen
- Sintesis Del Butanal A Partir de Butan-2-OlDokument10 SeitenSintesis Del Butanal A Partir de Butan-2-OlMicaelNoch keine Bewertungen
- Sintesis Del Butanal A Partir de Butan-2-OlDokument10 SeitenSintesis Del Butanal A Partir de Butan-2-OlMicaelNoch keine Bewertungen
- Informe KjeldahlDokument5 SeitenInforme KjeldahlMicaelNoch keine Bewertungen
- Abandonarse A La PasionDokument1 SeiteAbandonarse A La PasionMicaelNoch keine Bewertungen
- Org IIDokument21 SeitenOrg IIMicaelNoch keine Bewertungen
- Abandonarse A La PasionDokument1 SeiteAbandonarse A La PasionMicaelNoch keine Bewertungen
- Análisis QuímicoDokument8 SeitenAnálisis QuímicoMicaelNoch keine Bewertungen
- P4 Obtención de B-NEROLINA - Equipo6Dokument14 SeitenP4 Obtención de B-NEROLINA - Equipo6María Fernanda Carmona MartínezNoch keine Bewertungen
- Cinética AmpicilinaDokument7 SeitenCinética AmpicilinaJosé Enrique Ariza ColinaNoch keine Bewertungen
- Sintesis Polimero de CoordinacionDokument16 SeitenSintesis Polimero de Coordinacionlaura rojasNoch keine Bewertungen
- Previo Indoles Organica IVDokument4 SeitenPrevio Indoles Organica IVMario QCNoch keine Bewertungen
- Métodos de Síntesis de Nuevos Materiales Basados en Metales de TransiciónDokument11 SeitenMétodos de Síntesis de Nuevos Materiales Basados en Metales de TransiciónCamilo LaraNoch keine Bewertungen
- Cuestionario Practica 3Dokument4 SeitenCuestionario Practica 3M O C H I •᷄ɞ•᷅Noch keine Bewertungen
- Modelamiento, Simulación, Integración y Optimización de Una Planta de Síntesis de Amoniaco A Aprtir de Gas Natural FinalDokument100 SeitenModelamiento, Simulación, Integración y Optimización de Una Planta de Síntesis de Amoniaco A Aprtir de Gas Natural FinalJuan Manuel Uceda PérezNoch keine Bewertungen
- El Método Del Arbol de SíntesisDokument87 SeitenEl Método Del Arbol de SíntesisWilbert Rivera Muñoz100% (6)
- DepalabrasyconceptosDokument68 SeitenDepalabrasyconceptosMaximiliano Mendoza GuillenNoch keine Bewertungen
- Creación de ProcesosDokument31 SeitenCreación de ProcesosEdwin Roger AranibarNoch keine Bewertungen
- Informe 3 Sintesis de Peroxoborato de Sodio PDFDokument8 SeitenInforme 3 Sintesis de Peroxoborato de Sodio PDFJGARCIA38Noch keine Bewertungen
- Practica No. 2 Reacción de Estado Sólido 1 PDFDokument2 SeitenPractica No. 2 Reacción de Estado Sólido 1 PDFJairArmandoGomezPerezNoch keine Bewertungen
- 110Dokument4 Seiten110Meliza Deyna Monrroy AlonsoNoch keine Bewertungen
- Ejercicios Qoa1 S o PDFDokument8 SeitenEjercicios Qoa1 S o PDFmerchinetsNoch keine Bewertungen
- Guión Práctica 2 2022Dokument7 SeitenGuión Práctica 2 2022Jhess TektekNoch keine Bewertungen
- Síntesis Asistida Por MicroondasDokument5 SeitenSíntesis Asistida Por MicroondasMauricioCadenaNoch keine Bewertungen
- Sintesis de CiclohexenoDokument10 SeitenSintesis de CiclohexenoGustavo Javier Pérez Contreras100% (1)
- Informe No. 3 Síntesis Ácido 5-Nitrosalicílico-1Dokument41 SeitenInforme No. 3 Síntesis Ácido 5-Nitrosalicílico-1Luz Ena BeleñoNoch keine Bewertungen
- PRINCIPIOS DE DISEÑO DE PRODUCTO Y PROCESO Capitulo 6 HEURISTICASDokument51 SeitenPRINCIPIOS DE DISEÑO DE PRODUCTO Y PROCESO Capitulo 6 HEURISTICASGarcía Nuñez Sergio100% (1)
- PiperazinaDokument20 SeitenPiperazinaHector JavierNoch keine Bewertungen
- Practica 5 BioorganicaDokument4 SeitenPractica 5 BioorganicasekaiNoch keine Bewertungen
- Prctica 8Dokument3 SeitenPrctica 8T3312Noch keine Bewertungen
- Síntesis, Caracterización y Acetilación Del FerrocenoDokument7 SeitenSíntesis, Caracterización y Acetilación Del FerrocenoJuan Alejandro Guerrero Teran100% (1)
- Consolidado 2 - Sintesis Del TalampanelDokument23 SeitenConsolidado 2 - Sintesis Del TalampanelJuani BustamanteNoch keine Bewertungen
- 12 Principios de La Química VerdeDokument27 Seiten12 Principios de La Química VerdeRicardo Alfonso Trujillo SantillanaNoch keine Bewertungen
- Fundamentos de Química Heterocíclica-VERSION 2.2Dokument66 SeitenFundamentos de Química Heterocíclica-VERSION 2.2Ivan Monroy100% (1)
- Orga PirrolDokument8 SeitenOrga Pirrolalonsini1Noch keine Bewertungen
- SÍNTESIS DE DIHIDROPIRIMIDINAS-Equipo 13Dokument5 SeitenSÍNTESIS DE DIHIDROPIRIMIDINAS-Equipo 13Jose BarajasNoch keine Bewertungen
- Pqoii 4Dokument4 SeitenPqoii 4anon_932600778Noch keine Bewertungen
- Reacciones de Eliminación IDokument6 SeitenReacciones de Eliminación IMayra DelgadoNoch keine Bewertungen