Beruflich Dokumente
Kultur Dokumente
TP 7 Protocole Coupe Histologique v2011 PDF
Hochgeladen von
Bektache nabylOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
TP 7 Protocole Coupe Histologique v2011 PDF
Hochgeladen von
Bektache nabylCopyright:
Verfügbare Formate
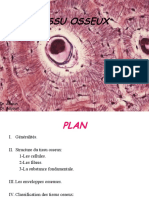
BTSA 1 M55
TP 7 Histologie
Les techniques de MO et de ME sont utilisées en routine
pour visualiser les structures.
Avec les conseils de Madame Julien. Anatomopathologie . 26000 Valence
Pour rendre visible ce que l'on veut observer, il est nécessaire de mettre en oeuvre des techniques
diverses (préparation des échantillons) que l'on applique au matériel. Pour l'observation en MO
ou en ME, les coupes examinées sont le fruit de procédures techniques qui requièrent plusieurs
étapes successives : fixation, inclusion, coupe, coloration, montage.
I Pour la MO : fixation au formol, inclusion en paraffine,
colorations standard (hématoxyline-éosine ou HES ou
trichrome)
La fixation a pour but la conservation des structures et le durcissement des pièces. Elle
doit se faire immédiatement après le prélèvement, par immersion du matériel dans un
grand volume de liquide fixateur. Les liquides fixateurs les plus utilisés sont le formol ou
le liquide de Bouin (mélange de formol et d'acide picrique). La durée de la fixation varie
selon le volume des prélèvements (de quelques heures pour un petit fragment biopsique à
plusieurs semaines pour un cerveau humain entier).
L'inclusion a pour but de permettre la réalisation de coupes fines et régulières. Le milieu
d'inclusion le plus utilisé est la paraffine. Comme la paraffine est hydrophobe, le
prélèvement doit d'abord subir une déshydratation (par immersion dans des bains d'alcool
de degré croissant puis dans des bains de toluène) avant d'être coulé dans un moule
contenant de la paraffine fondue par chauffage et devenue liquide, qui infiltre alors toute
la pièce. Après refroidissement, on se trouve en présence d'un bloc de paraffine, dur, à
l'intérieur duquel la pièce prélevée est incluse. Dans certains cas, on utilise d'autres
milieux d'inclusion (celloïdine, résines plastiques, etc.).
Les coupes du bloc de paraffine sont faites avec un microtome permettant de réaliser des
tranches de section (coupes) de 2 à 5 µm d'épaisseur. Les coupes sont recueillies sur des
lames de verre.
Ph.A biotechnologies.education page 1
BTSA 1 M55
Les colorations réalisées sur lames, accentuent les contrastes pour mieux reconnaître les
différents éléments de la préparation. Comme les colorants sont en solution aqueuse, les
coupes doivent d'abord subir une réhydratation. Celle-ci est effectuée après déparaffinage
des coupes (par la chaleur et des bains de toluène) en immergeant les lames dans des
bains d'alcool de degré décroissant puis dans l'eau distillée. Les colorations les plus
fréquemment utilisées associent deux ou trois colorants différents : l'Hématoxyline-
Eosine (H.E.) associe l'hématéine qui colore les noyaux en violet et l'éosine les
cytoplasmes en rose ; les colorations trichromiques usuelles sont l'Hématéine-Eosine-
Safran (H.E.S.) par ajout de safran colorant en jaune les fibres de collagène, et le
trichrome de Masson qui associe un colorant nucléaire (hématoxyline), un colorant
cytoplasmique et un colorant bleu ou vert colorant les fibres de collagène. De nombreuses
colorations spéciales (dites signalétiques) permettent de visualiser différentes structures
ou composants des tissus (par exemple, les fibres de réticuline par des colorations
argentiques ou les fibres élastiques par l'orcéine).
Le montage. Après avoir subi une déshydratation (par bains d'alcool de degré croissant
puis bains de toluène), les coupes colorées sont montées entre lame et lamelle avec une
résine synthétique dont l'indice de réfraction est voisin de celui du verre. On dispose alors
d'une « préparation microscopique » (simplement appelée « lame » dans le langage
courant) prête à être observée au MO.
Remarque :Pour la ME : fixation à la glutaraldéhyde, post-
fixation à l'acide osmique, inclusion en épon, contraste par
l'acétate d'uranyle et le citrate de plomb
La technique dite « standard » de ME est analogue dans ses principes à celle de MO, mais les
modalités précises diffèrent.
La fixation se fait habituellement dans de la glutaraldéhyde tamponnée et est suivie d'une
post-fixation à l'acide osmique.
L'inclusion se fait dans une résine synthétique type Epon ou Araldite, après que les
fragments ont été déshydratés dans les alcools et dans l'oxyde de propylène.
Les coupes ultrafines des blocs sont réalisées grâce à un ultramicrotome qui permet
d'obtenir des coupes ultrafines d'environ 80 nm d'épaisseur. Les coupes sont recueillies
sur des grilles de cuivre. Avec le même ultramicrotome, on peut faire des coupes semi-
fines, observables en MO et permettant de guider le choix des zones à étudier en ME.
Le contraste des coupes s'effectue habituellement avec de l'acétate d'uranyle (contrastant
les nucléoprotéines : noyau, nucléole, ribosomes) et des sels de plomb comme le citrate de
plomb (contrastant les membranes).
Ph.A biotechnologies.education page 2
BTSA 1 M55
II Technique de préparation des échantillons d’origine
animale en laboratoire d’anatomopathologie.
1 Fixation
Mettre la pièce anatomique dans un bain de formol à 10% entre 24h et 48h. (il est préférable de la
laisser 48h).
Il faut veiller à préparer un bain qui représente 10 fois la masse de la pièce à fixer.
Remarque : Formol à 10% en sachant que les solutions du commerce sont à 30%
Prélever un fragment de l’organe à étudier. Le positionner dans une cassette que l’on ferme et
que l’on trempera dans les bains successifs. (Attention à la coupe du fragment. Il y a un sens pour
l’organe).
2 Préparation avant inclusion : La déshydratation
Mettre dans des bains successifs d’alcools de concentration croissante pour déshydrater l’organe
sachant que la paraffine est très hydrophobe.
Alcool 70° 85° 90° 100°
Temps 10 min 30 min 45 min 1h30
Ensuite mettre dans 3 bains successifs de safsolvent de concentration identique pour laver
l’organe.
safsolvent 15 min 30 min 45 min
Mettre dans de la paraffine liquide pour laver les excès de solvant. Pour cela on utilise une étuve
entre 56°C et 60 °C pour garder la paraffine liquide.
Paraffine liquide 1h 1h 1h
Le dernier bain peut durer 1 nuit afin d’effectuer, le lendemain, la coupe avec les étudiants
3 Inclusion/ enrobage
Dans un moule métallique ou jetable préalablement placé à l’étuve à 56°C.
Mettre au fond quelques gouttes de paraffine liquide
(Les pinces doivent être chaude pour faciliter cette opération.. Utiliser le bec bunsen).
Mettre l’organe en veillant au sens pour obtenir une coupe de tous les tissus
Rajouter de la paraffine liquide
La cassette, puis de nouveau de la paraffine liquide
On place l’inclusion au congélateur (bain glacé) pour faciliter le démoulage.
Ph.A biotechnologies.education page 3
BTSA 1 M55
4 Coupe histologique
le microtome
o reculer le porte objet au maximum
o placer le bloc dans le porte objet sans le fixer
o placer le rasoir face gravée vers l'extérieur : e fixer (face à
couper dans un plan vertical, parallèle au fil du rasoir, les deux
arêtes du bloc les plus longues horizontalement
o dégrossir à la main
o régler l'épaisseur des coupes (5 microns)
o mettre le cliquet
o couper
DIFFICULTES
o Les coupes ne se font pas vérifier le cliquet, l'inclinaison du rasoir, la fixation du
porte objet
o coupes striées essuyer le rasoir ou le déplacer
o coupes irrégulières vérifier la fixation du rasoir et du porte-objet
La cire doit être assez froide, pour obtenir un ruban. =>Mettre le bloc de paraffine au
congélateur si besoin ou utiliser une bombe cryolab qui refroidit la surface de la cire.
Ph.A biotechnologies.education page 4
BTSA 1 M55
5 Fixation de la coupe sur la lame
Sur une plaque chauffante maintenant une température de 50 °C.
On place une lame sur laquelle on dépose une solution eau distillée albuminé à 1% en veillant à
faire un dôme d’eau sur la lame pour éviter des bulles d’air. L’eau albuminé permet à la coupe de
bien glisser sur la lame.
On peut utiliser un bac d’eau chaude.
Rajouter dans l’eau chaude du stick on qui permet une meilleur fixation. 10ml dans un L d’eau
On dépose alors la coupe histologique sur la lame.
On égoutte la lame , en renversant simplement l’eau sur un sopalin.
On place la lame droite pour bien faire sécher. Par exemple sur un sopalin.
Puis on place la lame dans une étuve à 56°C pendant 1 h.
Cela permettra de faciliter d’enlever le reste de paraffine et de bien permettre la fixation de la
coupe sur la lame.
Les critères d’une bonne coupe histologique:
- couper tout l’organe étudié.
- une épaisseur constante.
- pas de pli, pas de bulle
- pas de détérioration de la coupe
- Bien déposer sur l’eau chaude pour que la
coupe s’étale correctement.
Ph.A biotechnologies.education page 5
BTSA 1 M55
6 Déparaffinage
Puis il est nécessaire d’enlever la paraffine. ( en veillant à ne pas enlever la coupe de la lame)
Par passage de la lame dans 2 bains de toluène. (en veillant à la propreté du dernier bain)
safsolvent 2 min 2 min
Passage dans de l’alcool pour réhydrater l’échantillon.
Alcool 100° 80° 50°
Temps 2 min 2 min 2 min
On place la lame dans un bain d’eau du robinet pendant quelques secondes.
On place la lame dans un bain d’eau distillée pendant quelques secondes
7 Coloration à HE
Bain à l’hématoxyline, permet de colorer les noyaux 5 min
Rinçage eau du robinet 3 min
Rinçage eau distillée passage
Bain à l’éosine, permet de colorer le cytoplasme en rose 3 minutes
Rinçage eau distillée passage
Bain dans l’alcool à 95% 1 min
Bain dans l’alcool à 100 % 1 min
Laisser tremper la lame dans le --------- jusqu’au montage. On peut laisser la lame
plusieurs semaines dans le toluène.
Ph.A biotechnologies.education page 6
BTSA 1 M55
8 Montage
On place une goutte de safemont sur la lame, puis on dépose la lamelle que l’on fixe
soigneusement avec une pince.
Déterminer le rôle de l’intestin.
Critères de réussite d’une bonne lame.
Pas de pli sur la lame.
Pas de bulle au montage.
Bon contraste au niveau des noyaux.
Coupe complète de la pièce de l’intestin.
Epaisseur régulière dans la coupe
Ph.A biotechnologies.education page 7
Das könnte Ihnen auch gefallen
- Applications de la spectrophotomérie en phytochimie: sciencesVon EverandApplications de la spectrophotomérie en phytochimie: sciencesNoch keine Bewertungen
- TD N°2 Téchnique de Préparation Des Coupes Histologiques - CopieDokument4 SeitenTD N°2 Téchnique de Préparation Des Coupes Histologiques - CopieI Am a Queen100% (1)
- Préparations HistologiquesDokument4 SeitenPréparations HistologiquesCharlotte Taton73% (15)
- Fiche Technique Anapath La Coupe Au MicrotomeDokument1 SeiteFiche Technique Anapath La Coupe Au MicrotomeBektache nabyl100% (4)
- 17 Tissu Osseux TDDokument36 Seiten17 Tissu Osseux TDouis safaaNoch keine Bewertungen
- TD #2 L2 S.AlimentaireDokument31 SeitenTD #2 L2 S.AlimentaireSagacious IvejutenNoch keine Bewertungen
- GramDokument9 SeitenGramFatma fatiNoch keine Bewertungen
- TP5 Tissu SanguinDokument8 SeitenTP5 Tissu SanguinNihal KrikaNoch keine Bewertungen
- Le Mémoire CDDokument90 SeitenLe Mémoire CDCertaf Maghnja100% (3)
- TP1 de CytologieDokument6 SeitenTP1 de CytologieSonja BendadaNoch keine Bewertungen
- II-Méthodes D'étude de La C (1-M.optiques)Dokument59 SeitenII-Méthodes D'étude de La C (1-M.optiques)مريم البتولNoch keine Bewertungen
- مهم جداDokument222 Seitenمهم جداManal MounirNoch keine Bewertungen
- Memoire Final 2018 PDFDokument65 SeitenMemoire Final 2018 PDFchahinez bouikniNoch keine Bewertungen
- Fiche TD 1Dokument4 SeitenFiche TD 1nourzakiNoch keine Bewertungen
- Extraction d'ADNDokument2 SeitenExtraction d'ADNAMIENNoch keine Bewertungen
- GlucidesDokument34 SeitenGlucidesRémi Cechia100% (1)
- BIO 270 Physiologie Cellulaire Générale 2020 PDFDokument125 SeitenBIO 270 Physiologie Cellulaire Générale 2020 PDFTONDI ABDOU CHACOURNoch keine Bewertungen
- Guide de Préconisation Animalerie IPBSDokument33 SeitenGuide de Préconisation Animalerie IPBSKelly ChherNoch keine Bewertungen
- TP-Biofilm Et Hygiène-2022Dokument4 SeitenTP-Biofilm Et Hygiène-2022MERi BNoch keine Bewertungen
- Metabolisme Et Nutrition BacteriensDokument22 SeitenMetabolisme Et Nutrition BacteriensMohamed ECHAMAINoch keine Bewertungen
- 4-Les Lymphocytes B 2017 2018 PharmDokument33 Seiten4-Les Lymphocytes B 2017 2018 PharmYahia Benali100% (1)
- TP 2Dokument67 SeitenTP 2Dòùñïã ĎòùNoch keine Bewertungen
- BDokument3 SeitenBdotse kodzo hetsuNoch keine Bewertungen
- Compte Rendu UE35 Final3Dokument23 SeitenCompte Rendu UE35 Final3ÏsSå FøuNoch keine Bewertungen
- Tableau Comparatif Des Techniques ChromatographiquesDokument1 SeiteTableau Comparatif Des Techniques Chromatographiqueskhouloud gazzehNoch keine Bewertungen
- Flore Aérobie MésophileDokument1 SeiteFlore Aérobie Mésophilebouchra007Noch keine Bewertungen
- Chapitre 1 PDFDokument4 SeitenChapitre 1 PDFAsma MenaiNoch keine Bewertungen
- These Mounia Finale Soutenance 2020.docx 9898989 PDFDokument253 SeitenThese Mounia Finale Soutenance 2020.docx 9898989 PDFhomraniNoch keine Bewertungen
- Poly TP S1Dokument8 SeitenPoly TP S1m.aNoch keine Bewertungen
- Exploration Du Metabolisme GlucidiqueDokument40 SeitenExploration Du Metabolisme GlucidiqueAbdoulaye sebyNoch keine Bewertungen
- IntroductionDokument9 SeitenIntroductionSirine RhlNoch keine Bewertungen
- Buts Et Méthodes de L'Anatomie PathologiqueDokument62 SeitenButs Et Méthodes de L'Anatomie PathologiqueCosmin Florescu100% (1)
- La Spore Bactérienne FinDokument24 SeitenLa Spore Bactérienne FinMeriem TV100% (1)
- Mémoire Francesca - CopieDokument50 SeitenMémoire Francesca - CopieFrancesca WekamNoch keine Bewertungen
- Cours - 1: Définitions, Morphologie Et Structure Des ChampignonsDokument449 SeitenCours - 1: Définitions, Morphologie Et Structure Des ChampignonsKellia MvogheNoch keine Bewertungen
- Formation Des Biofilms Chez Les Bactéries Du Genre Bacillus Dans Les Aliments FermentésDokument88 SeitenFormation Des Biofilms Chez Les Bactéries Du Genre Bacillus Dans Les Aliments FermentésNKANGOU AmourNoch keine Bewertungen
- Mutation Et Mécanismes de Réparation de LDokument9 SeitenMutation Et Mécanismes de Réparation de LFati HaNoch keine Bewertungen
- Les Agents AntimicrobiensDokument33 SeitenLes Agents AntimicrobiensKenz L'AïdNoch keine Bewertungen
- Chapitre 5:: Le Système MusculaireDokument5 SeitenChapitre 5:: Le Système MusculaireRAYANE YTNoch keine Bewertungen
- 2016 TD 1 de Biologie CellulaireDokument36 Seiten2016 TD 1 de Biologie Cellulairezabe50% (2)
- Traitements Thermiques Du Lait+les Produits LaitiersDokument6 SeitenTraitements Thermiques Du Lait+les Produits Laitiersfifi fifiNoch keine Bewertungen
- M Moire-Finale-Pour-Impression-CorrigDokument60 SeitenM Moire-Finale-Pour-Impression-CorrigAmira AmouraNoch keine Bewertungen
- Transformation Des Produits Alimentaires Par Des EnzymesDokument58 SeitenTransformation Des Produits Alimentaires Par Des EnzymesEmnaNoch keine Bewertungen
- Compte Rendu - Plasmides Et PCRDokument4 SeitenCompte Rendu - Plasmides Et PCRLouise Equages100% (2)
- Spongiaires 1 PDFDokument5 SeitenSpongiaires 1 PDFNabil holmes100% (2)
- 4.techniques D'encemencement, D'isolement Et de Numération Des Microorganism 103348Dokument82 Seiten4.techniques D'encemencement, D'isolement Et de Numération Des Microorganism 103348www.rourita99Noch keine Bewertungen
- ElDokument6 SeitenElAmin MohammedNoch keine Bewertungen
- 5087243Dokument15 Seiten5087243Nabil holmesNoch keine Bewertungen
- Identification Biochimique Merad - Pp-ConvertiDokument27 SeitenIdentification Biochimique Merad - Pp-ConvertiMed amine El abassiNoch keine Bewertungen
- Le Principe de Fonctionnement de L'extraction SoxhletDokument3 SeitenLe Principe de Fonctionnement de L'extraction Soxhlet88bkcf9fhqNoch keine Bewertungen
- Electrophorese en Champ PulséDokument23 SeitenElectrophorese en Champ Pulséابو ريتاج100% (4)
- B. 1) Tissu Osseux (Partie 2), OssificationDokument7 SeitenB. 1) Tissu Osseux (Partie 2), OssificationILHEM RAMDANoch keine Bewertungen
- TD Pharmacognosie Serie 2Dokument2 SeitenTD Pharmacognosie Serie 2Tanga SergioNoch keine Bewertungen
- Diagnostic Microscopique Des MicrofilairesDokument18 SeitenDiagnostic Microscopique Des MicrofilairesMajeste EacNoch keine Bewertungen
- Nefoussi Hafsa Memoire Master 02Dokument78 SeitenNefoussi Hafsa Memoire Master 02Rafik Armadilo100% (1)
- TP 10 Et 11 Anatomie - Comparée - Des - Organes PDFDokument24 SeitenTP 10 Et 11 Anatomie - Comparée - Des - Organes PDFWansl MiNoch keine Bewertungen
- Rapport de Stage en MicrobiologieDokument61 SeitenRapport de Stage en MicrobiologieScribdTranslations100% (1)
- Microbiologie médicale II: stérilisation, diagnostic de laboratoire et réponse immunitaireVon EverandMicrobiologie médicale II: stérilisation, diagnostic de laboratoire et réponse immunitaireNoch keine Bewertungen
- Mon livre sur le diabète et ses complications: Expérience et spécificité au service d'un artVon EverandMon livre sur le diabète et ses complications: Expérience et spécificité au service d'un artNoch keine Bewertungen
- FTL4 MicrotomeDokument4 SeitenFTL4 MicrotomeBektache nabylNoch keine Bewertungen
- Memoire FcuDokument108 SeitenMemoire FcuBektache nabylNoch keine Bewertungen
- Td6 Techniques Immunologiques Et EnzymatiquesDokument2 SeitenTd6 Techniques Immunologiques Et EnzymatiquesBektache nabyl100% (1)
- Guide Danatomopathologie 2014Dokument88 SeitenGuide Danatomopathologie 2014Bektache nabylNoch keine Bewertungen
- HPV Oncogenes Recherche ADNDokument87 SeitenHPV Oncogenes Recherche ADNBektache nabylNoch keine Bewertungen
- Examen ExtemporanéDokument37 SeitenExamen ExtemporanéBektache nabylNoch keine Bewertungen
- Anatomie Et Cytologie PathologiquesDokument9 SeitenAnatomie Et Cytologie PathologiquesBektache nabylNoch keine Bewertungen
- Ue2 Chapitre 1 - Méthodes en HistologieDokument14 SeitenUe2 Chapitre 1 - Méthodes en Histologieakizar ZinoukNoch keine Bewertungen
- Module D'anatomie CytopathologiqueDokument117 SeitenModule D'anatomie CytopathologiqueBektache nabyl100% (1)
- Anapath Paramedicale Yous Zei 2Dokument125 SeitenAnapath Paramedicale Yous Zei 2Bektache nabyl100% (1)
- 01 - Introduction A La Mycologie 2018Dokument9 Seiten01 - Introduction A La Mycologie 2018Bektache nabylNoch keine Bewertungen
- Mtp-284450-Papillomavirus Les Virus Et La Physiopathologie de Linfection - Wo-dX38AAQEAAG4jpiEAAAAH-A.pdf Version 1uuuDokument15 SeitenMtp-284450-Papillomavirus Les Virus Et La Physiopathologie de Linfection - Wo-dX38AAQEAAG4jpiEAAAAH-A.pdf Version 1uuuBektache nabylNoch keine Bewertungen
- Mtp-284450-Papillomavirus Les Virus Et La Physiopathologie de Linfection - Wo-dX38AAQEAAG4jpiEAAAAH-A.pdf Version 1uuuDokument15 SeitenMtp-284450-Papillomavirus Les Virus Et La Physiopathologie de Linfection - Wo-dX38AAQEAAG4jpiEAAAAH-A.pdf Version 1uuuBektache nabylNoch keine Bewertungen
- Ciments, Mortiers, BétonsDokument3 SeitenCiments, Mortiers, Bétonsgeniecivil93100% (1)
- Les Structures IoniquesDokument15 SeitenLes Structures IoniquesChaoukiNoch keine Bewertungen
- Chapitre 2Dokument12 SeitenChapitre 2ChebouNoch keine Bewertungen
- Pharmacopee SommaireDokument54 SeitenPharmacopee SommaireElizabethNoch keine Bewertungen
- Techniques ImmunologiquesDokument1 SeiteTechniques ImmunologiquesqalbonNoch keine Bewertungen
- BIO 111 CHAP IXb 2021Dokument12 SeitenBIO 111 CHAP IXb 2021meteweflorindaNoch keine Bewertungen
- Guide Sécurité SVTDokument36 SeitenGuide Sécurité SVTSVT LyonNoch keine Bewertungen
- Cours Diag PhaseDokument52 SeitenCours Diag PhaseSalah-eddine SaidiNoch keine Bewertungen
- 40048254Dokument114 Seiten40048254Hazem ChakrounNoch keine Bewertungen
- New Document Microsoft WordDokument5 SeitenNew Document Microsoft Wordelyalaouim4Noch keine Bewertungen
- AYADI Walid Abdelghani GUENOUNE AbdelmalekDokument105 SeitenAYADI Walid Abdelghani GUENOUNE Abdelmalekathena7redNoch keine Bewertungen
- BATAN - Série 3 Chimie Minérale Descriptive - C245 - BCG - S4 - 2019 - 2020Dokument8 SeitenBATAN - Série 3 Chimie Minérale Descriptive - C245 - BCG - S4 - 2019 - 2020Yassine MOUHIBNoch keine Bewertungen
- Chim 2Dokument5 SeitenChim 2Karim DahbiNoch keine Bewertungen
- Polycopié Cours - Chimie Des Solutions SMPC SII 2021 - 2022Dokument55 SeitenPolycopié Cours - Chimie Des Solutions SMPC SII 2021 - 2022kahhoulomar1Noch keine Bewertungen
- Safajdir PhytDokument3 SeitenSafajdir Phytصفاء إجديرNoch keine Bewertungen
- Quadro de Cores Óleo Lefranc & Bourgeois PDFDokument2 SeitenQuadro de Cores Óleo Lefranc & Bourgeois PDF0703760% (1)
- Chapitre VI Cours Cristaux Ioniques - Abbas LhabibDokument26 SeitenChapitre VI Cours Cristaux Ioniques - Abbas LhabibdaghadjoudiNoch keine Bewertungen
- Bac-Blanc 2022-2023 - MaisonDokument9 SeitenBac-Blanc 2022-2023 - MaisonnjnNoch keine Bewertungen
- TPN-1 Réalisation Dun Pile Éléctrochimie GPDokument3 SeitenTPN-1 Réalisation Dun Pile Éléctrochimie GPعبدالسلام ارفيس75% (4)
- Eaux Usees PDFDokument57 SeitenEaux Usees PDFOssama ElbakoucheNoch keine Bewertungen
- Rosini HDDokument8 SeitenRosini HDZied Ben AliNoch keine Bewertungen
- Rappel de Cours Tech. de Base2éme ST (Déc. G.Mecanique)Dokument34 SeitenRappel de Cours Tech. de Base2éme ST (Déc. G.Mecanique)Mohamed RougabNoch keine Bewertungen
- Cours Valorisation Des Déchets PDFDokument100 SeitenCours Valorisation Des Déchets PDFImed CasanostraNoch keine Bewertungen
- Chimie Generale Partie2Dokument13 SeitenChimie Generale Partie2listesel788100% (2)
- Polymères CoursDokument34 SeitenPolymères CoursWallah Bakary100% (1)
- P39oxbenzoine PersaDokument8 SeitenP39oxbenzoine Persaayoub dahbi0% (1)
- Catalogue Formation Continue Chimie Materiaux Polymeres Metaux Composites Formulation Parfums Cosmetique Analyse Securite 2019 PDFDokument257 SeitenCatalogue Formation Continue Chimie Materiaux Polymeres Metaux Composites Formulation Parfums Cosmetique Analyse Securite 2019 PDFAtomer Formation0% (1)
- LaH - Amphi-3 - Diagrammes D'équilibre Alliages Fer-Carbone PDFDokument21 SeitenLaH - Amphi-3 - Diagrammes D'équilibre Alliages Fer-Carbone PDFMario StiflerNoch keine Bewertungen
- HSI Corrigé TP RédigéDokument8 SeitenHSI Corrigé TP RédigéWinoc AmadjikpèNoch keine Bewertungen
- Cours de Chimie Organique Chapitre 1 CTA1Dokument76 SeitenCours de Chimie Organique Chapitre 1 CTA1MohamedBelhoudaNoch keine Bewertungen