Beruflich Dokumente
Kultur Dokumente
C05 Indicateur Colore
Hochgeladen von
alinOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
C05 Indicateur Colore
Hochgeladen von
alinCopyright:
Verfügbare Formate
CHIMIE DOMAINE DE PRÉDOMINANCE DES INDICATEURS COLORÉS Chap.
5
I. Présentation de l’indicateur coloré
A. Objectifs
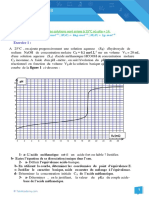
Comprendre le mode de fonctionnement d’un Absorbance A Spectre A = f() des deux
indicateur coloré. formes HIn et In- du BBT
Déterminer par spectrophotométrie le diagramme
de distribution, en fonction du pH, des formes acide
HIn
et basiques du bleu de bromothymol et en déduire
le domaine de prédominance de ces espèces en In-
fonction du pH.
Longueur
B. Le bleu de bromothymol (ou B.B.T.)
d’onde en
Un indicateur coloré est un couple acide/base, noté
nm
pour simplifier HIn/In-, dont les formes acide HIn
-
et basique In ont des couleurs différentes. 400 500 600 700
Dans le cas du bleu de bromothymol, la forme acide HIn est jaune et la forme basique In - est bleue.
La prédominance de l’une des formes de l’indicateur coloré en solution est donc observable
visuellement.
L’évolution des concentrations des formes acide et basique sera suivie par une méthode
spectrophotométrique. Ces deux formes n’ayant pas la même couleur présentent donc des spectres
d’absorption différents.
II. Évolution des concentrations des formes acide et basique du bleu de bromothymol
A. Matériel et produits
pipettes de 1,0 mL et 20,0 mL. Solution de bleu de bromothymol de
Une burette de 25,0 mL concentration molaire 3,00.10-4 mol.L-1 dans une
2 bechers de 50 mL. burette au bureau.
pH-mètre sur le bureau du professeur. Solution d’hydroxyde de sodium de
Spectrophotomètre et cuves concentration molaire 1,00.10-1 mol.L-1.
Solution de « Britton-Robinson ».
Note : La solution de « Britton-Robinson » a une composition telle que son pH varie linéairement
avec la quantité d’ions hydroxyde HO- ajoutés.
B. Manipulation
Chaque groupe doit prendre en charge 2 ou 3 solutions : les résultats seront mis en commun et
exploités par tous.
Toutes les mesures de pH seront effectuées avec le même pH-mètre.
C. Préparation de la solution Sn
Prendre dans un pot environ 40 mL de solution «Britton-Robinson ».
A l’aide d’une pipette jaugée, (ATTENTION au 2ème trait de jauge) verser dans un premier becher, un
volume V = 20,0 mL de solution «Britton-Robinson ».
Ajouter avec la burette graduée, le volume Vn de solution d’hydroxyde de sodium de concentration
molaire 1,00.10-1 mol.L-1 selon les indications figurant dans le tableau page suivante.
Prélever à la pipette jaugée 20,0 mL (ATTENTION au 2ème trait de jauge) de la solution ainsi
préparée ;
Verser dans un second becher numéroté ;
Ajouter, à l’aide de la burette du bureau, 1,00 mL de solution de bleu de bromothymol, soit (S n) la
solution ainsi préparée.
D. Mesures
Mesurer le pH de la solution (Sn) sur le seul pH-mètre à votre disposition.
Mesure de l’absorbance de la solution (Sn)
Régler le spectrophotomètre à la longueur d’onde = 620 nm
Faire le blanc avec un mélange de 2/3 de solution de « Britton-Robinson » et 1/3 de solution de
soude.
Mesurer l’absorbance A de la solution (Sn).
28/11/09 499724955.doc 1/2
E. Résultats
Consigner les valeurs mesurées du pH et de l’absorbance dans le tableau ci-dessous :
Solution [In-] [HIn]
Groupes Vn (mL) Couleur pH A log(r) = log()
Sn (mol.L ) (mol.L-1 )
-1
1 1 3 5 4,00
2 2 4 6 4,50
3 3 5 7 5,00
4 4 6 8 5,50
5 5 7 9 6,00
6 6 8 1 6,50
7 7 9 2 7,00
8 8 1 3 7,50
9 9 2 4 8,00
10 1 3 5 8,50
11 2 4 6 9,00
III. Exploitation des résultats
A. Questions préliminaires
1) Calculer la concentration c en bleu de bromothymol apporté dans la solution (S n).
2) Démontrer la relation entre les concentrations : c = [HIn] + [In-]
3) En analysant le graphique des absorbances des formes acide et basique du bleu de bromothymol, que
peut-on penser de l’absorbance des formes HIn et In- à la longueur d’onde choisie = 620 nm ?
En déduire la relation entre l’absorbance A de la solution et la concentration de la forme basique [In -].
4) Dans le cas de la solution n°11, la forme basique In- est supposée prédominer largement sur la forme
acide HIn, et l’on peut alors négliger la concentration [HIn] devant [In -]. Montrer alors que AMAX =
k.c.
5) Établir alors la relation permettant de calculer la concentration [In -] en fonction de A, AMAX et c.
6) En déduire la relation permettant de calculer [HIn] en fonction de A, AMAX et c.
F. Domaines de prédominance
1) A l’aide de Regressi, créer deux variables expérimentales pH et A et entrer les valeurs au clavier.
Créer les grandeurs paramètres c et Amax ; entrer les valeurs au clavier.
2) Créer les grandeurs calculées nommées base (= [In-]) et acide (= [Hin]) en fonction de A, Amax et c.
3) Afficher les graphes acide = f(pH) et base = g(pH) dans la même fenêtre.
4) Modéliser chaque courbe par une sigmoïde.
5) On considère qu’une forme prédomine devant une autre si sa concentration est supérieure. Indiquer
alors graphiquement les domaines de prédominance de la forme acide HIn et basique In-.
6) Déterminer la zone de virage de cet indicateur coloré sachant que la zone de virage d’un indicateur
coloré est généralement définie par l’intervalle de pH dans lequel le rapport des concentrations
molaires des formes acide et basique est compris entre et 10, soit < < 10.
G. Prolongement
1) Créer la grandeur calculée le rapport logr = log() puis visualiser la courbe pH = f(logr). Quelle est
l’allure de la courbe ? Quelle est son équation ?
2) Déterminer la zone de virage de cet indicateur coloré sachant que la zone de virage d’un indicateur
coloré est généralement définie par l’intervalle de pH dans lequel le rapport des concentrations
molaires des formes acide et basique est compris entre et 10, soit < < 10 ou -1 < log() < 1.
3) A partir du spectre d’absorption A = f(), expliquer pourquoi la forme acide HIn apparaît jaune et la
forme basique In- apparaît bleue.
28/11/09 499724955.doc 2/2
Das könnte Ihnen auch gefallen
- Objectifs: IV Chimie: Enseignement Obligatoire. B. La Transformation D'un Système Est-Elle Toujours Rapide ?Dokument10 SeitenObjectifs: IV Chimie: Enseignement Obligatoire. B. La Transformation D'un Système Est-Elle Toujours Rapide ?Yosr RhoumaNoch keine Bewertungen
- Chimie TP6 ProfDokument4 SeitenChimie TP6 ProfBrahim ABAGHOUGHNoch keine Bewertungen
- 2008 National Exo1 Sujet BBT 6 5ptsDokument4 Seiten2008 National Exo1 Sujet BBT 6 5ptsmoezbouchnak80Noch keine Bewertungen
- TP - CH - Tacide Et BaseDokument4 SeitenTP - CH - Tacide Et BasebounegabNoch keine Bewertungen
- Rapport de TP ExempleDokument10 SeitenRapport de TP Exemplealexandre FRANKENoch keine Bewertungen
- Série Dosage PDFDokument8 SeitenSérie Dosage PDFAya ArNoch keine Bewertungen
- Serie D'exercices Sur C5 Et C6: IA Kédougou - Cellule Mixte Des Sciences Physiques - Terminale S 2019-2020Dokument4 SeitenSerie D'exercices Sur C5 Et C6: IA Kédougou - Cellule Mixte Des Sciences Physiques - Terminale S 2019-2020kathyNoch keine Bewertungen
- Série DosageDokument8 SeitenSérie DosageAicha Daou100% (1)
- Indicateurs ColorésDokument3 SeitenIndicateurs ColorésAicha DiabyNoch keine Bewertungen
- Fiches Exercices Titrages-2010Dokument3 SeitenFiches Exercices Titrages-2010Daniel Parnor100% (1)
- Transformation Liée À Des Réactions Acides Et Bases (WWW - Pc1.ma)Dokument21 SeitenTransformation Liée À Des Réactions Acides Et Bases (WWW - Pc1.ma)Abderrazzak ElhaimerNoch keine Bewertungen
- Pka BBTDokument2 SeitenPka BBTananNoch keine Bewertungen
- 2016 AmSud Exo2 Sujet Benzaldehyde 9ptsDokument7 Seiten2016 AmSud Exo2 Sujet Benzaldehyde 9ptsRichad NaziralyNoch keine Bewertungen
- Dosage PHDokument2 SeitenDosage PHOumar TraoréNoch keine Bewertungen
- C5 Sol Aqueuses WahabDiopDokument3 SeitenC5 Sol Aqueuses WahabDiopGaye Bachir100% (1)
- Ds 06-IbuprofeneDokument3 SeitenDs 06-IbuprofeneThomas champagneNoch keine Bewertungen
- TS TPC3 SpectroBBTDokument3 SeitenTS TPC3 SpectroBBTBrahim ABAGHOUGHNoch keine Bewertungen
- Bac Blanc ChimieDokument5 SeitenBac Blanc ChimieMohamed SaidiNoch keine Bewertungen
- Acidite D Un VinaigreDokument6 SeitenAcidite D Un Vinaigreboudriat ahmedNoch keine Bewertungen
- 2013 09 Antilles Exo2 Sujet Ibuprofene 11ptsDokument4 Seiten2013 09 Antilles Exo2 Sujet Ibuprofene 11ptsceliabenayNoch keine Bewertungen
- Reactions Acido BasiquesDokument3 SeitenReactions Acido Basiquesh3r3t1kNoch keine Bewertungen
- TD Gog N°2Dokument2 SeitenTD Gog N°2Léo Moraless IINoch keine Bewertungen
- Baccalauréat Blanc Science Physique Avril 2022Dokument2 SeitenBaccalauréat Blanc Science Physique Avril 2022pemejosueNoch keine Bewertungen
- TPC05 DeterminationdepKaDokument3 SeitenTPC05 DeterminationdepKaArnold Murphy Elouma NdingaNoch keine Bewertungen
- Dosage 2Dokument3 SeitenDosage 2Riadh Marouani100% (1)
- TD #3 Chimie Analytique - 2 Année Pharmacie Batna2 - Dr. MaghchicheDokument4 SeitenTD #3 Chimie Analytique - 2 Année Pharmacie Batna2 - Dr. Maghchicheromaissa benchadiNoch keine Bewertungen
- TP 2 Tda L3 GDPDokument3 SeitenTP 2 Tda L3 GDPMål ÆkNoch keine Bewertungen
- TP 2 Tda l3 Gdp-1Dokument3 SeitenTP 2 Tda l3 Gdp-1Mål ÆkNoch keine Bewertungen
- TP 2 Tda L3 GDPDokument3 SeitenTP 2 Tda L3 GDPLina alikh100% (2)
- R2013SM PDFDokument9 SeitenR2013SM PDFmjidooooNoch keine Bewertungen
- Mission - N°4 - Pka - BBT - Version ConfinementDokument2 SeitenMission - N°4 - Pka - BBT - Version ConfinementAmélie D.Noch keine Bewertungen
- 6 Exercices Réactions Acido-Basique 2Dokument1 Seite6 Exercices Réactions Acido-Basique 2Alaoui Abdallah0% (1)
- Ex 1Dokument6 SeitenEx 1teghre chekhne El koryNoch keine Bewertungen
- 2008 Liban Exo2 SujetpKaBBP 6 5ptsDokument4 Seiten2008 Liban Exo2 SujetpKaBBP 6 5ptsHarakat ElhoucineNoch keine Bewertungen
- Chap 06 Dosage Par TitrageDokument6 SeitenChap 06 Dosage Par TitrageYounes MAZOUARNoch keine Bewertungen
- TSP2SP1Ch18T11-TP10 Corrige Destop AspirineDokument5 SeitenTSP2SP1Ch18T11-TP10 Corrige Destop AspirineAyoub AinaneNoch keine Bewertungen
- Nath 24Dokument6 SeitenNath 24Khadija IfriNoch keine Bewertungen
- الامتحان الوطني في مادة الفيزياء والكيمياء 2013 علوم رياضية ترجمة فرنسية الدورة الاستدراكيةDokument9 Seitenالامتحان الوطني في مادة الفيزياء والكيمياء 2013 علوم رياضية ترجمة فرنسية الدورة الاستدراكيةFahmiNoch keine Bewertungen
- DS Type Bac N2 TS3Dokument5 SeitenDS Type Bac N2 TS3Ahmed TafouktNoch keine Bewertungen
- ch13 Reaction Chimique Echange ProtonDokument5 Seitench13 Reaction Chimique Echange ProtonSophie RosiNoch keine Bewertungen
- SeÌ Rie 1 - Dosage Acido-BasiqueDokument2 SeitenSeÌ Rie 1 - Dosage Acido-Basiqueb01554837Noch keine Bewertungen
- Chimie-Dosages Par TitragesDokument16 SeitenChimie-Dosages Par TitragescontroleinterneNoch keine Bewertungen
- 201704071220521Dokument6 Seiten201704071220521paixdedieu90Noch keine Bewertungen
- Ece 24 PC 01Dokument5 SeitenEce 24 PC 016fpqgqr4gsNoch keine Bewertungen
- TP BBT Indicateurs Colores (Home) CorrectionDokument6 SeitenTP BBT Indicateurs Colores (Home) CorrectionBrahim ABAGHOUGHNoch keine Bewertungen
- Les Indicateures ColoreesDokument9 SeitenLes Indicateures ColoreesmedNoch keine Bewertungen
- 2022 Polynesie J1 Exo1 Sujet SyntheseEsterFloral 10ptsDokument6 Seiten2022 Polynesie J1 Exo1 Sujet SyntheseEsterFloral 10ptsemmanuel.traceNoch keine Bewertungen
- Sujetbb 12 Spe 29 JanvDokument6 SeitenSujetbb 12 Spe 29 JanvAmza FarelNoch keine Bewertungen
- ChimEq - Syllabus TP - 2023-2024Dokument26 SeitenChimEq - Syllabus TP - 2023-2024juanlognoulNoch keine Bewertungen
- La Réaction A Lieu Dans Les Deux Sens-1Dokument13 SeitenLa Réaction A Lieu Dans Les Deux Sens-1Mehdi BnmssdNoch keine Bewertungen
- TP Titrage PhmetriqueDokument8 SeitenTP Titrage PhmetriqueSoundous TayssirNoch keine Bewertungen
- (C4) TDDokument3 Seiten(C4) TDMeneNoch keine Bewertungen
- Equilibre chimique3PCDokument3 SeitenEquilibre chimique3PCKhalid AwtmNoch keine Bewertungen
- TP 3 Chimie 1Dokument4 SeitenTP 3 Chimie 1Marouane Taibini100% (2)
- Faculté Pluridisciplinaire de Nador AnnéeDokument3 SeitenFaculté Pluridisciplinaire de Nador AnnéeHakim BilNoch keine Bewertungen
- TP DosageDokument8 SeitenTP DosageYosr Rhouma67% (3)
- TP 3 STDokument4 SeitenTP 3 STABDelpari SeraicheNoch keine Bewertungen
- LycéeBBangangté Chimie TleCD BaccBlanc3 2019 PDFDokument4 SeitenLycéeBBangangté Chimie TleCD BaccBlanc3 2019 PDFESSOME ESSOME OLIVIER STEPHANENoch keine Bewertungen
- 06 BBT CorrectionDokument4 Seiten06 BBT CorrectionChartier JulienNoch keine Bewertungen
- Applications de la spectrophotomérie en phytochimie: sciencesVon EverandApplications de la spectrophotomérie en phytochimie: sciencesNoch keine Bewertungen
- 9782340002081Dokument11 Seiten9782340002081msabNoch keine Bewertungen
- Dusa 2 Dspe 2 Dsujet 2 Dtitragechlorureconductimetrie 2 D 4 PtsDokument3 SeitenDusa 2 Dspe 2 Dsujet 2 Dtitragechlorureconductimetrie 2 D 4 Ptsla physique selon le programme FrançaisNoch keine Bewertungen
- Especes Chimiques en Solution AqueuseDokument7 SeitenEspeces Chimiques en Solution AqueuseValéry Epee EbongueNoch keine Bewertungen
- Exercices C7 TSDokument2 SeitenExercices C7 TSkondemamadousaidouNoch keine Bewertungen
- ToutDokument36 SeitenToutYacoub CheikhNoch keine Bewertungen
- Chapitre3 Caracterisation de Quelques IonsDokument7 SeitenChapitre3 Caracterisation de Quelques IonsAlhou Inabigue HarounaNoch keine Bewertungen
- TP1CHIMIEDokument4 SeitenTP1CHIMIEKhalid ChrisNoch keine Bewertungen
- Cours TitragesDokument6 SeitenCours TitragesKira BeatboxNoch keine Bewertungen
- 5 PHDokument6 Seiten5 PHDaboNoch keine Bewertungen
- TD AMINES 2024-Sabs - WahabdiopDokument3 SeitenTD AMINES 2024-Sabs - Wahabdiopbibos8318Noch keine Bewertungen
- 2023 09 Polynesie OriginalDokument14 Seiten2023 09 Polynesie OriginalgwendalvignetNoch keine Bewertungen
- dc3 4eme Sadiki 12 MathsDokument5 Seitendc3 4eme Sadiki 12 MathsLotfi BoucharebNoch keine Bewertungen
- Pathologie Des Ouvrages en Béton Armé FiniDokument31 SeitenPathologie Des Ouvrages en Béton Armé FiniHAYTHEM100% (3)
- Serie 7 8 Acides Faibles Bases Faibles Solutions TamponsDokument10 SeitenSerie 7 8 Acides Faibles Bases Faibles Solutions TamponsBrahim DahaiNoch keine Bewertungen
- Force Des Acides Et BasesDokument4 SeitenForce Des Acides Et Basestjmhfkdkd5Noch keine Bewertungen
- Cahier Des Textes 2BACSVTDokument18 SeitenCahier Des Textes 2BACSVTAbdelbar ElkhachineNoch keine Bewertungen
- DS1 FinalDokument3 SeitenDS1 FinalYassir RochdNoch keine Bewertungen
- Capture D'écran . 2022-06-08 À 17.26.29Dokument21 SeitenCapture D'écran . 2022-06-08 À 17.26.29FirstofalltimeNoch keine Bewertungen
- Physique-Chimie DNB 2018 Sept Metropole Serie AgricoleDokument2 SeitenPhysique-Chimie DNB 2018 Sept Metropole Serie Agricolelouanejacquet29042009Noch keine Bewertungen
- La Vie Aquatique CorrecDokument2 SeitenLa Vie Aquatique Correcabdo sadi100% (1)
- Sujet 6-2Dokument7 SeitenSujet 6-2Najimou Alade TidjaniNoch keine Bewertungen
- PH - Transformation ChimiqueDokument4 SeitenPH - Transformation Chimiqueautotestentretien.servicesNoch keine Bewertungen
- TP Comment Synthétiser Et Caractériser Un PolymèreDokument3 SeitenTP Comment Synthétiser Et Caractériser Un PolymèrealexbardonfrNoch keine Bewertungen
- Devoir Surveillé #2 Semestre II, 2BAC BIOF, PC - SM Et SVT, 2020-2021, PR JENKAL RACHIDDokument3 SeitenDevoir Surveillé #2 Semestre II, 2BAC BIOF, PC - SM Et SVT, 2020-2021, PR JENKAL RACHIDHiba NajiNoch keine Bewertungen
- C9 ForceDesAcidesEtBasesEleveDokument13 SeitenC9 ForceDesAcidesEtBasesEleveYann FourteauNoch keine Bewertungen
- 26 Dosage 3Dokument3 Seiten26 Dosage 3Ilyes Ben Jemaa0% (1)
- TleD - CH - L11 - Dosage Acido-BasiqueDokument10 SeitenTleD - CH - L11 - Dosage Acido-BasiqueHamadi DialloNoch keine Bewertungen
- TP Chimie Compte Rendu Preparation Dune SolutionDokument6 SeitenTP Chimie Compte Rendu Preparation Dune SolutionAbdellah BerrouachdiNoch keine Bewertungen
- Fiches 4.3 Acides Et BasesDokument18 SeitenFiches 4.3 Acides Et Basesclara demeuldreNoch keine Bewertungen
- Cours. Chimie de L'eauDokument14 SeitenCours. Chimie de L'eauHamidaNoch keine Bewertungen