Beruflich Dokumente
Kultur Dokumente
B040BCD9-1D30-41BE-B20F-F4FCB84AC341 (2)
Hochgeladen von
John WongCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
B040BCD9-1D30-41BE-B20F-F4FCB84AC341 (2)
Hochgeladen von
John WongCopyright:
Verfügbare Formate
CHEMIE-KLAUSUR II für T1W-Klasse 19.08.
2021
1. Barium ist ein Metall, Brom ist eine braune Flüssigkeit der Dichte 3,12 g∙cm 3. Barium und
Brom reagieren exotherm miteinander zu einem weißen, wasserlöslichen Feststoff.
a) Formulieren Sie die Reaktionsgleichung.
b) Sie geben 180 g Barium und 60 ml Brom in das Reaktionsgefäß. Erklären Sie, ob beide
Stoffe vollständig miteinander reagieren oder ob von einem Stoff ein Rest übrig bleibt.
c) Berechnen Sie die Masse des entstehenden Produkts.
2. Misst man die Ausbeute von Schwefeltrioxid (SO3) in Vol.-% bei der Reaktion zwischen
Schwefeldioxid (SO2) und Sauerstoff, so stellt sich heraus, dass sich bei der Temperatur von
900 K rund 65 Vol.-% Schwefeltrioxid und bei 700 K rund 96 Vol.-% Schwefeltrioxid mit
Sauerstoff und Schwefeltrioxid im Gleichgewicht befinden.
a) Geben Sie die Reaktionsgleichung für die Darstellung von Schwefeltrioxid.
b) Erläutern Sie den Einfluss der Temperatur bei dieser Gleichgewichtsreaktion.
c) Erklären Sie, wie sich das Gleichgewicht durch Erhöhung des Druckes verhält.
3. Ammoniak, der u.a. für die Düngemittelherstellung benötigt wird, wird aus den
entsprechenden Elementen nach dem Haber-Bosch-Verfahren hergestellt.
a) Formulieren Sie die Reaktion für die Synthese von Ammoniak.
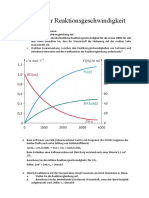
b) Begründen Sie mit Hilfe der unten stehenden Abbildung den Einfluss der Temperaturen und
der Drücke.
4. Gegeben ist die folgende nicht-stöchiometrische Gleichgewichtsreaktion:
CHEMIE-KLAUSUR II für T1W-Klasse 19.08.2021
CS2 (g) + H2 (g) ⇄ CH4 (g) + H2S (g) KC = 27,8 ℓ2 · molˉ2
a) Eine Erhöhung der Temperatur führt zur Erhöhung der CS2-Konzentration. Deuten Sie diese
Erscheinung an. Was passiert mit der Gleichgewichtskonstante?
b) Bestimmen Sie die Gleichgewichtskonstante KC' für die folgende Reaktion:
½ CH4 (g) + H2S (g) ⇄ ½ CS2 (g) + 2 H2 (g)
5. Die Gleichgewichtskontante für die folgende Reaktion bei 458°C beträgt KC = 0,02.
H2 (g) + I2 (g) ⇄ 2 HI (g)
Für die folgende Reaktion bei 425°C beträgt die Gleichgewichtskonstante KC = 0,054:
2 HI (g) ⇄ H2 (g) + I2 (g)
Erklären Sie, ob es sich bei der Reaktion: H2 (g) + I2 (g) ⇄ 2 HI (g) um eine endotherme
oder exotherme Reaktion handelt.
6. Bei hohen Temperaturen führt z. B. die Reduktion von Eisen(III)-oxid (Fe2O3 (f)) durch
Kohlenstoff (f) zum Eisen (f) und Kohlendioxid (g). Wenn die Reaktion eine
Gleichgewichtsreaktion darstellt, erklären Sie, was passieren würde, wenn die folgende
Maßnahme auf das Gleichgewichtssystem ausgeübt wird.
a) Zugabe von Kohlenstoffdioxid.
b) Entfernung von Eisen(III)-oxid.
c) Erhöhung des Druckes des Systems.
Das könnte Ihnen auch gefallen
- Thermodynamik MKE-Übungen+Hinweise-V3.4Dokument20 SeitenThermodynamik MKE-Übungen+Hinweise-V3.4AlexThierheimerNoch keine Bewertungen
- Übung Kap6Dokument10 SeitenÜbung Kap6kekekNoch keine Bewertungen
- Übungsaufgaben - Massenwirkungsgesetz - LösungenDokument2 SeitenÜbungsaufgaben - Massenwirkungsgesetz - LösungenNgọc NghĩaNoch keine Bewertungen
- 7.3 Prinzip Des Kleinsten Zwangs - Le Chatelier: A) Ausweichen Bei DruckänderungenDokument3 Seiten7.3 Prinzip Des Kleinsten Zwangs - Le Chatelier: A) Ausweichen Bei DruckänderungenNgọc NghĩaNoch keine Bewertungen
- Kapitel 5Dokument2 SeitenKapitel 5ayashadornNoch keine Bewertungen
- 4713 Chapter 08exDokument22 Seiten4713 Chapter 08exchinensisNoch keine Bewertungen
- Übungsbeispiele 2007Dokument18 SeitenÜbungsbeispiele 2007Dardan H JashariNoch keine Bewertungen
- Verbrennung Und DampferzeugungDokument57 SeitenVerbrennung Und Dampferzeugung86pqkcd4pxNoch keine Bewertungen
- Waermebilanz 2002Dokument20 SeitenWaermebilanz 2002Anonymous T02GVGzBNoch keine Bewertungen
- Kapitel 4Dokument2 SeitenKapitel 4ayashadornNoch keine Bewertungen
- 2009 E Chimie Anorganica I Niv I Si II in Limba GermanaDokument4 Seiten2009 E Chimie Anorganica I Niv I Si II in Limba GermanadpNoch keine Bewertungen
- Inbound 5183008975313953121Dokument4 SeitenInbound 5183008975313953121swkn8pdtvbNoch keine Bewertungen
- 3.2 Schüler Schreiben OCR PAG AufDokument3 Seiten3.2 Schüler Schreiben OCR PAG AufScribdTranslationsNoch keine Bewertungen
- 3.1.A.Das Chemische Gleichgewicht PDFDokument9 Seiten3.1.A.Das Chemische Gleichgewicht PDFAisyah MusaNoch keine Bewertungen
- 1 Chemie Ist Wie Wirtschaft: Chemie - Die Stimmt!" 2017/2018 Aufgabenblatt 2. Runde - Klasse 9Dokument5 Seiten1 Chemie Ist Wie Wirtschaft: Chemie - Die Stimmt!" 2017/2018 Aufgabenblatt 2. Runde - Klasse 9Quốc NguyễnNoch keine Bewertungen
- Gleichgewicht Der Gase 37. JahrgangDokument13 SeitenGleichgewicht Der Gase 37. JahrgangJohn WongNoch keine Bewertungen
- Stöchiometrie AufgabenDokument5 SeitenStöchiometrie AufgabenDaveNoch keine Bewertungen
- 2-8 Gr25 SL 2022Dokument10 Seiten2-8 Gr25 SL 2022Sakon UkonNoch keine Bewertungen
- 10 Übungsblatt PC1 WS19-20 KM ABDokument1 Seite10 Übungsblatt PC1 WS19-20 KM ABSherrine HartonoNoch keine Bewertungen
- EnergetikDokument2 SeitenEnergetikshahedzyadah3Noch keine Bewertungen
- BK01 - Nebenfach Chemie - Klausurfragen 13.07.07Dokument10 SeitenBK01 - Nebenfach Chemie - Klausurfragen 13.07.07script-bertNoch keine Bewertungen
- Seminar 10Dokument40 SeitenSeminar 10api-3697516100% (1)
- Aufgabenbuch 2017Dokument220 SeitenAufgabenbuch 2017Quoc AnhNoch keine Bewertungen
- Estado GaseosoDokument2 SeitenEstado GaseosoFELIX CUELLARNoch keine Bewertungen
- 05 SRÃ AS EntropieDokument4 Seiten05 SRÃ AS EntropiePhilippNoch keine Bewertungen
- Chemie BeispielDokument3 SeitenChemie BeispielDavid EnriquezNoch keine Bewertungen
- 3.3.a.chemische ThermodynamikDokument15 Seiten3.3.a.chemische Thermodynamikcacbu100% (1)
- Übungsklausur TH 1Dokument4 SeitenÜbungsklausur TH 1Quelle des ErfolgsNoch keine Bewertungen
- B.ardere 2018Dokument24 SeitenB.ardere 2018claudiu feierNoch keine Bewertungen
- Ac Ref Gleichgewicht LöslichkeitDokument13 SeitenAc Ref Gleichgewicht LöslichkeitduspakepseNoch keine Bewertungen
- Semianr1 AwDokument28 SeitenSemianr1 Awapi-3697516100% (1)
- Übungen MolmasseDokument11 SeitenÜbungen MolmasseДилшода ИсмоиловаNoch keine Bewertungen
- 11 - KA2 - Übungen Zur Klassenarbeit - VerbDokument3 Seiten11 - KA2 - Übungen Zur Klassenarbeit - Verbbendix.pfeiferNoch keine Bewertungen
- Korrosion: SchulversuchspraktikumDokument15 SeitenKorrosion: SchulversuchspraktikumasdfasddfNoch keine Bewertungen
- Meixner Chemie 1Dokument38 SeitenMeixner Chemie 1Diemo DaumNoch keine Bewertungen
- Chemistry F3T2 QSDokument8 SeitenChemistry F3T2 QSAugustine stertNoch keine Bewertungen
- AB Salzsäure + Marmor Theoretische AufgabeDokument1 SeiteAB Salzsäure + Marmor Theoretische Aufgabephaos85Noch keine Bewertungen
- ATD Fragenkatalog SS16 V2bDokument11 SeitenATD Fragenkatalog SS16 V2bKarim SalehNoch keine Bewertungen
- Gemischte AufgabenDokument1 SeiteGemischte AufgabenchemtrailsoverNoch keine Bewertungen
- Gemischte Aufgaben Mit LÃ Sung Gr.1Dokument3 SeitenGemischte Aufgaben Mit LÃ Sung Gr.1chemtrailsoverNoch keine Bewertungen
- Chemisehes Zentralblatt.: A. Allgemeine Und Płiysikalische ChemieDokument224 SeitenChemisehes Zentralblatt.: A. Allgemeine Und Płiysikalische ChemieKris MNoch keine Bewertungen
- Guia Esteq 1°BDokument3 SeitenGuia Esteq 1°BPaola Casanova moragaNoch keine Bewertungen
- U Êbungszettel2 UNT.059UBDokument2 SeitenU Êbungszettel2 UNT.059UBLukas M.Noch keine Bewertungen
- TUT - Molare Massen, Stoffmengen Und Chemische GleichungenDokument3 SeitenTUT - Molare Massen, Stoffmengen Und Chemische Gleichungenteipel21Noch keine Bewertungen
- AB Übungen REaktionsgeschwindigkeitDokument2 SeitenAB Übungen REaktionsgeschwindigkeitphaos85Noch keine Bewertungen
- Modulklausur 2015Dokument3 SeitenModulklausur 2015KossieNoch keine Bewertungen
- Uebungsaufgaben Allgemeine Chemie - KrausDokument15 SeitenUebungsaufgaben Allgemeine Chemie - KrausNafasNoch keine Bewertungen
- Uebungsblatt 2-2020 - Loesungen-FreigeschaltetDokument9 SeitenUebungsblatt 2-2020 - Loesungen-FreigeschaltetFerryNoch keine Bewertungen
- Übungen Zum StöchiometrieDokument2 SeitenÜbungen Zum StöchiometrieДилшода ИсмоиловаNoch keine Bewertungen
- Einführung in Die Allgemeine Und Anorganische Chemie 3Dokument7 SeitenEinführung in Die Allgemeine Und Anorganische Chemie 3David AhouaNoch keine Bewertungen
- Krasserstoff - CH - 04 - Dossier - St"chiometrieDokument4 SeitenKrasserstoff - CH - 04 - Dossier - St"chiometrieGreezyNoch keine Bewertungen
- UE5 CHE SolutionDokument4 SeitenUE5 CHE SolutionLukas M.Noch keine Bewertungen
- RedoxreaktionenDokument15 SeitenRedoxreaktionenOdranoel RellekNoch keine Bewertungen
- E D Chimie Anorganica 2024 Var Simulare LGEDokument2 SeitenE D Chimie Anorganica 2024 Var Simulare LGEMarin FlorinaNoch keine Bewertungen
- Tablas TermodinamicasDokument23 SeitenTablas TermodinamicasDavid EscobarNoch keine Bewertungen
- E D Chimie Organica 2023 Var Simulare LGEDokument2 SeitenE D Chimie Organica 2023 Var Simulare LGEMirela ElenaNoch keine Bewertungen
- CHE.119 Uebungsblatt5 GekuerztDokument1 SeiteCHE.119 Uebungsblatt5 Gekuerztmaneubacher2311Noch keine Bewertungen
- Stöch - Für TestDokument1 SeiteStöch - Für Testsiegfried.ender.martinNoch keine Bewertungen
- Umweltchemie: Eine Einführung mit Aufgaben und LösungenVon EverandUmweltchemie: Eine Einführung mit Aufgaben und LösungenNoch keine Bewertungen