Beruflich Dokumente
Kultur Dokumente
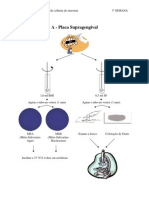
Cabulas Dos Musculos 1
Hochgeladen von
api-264291880 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
344 Ansichten1 SeiteCopyright
© Attribution Non-Commercial (BY-NC)
Verfügbare Formate
DOC, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Attribution Non-Commercial (BY-NC)
Verfügbare Formate
Als DOC, PDF, TXT herunterladen oder online auf Scribd lesen
0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
344 Ansichten1 SeiteCabulas Dos Musculos 1
Hochgeladen von
api-26429188Copyright:
Attribution Non-Commercial (BY-NC)
Verfügbare Formate
Als DOC, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 1
Tecido muscular estriado esquelético: é formado por feixes de células musculares (fibras) cilíndricas, muito alongadas e com vários
núcleos localizados na periferia da célula.
Apresenta estriação transversal. Este tipo de tecido muscular apresenta contracção rápida, forte, descontínua, vigorosa, sujeita a controlo voluntário e sem actividade autónoma.
Este tecido é o constituinte principal dos músculos. A força total desenvolvida pelo músculo esquelético depende de 2 factores: somação (número de contracções induzidas
pelos potenciais de acção numa fibra muscular) e recrutamento (número crescente de fibras activas num dado momento).
Tecido muscular estriado cardíaco: apresenta estrias transversais (semelhantes às fibras do tipo I do músculo esquelético), é formado por células musculares (fibras) alongadas
e ramificadas. Os núcleos estão localizados no centro da célula e existe um só núcleo em cada célula. As fibras ligam-se topo a topo por intermédio de discos intercalares
(estruturas encontradas exclusivamente no músculo cardíaco e que permitem a comunicação eléctrica entre as fibras) e apresentam estriação transversal. As fibras formam um
sincício funcional, mas não físico e apresentam contracção involuntária, vigorosa e rítmica. Este tecido existe apenas no coração. O tecido muscular cardíaco não apresenta
somação. A sua superfície membranária apresenta canais de Ca 2+ voltagem-dependentes. A entrada de cálcio pelo potencial de acção é necessária para o acoplamento excitação-
contracção.
Tecido muscular liso: é formado por aglomerados de células fusiformes com um só núcleo localizado no centro da célula e não possuem estrias transversais. Não apresentam
controlo voluntário e podem ter actividade espontânea: “pace-maker” irregular. Existe em vasos sanguíneos, útero, vesícula biliar e tubo digestivo. Neste músculo ainda há
muitos mais filamentos de actina em relação aos de miosina. As suas proteínas contrácteis não estão organizadas em sarcómeros, elas são arranjos paralelos de filamentos
espessos e delgados (miosina e actina) e os filamentos de miosina ligam-se a uns corpos densos ou ao sarcolema, os quais por sua vez se ligam às membranas celulares e
promovem o encurtamento celular. O músculo liso contrai e relaxa muito mais lentamente que o m. esquelético. as fibras lisas não apresentam retículo endoplasmático bem
desenvolvido. Tal como no cardíaco, existem canais de Ca 2+ voltagem-dependentes na membrana citoplasmática e a sua entrada resulta na despolarização. Existe calmodulina
que quando activa é essencial para a ligação da miosina à actina.
Diferenças entre músculo esquelético, cardíaco e liso: receptor de Ca2+ no acoplamento excitação-contracção: troponina (esquelético), troponina (cardíaco) e calmodulina
e miosina (liso); fontes de Ca2+: retículo sarcoplasmático (esquelético), RS e espaço extracelular (cardíaco) e espaço extracelular (liso); regulação da força: somação e
recrutamento (esquelético), estiramento (cardíaco) e modulação (liso).
Miofibrilhas: são os elementos contrácteis das células musculares. Estas são constituídas por unidades contrácteis, os sarcómeros. As fibras têm entre 10 a 80µm de diâmetro e
estendem-se ao longo de todo o músculo até aos tendões. A estriação das células é originada pelas miofibrilhas que existem em cada “fibra” muscular (100.000 a 1.000.000
miofibrilhas por fibra). As miofibrilhas são constituídas por filamentos de actina (3000) e miosina (1500). As miosinas são filamentos espessos de proteínas polimerizadas e as
actinas filamentos finos. Os filamentos interdigitam-se causando bandas escuras e claras. As bandas claras contém apenas filamentos de actina – Bandas I (isotrópicas para a luz
polarizada. As bandas I têm propriedades físicas uniformes qualquer que sejam as direcções nas quais sejam medidas). As bandas escuras contém filamentos de miosina e os
terminais de filamentos de actina – Bandas A (anisotrópicas para a luz polarizada. As propriedades físicas das bandas A dependem da direcção de medida. O seu índice de
refracção não é uniforme em todas as direcções devido à propriedade de birrefringência), linha Z e a linha M. A unidade contráctil é o sarcómero (pode encurtar até 20-50% e
alongar até 120% do seu comprimento de repouso, quando o músculo é estirado). Existem pontes cruzadas nos filamentos de miosina ao longo de todo o filamento excepto ao
centro do filamento de miosina. É a interacção entre estas pontes cruzadas e os filamentos de actina que provoca a contracção.
Tipos de contracção: isométrica: a tensão muscular varia, mas o comprimento muscular mantém-se; isotónica: o comprimento muscular varia e a tensão muscular mantém-se
constante. Numa contracção muscular habitualmente verificam-se os dois tipos de contracção. A força total depende de: somatório das contracções induzidas por um potencial
de acção e recrutamento de um número crescente de fibras activas num músculo. Tónus muscular: é a contracção residual dos músculos esqueléticos em repouso (a partir de
impulsos provenientes dos feixes medulares motores) – quando há secção destes feixes, ocorre uma atrofia muscular (p. ex.: na paraplegia); fadiga muscular: quando a
contracção muscular é mantida demasiado tempo para as capacidades metabólicas da fibra muscular – diminuição da potência de contracção (fadiga rápida: resulta de um
exercício intenso rápido – mais ácido láctico, menos ATP; fadiga lenta: resulta de um exercício submáximo, prolongado – menos glicogénio, ficando o músculo dependente de
substâncias lipídicas) ; tétano muscular: contracção muscular mantida e de intensidade máxima devido a uma estimulação de alta frequência. A tensão tetânica mantém-se
enquanto houver estimulação ou até ao aparecimento de fadiga. O músculo cardíaco não é tetanizável (longo período refractário).
Componentes proteicos das miofibrilhas (miofilamentos): miosina: cada filamento de miosina (55 a 60% das proteínas miofibrilhares) é composto de aproximadamente 200
moléculas de miosina, com um peso molecular igual a 490.000 Da. Apresenta 6 cadeias polipeptídicas, sendo duas cadeias pesadas (peso molecular igual a 200.000), a
meromiosina L e H que contém a actividade ATPásica Ca2+ dependente e inibida por Mg2+ e os sítios de união com a actina; e quatro cadeias leves (peso molecular igual a
20.000), uma C1, duas C2 e uma C3. Actina: cada filamento de actina (20 a 25% das proteínas miofibrilhares) apresenta 2 formas, a actina G (globular) e actina F (fibrilhar)
formada pela união de um grande número de moléculas de actina G dispostas em dupla espiral. Constituem os filamentos delgados, juntamente com duas outras proteínas
reguladoras. Tropomiosina: cada filamento de tropomiosina (4 a 11% das proteínas miofibrilhares) está entrelaçado com a actina e fixam-se à linha Z, juntamente com a α-
actinina. Troponina: é formada por 3 cadeias polipeptídicas: a troponina T (fixa o complexo à tropomiosina), troponina C (fixa os iões Ca2+) e troponina I (inibe a interacção
entre a miosina e a actina). Actomiosina: forma-se pela associação de uma parte de actina F com três partes de miosina, formando um complexo muito viscoso e que se
dissocia a concentrações salinas muito altas. Enquanto que a actividade ATPásica da miosina pura requer CA2+ e é inibida pelo Mg2+, a actividade ATPásica da actomiosina é
estimulada pelo Mg2+.
Sarcolema: membrana celular da fibra muscular. É composta por: colesterol (principal lipído neutro); lecitina (é o principal fosfolípido); alterações lipídicas com distrofias;
glicoproteínas, glicolípidos e aminoglicanas sobretudo na membrana basal e enzimas (Na +/K+-ATPase e Ca2+/Mg2+-ATPase). O potencial de membrana é de 85mV e
apresentando grande permeabilidade ao Ca2+ (importante factor de lesão muscular e irritabilidade neuromuscular).
Sistema contráctil: Filamentos espessos: miosina, pequena quantidade de proteína I, proteína C e proteína M. Filamentos delgados: actina, proteínas reguladoras, troponina e
tropomiosina, β-actinina (extremidade dos filamentos delgados) e α-actinina nas linhas Z (ligam os filamentos delgados às linhas Z).
Desmina: liga as linhas Z das miofibrilhas ao sarcolema.
Sarcoplasma: citoplasma da fibra muscular, com muitas mitocôndrias, K+ e Mg2+.
Sarcosomas: mitocôndrias.
Retículo sarcoplasmático: retículo endoplasmático liso, controla a contracção muscular. É mais abundante nas músculos de contracção rápida e 90% das suas proteínas são
ATPases Ca2+ dependentes.
Distrofina: cerca de 5% do total de distrofinas do citosqueleto está ligada à membrana; codificada pelo cromossoma X; liga o complexo glicoproteico (DAG) à actina do
citosqueleto ou do sarcómero; tipos de distrofina: músculo-esquelético, cerebral e hepático; tem como função o reforço do sarcolema, ligando mecanicamente o citosqueleto
celular à matriz extracelular, protegendo o sarcolema de roturas e subsequente necrose induzidas pelo estiramento da fibra. A distrofina está ausente na maioria das fibras
musculares da distrofia muscular (Duchenne).
Complexo glicoproteico associado à distrofina (DGC): constituído por 6 sub-unidades. Constituído por: laminina, α-distroglicana, β-distroglicana, sarcoglicanas, sintrofina e
distrofina. Exemplos patológicos: 1) distrofia muscular Duchenne ou Becker (ausência ou diminuição de distrofina), 2) distrofias musculares das cinturas (resulta de mutações
nas sarcoglicanas) e 3) distrofias musculares congénitas (resulta de mutações para o gene da α2-laminina). Enzimas catabólicos: proteinases; turnover normal das proteínas
musculares incluindo o aparelho miofibrilhar; aumento das proteinases ácidas e neutras nos estádios precoces após desnervação e distrofias; proteinases alcalinas nos mastócitos
e proteinases neutras activadas pelo Ca2+ (removem selectivamente as linhas Z e degradam a tropomiosina, troponina e proteína C, mas não a miosina e a actina. Podem ser
responsáveis por algumas miopatias). Heterogeneidade das fibras musculares: tipo 1: contracção e relaxamento lentos; resistência à fadiga; metabolismo aeróbio; succinico
desidrogenase; mais mitocôndrias; maiores linhas Z e mais ATPase miofibrilhar a pH ácido do que nas do tipo II. Tipo 2 (2a e 2b): contracção e relaxamento rápidos; mais
fatigáveis; glicólise anaeróbia; fosforilase; menos mitocôndrias; maior desenvolvimento do retículo sarcoplásmico e mais ATPase miofibrilhar a pH alcalino do que as do tipo 1.
Diferem, também, nas propriedades das cadeias leves da miosina, na tropomiosina e troponina. Fibras pertencendo à mesma unidade motora são do mesmo tipo bioquímico
inervação e sua actividade altera o tipo de fibra. Transmissão neuromuscular: receptores Ach e placa motora. Substractos energéticos: ácidos gordos livres e glicogénio.
Rede de proteínas elásticas: envolvem os filamentos de actina e de miosina. São exemplos a tilina e a nebulina. A sua destruição leva à desorganização dos sarcómeros
interferindo com o desenvolvimento da força muscular.
Modelo do deslizamento: A troponina I, inibe a ligação da actina à miosina. Quando a troponina C se liga a dois Ca2+, expõe-se o sitio activo e forma-se o complexo gerador de
força, através do qual se verifica a união da cabeça da miosina ao monómero de actina G. A cabeça da miosina sofre uma alteração conformacional, assumindo um ângulo de 45º
em relação à cauda e passa para uma conformação não energética, deixando o ADP + P livres no sitio de união com a actina. A hidrólise do ATP, permite o deslizamento dos
filamentos finos (actina) sobre os grossos (miosina). A relaxação muscular efectua-se com o transporte de Ca2+ do sarcoplasma para o retículo sarcoplasmático por transporte
activo. Antes, ocorre a despolarização do sistema T, cujas membranas têm o receptor dihidropiridina, relacionados com canais de Na + voltagem-dependentes. Esta
despolarização aumenta a permeabilidade do retículo ao Ca 2+ para o receptor riaxodina, contido nas cisternas do retículo sarcoplásmico no estado de repouso onde se encontra
solúvel ou ligado á calsequertrina. Neste estado a hidrólise de ATP pela miosina é inibida pelas concentrações de Mg 2+ (esta inibição é contrariada pela reacção da actina com a
miosina na presença de concentrações activadoras de Ca 2+). É necessário uma molécula de ATP para segregar dois Ca 2+ nas cisternas para relaxar o músculo. Duas a quatro
moléculas de ATP são ligadas e hidrolizadas por cada ponte activadora durante a contracção. O ATP é necessário para a contracção e para a relaxação. Pelo menos 2/3 do ATP é
usado para a contracção e 1/3 é usado para o relaxamento.
Das könnte Ihnen auch gefallen
- Liga MetálicaDokument9 SeitenLiga MetálicaAlexandra BatistaNoch keine Bewertungen
- Queda PDFDokument10 SeitenQueda PDFMarco AlvesNoch keine Bewertungen
- Ficha Formativa - Regulação GénicaDokument4 SeitenFicha Formativa - Regulação GénicaRubina FerreiraNoch keine Bewertungen
- Proposta de Exame Biologia e GeologiaDokument11 SeitenProposta de Exame Biologia e GeologiaCintia Brigita SilvaNoch keine Bewertungen
- Formação e crescimento de cristaisDokument21 SeitenFormação e crescimento de cristaisEduarda Cardozo100% (1)
- Solucoes Do Manual Biogeo 11 BioDokument34 SeitenSolucoes Do Manual Biogeo 11 BioCarina SilvaNoch keine Bewertungen
- Análise de Circuitos ElétricosDokument88 SeitenAnálise de Circuitos ElétricosBernardo CascãoNoch keine Bewertungen
- Aquela Triste e Leda MadrugadaDokument2 SeitenAquela Triste e Leda MadrugadamateusNoch keine Bewertungen
- Exercicios de BiologiaDokument9 SeitenExercicios de BiologiacarolNoch keine Bewertungen
- Questões AlsDokument8 SeitenQuestões AlsInês DominguezNoch keine Bewertungen
- 110Q - (Teste 2) - Nov2019Dokument5 Seiten110Q - (Teste 2) - Nov2019antonioNoch keine Bewertungen
- Destilação simples e fraccionadaDokument22 SeitenDestilação simples e fraccionadaCristiana SantosNoch keine Bewertungen
- Sistema reprodutor humano e desenvolvimento embrionárioDokument6 SeitenSistema reprodutor humano e desenvolvimento embrionáriocarolinaNoch keine Bewertungen
- Fatores EnzimaDokument5 SeitenFatores EnzimaEmily BarretoNoch keine Bewertungen
- Desenvolvimento e Custos Ecológicos Catarina Ferreira (1) (2385)Dokument9 SeitenDesenvolvimento e Custos Ecológicos Catarina Ferreira (1) (2385)Camila Soares100% (1)
- Poster - Um Pesadelo Chamado InfertilidadeDokument1 SeitePoster - Um Pesadelo Chamado InfertilidadeBernadetteNoch keine Bewertungen
- Soluções Livro 11 AnoDokument81 SeitenSoluções Livro 11 AnoOBerçodaCortiçaNoch keine Bewertungen
- T 12A Bio2 15Dokument5 SeitenT 12A Bio2 15Maria MaiaNoch keine Bewertungen
- Sebenta FinalDokument740 SeitenSebenta FinalRodrigo FernandesNoch keine Bewertungen
- Poster Da Infertilidade Final Grupo 1 Turno 2Dokument1 SeitePoster Da Infertilidade Final Grupo 1 Turno 2ruisoares65100% (1)
- Autofagia descobertaDokument4 SeitenAutofagia descobertaSandraNoch keine Bewertungen
- Relatório 3Dokument7 SeitenRelatório 3António LucasNoch keine Bewertungen
- ArealDokument12 SeitenArealLuísa PintoNoch keine Bewertungen
- Probabilidade III - Matematica 12ºano - PTDokument19 SeitenProbabilidade III - Matematica 12ºano - PTPedro SantosNoch keine Bewertungen
- Fisiologia RenalDokument14 SeitenFisiologia RenalCristiana PachecoNoch keine Bewertungen
- Atrito estático e cinético: registos e resultados experimentaisDokument15 SeitenAtrito estático e cinético: registos e resultados experimentaisSofia RodriguesNoch keine Bewertungen
- Q12 - TesteDokument8 SeitenQ12 - TesteCarlos PocinhoNoch keine Bewertungen
- Fermentação LevedurasDokument16 SeitenFermentação LevedurascarolinaNoch keine Bewertungen
- Bio12 Ta1Dokument6 SeitenBio12 Ta1Mariana GuimarãesNoch keine Bewertungen
- Novo11Q Critérios Específicos Classificação Teste3 Mai18Dokument3 SeitenNovo11Q Critérios Específicos Classificação Teste3 Mai18pituchaNoch keine Bewertungen
- Edicoes ASA - 11 Ano 2019-20 - 4 Teste PDFDokument9 SeitenEdicoes ASA - 11 Ano 2019-20 - 4 Teste PDFrefúgio do saberNoch keine Bewertungen
- Solubilidade de sais e iões na água do marDokument7 SeitenSolubilidade de sais e iões na água do marOrlando Meireles0% (1)
- Ondas mecânicas e acústicas em diferentes meiosDokument2 SeitenOndas mecânicas e acústicas em diferentes meiostita32Noch keine Bewertungen
- Apresentação - Deformação Das RochasDokument31 SeitenApresentação - Deformação Das RochasBia BorgesNoch keine Bewertungen
- Complexos e CorDokument15 SeitenComplexos e CorFilipe LopesNoch keine Bewertungen
- Teste Matemática Porto Turistas 2022Dokument3 SeitenTeste Matemática Porto Turistas 2022Bia sousa0% (1)
- Relatório Biologia - Transporte Nas Plantas PDFDokument30 SeitenRelatório Biologia - Transporte Nas Plantas PDFO Sérgio ConceiçãoNoch keine Bewertungen
- Encontros Português 11o AnoDokument9 SeitenEncontros Português 11o AnoAna Isabel Lopes Marques 1Noch keine Bewertungen
- Atividade Experimental Coeficiente de Expansao LinearDokument10 SeitenAtividade Experimental Coeficiente de Expansao LinearCarinaGasparNoch keine Bewertungen
- 11FQA Ficha Trab Ini F1.3 - N.º 4 CorrDokument6 Seiten11FQA Ficha Trab Ini F1.3 - N.º 4 CorrMaria Clara De Sá Bôtto100% (1)
- Sistema Excretor - 9ºanoDokument20 SeitenSistema Excretor - 9ºanoAna Sofia SantosNoch keine Bewertungen
- Energia térmica e radiação IIDokument7 SeitenEnergia térmica e radiação IIMaria DuarteNoch keine Bewertungen
- Novo 11Q NL (Teste2 CC) Abr.2019Dokument3 SeitenNovo 11Q NL (Teste2 CC) Abr.2019Rui SantosNoch keine Bewertungen
- Relatório 1Dokument14 SeitenRelatório 1Alexandra BalçaNoch keine Bewertungen
- Biologia 12.º AnoDokument65 SeitenBiologia 12.º AnoPaula Amado100% (1)
- Re82137 Ny12 Resolucoes Manual Vol1e2Dokument128 SeitenRe82137 Ny12 Resolucoes Manual Vol1e2Carina Cardoso CardosoNoch keine Bewertungen
- Sentidos 11Dokument1 SeiteSentidos 11Miguel Dias100% (1)
- Novo11Q - (Teste 3 - Mai18)Dokument5 SeitenNovo11Q - (Teste 3 - Mai18)Isabel Vilhena FerreiraNoch keine Bewertungen
- V Gowin Sedimentacao 10ºano de Escolaridafwcome Trhcejveby YvyhDokument1 SeiteV Gowin Sedimentacao 10ºano de Escolaridafwcome Trhcejveby YvyhFly SweetNoch keine Bewertungen
- Teste 1 Fisica 12 Ano Novembro 2021 Turma ADokument3 SeitenTeste 1 Fisica 12 Ano Novembro 2021 Turma ADiretor do AgrupamentoNoch keine Bewertungen
- Aef11 Teste Ava 1Dokument5 SeitenAef11 Teste Ava 1TeresaVaraoNoch keine Bewertungen
- Ensaio FilosoficoDokument2 SeitenEnsaio FilosoficoRafaela Carvalho Alunos AECANoch keine Bewertungen
- Fq10a BQ 00010Dokument6 SeitenFq10a BQ 00010Maria DuarteNoch keine Bewertungen
- Apontamentos de Biologia sobre o Sistema Reprodutor MasculinoDokument93 SeitenApontamentos de Biologia sobre o Sistema Reprodutor MasculinoAna Rita EstevesNoch keine Bewertungen
- Aplicações Informáticas - Introdução ProgramaçãoDokument6 SeitenAplicações Informáticas - Introdução ProgramaçãoSofia RochaNoch keine Bewertungen
- Atividade Laboratorial Nº 3 - Produção de Iogurte Natural PDFDokument1 SeiteAtividade Laboratorial Nº 3 - Produção de Iogurte Natural PDFJosé Luiz Rodrigues SilvaNoch keine Bewertungen
- Resumo Tecido Muscular - JunqueiraDokument4 SeitenResumo Tecido Muscular - JunqueiraLucas Thiago BorgesNoch keine Bewertungen
- Tecido MuscularDokument4 SeitenTecido MuscularDeadmanNoch keine Bewertungen
- Fisiologia Av 2 k4zDokument89 SeitenFisiologia Av 2 k4zCaroline MoreiraNoch keine Bewertungen
- Medresumos 2016 - OmfDokument16 SeitenMedresumos 2016 - OmfMirianNoch keine Bewertungen
- PROGORALDokument36 SeitenPROGORALapi-26429188Noch keine Bewertungen
- OralDokument54 SeitenOralapi-26429188100% (2)
- Microbiologia Oral Microbiologia Oral ApontamentosDokument6 SeitenMicrobiologia Oral Microbiologia Oral Apontamentosapi-26429188100% (2)
- 2 Frekmicrobiologia2005Dokument1 Seite2 Frekmicrobiologia2005api-26429188Noch keine Bewertungen
- 2 Frekmicrobiologia2005Dokument1 Seite2 Frekmicrobiologia2005api-26429188Noch keine Bewertungen
- Examemicrobiologiajulho 2005Dokument1 SeiteExamemicrobiologiajulho 2005api-26429188Noch keine Bewertungen
- HepatiteDokument3 SeitenHepatiteapi-26429188Noch keine Bewertungen
- Microbiologia Oral Esquema Protocolo 10 - SEMANA API20ADokument7 SeitenMicrobiologia Oral Esquema Protocolo 10 - SEMANA API20Aapi-26429188Noch keine Bewertungen
- Microbiologia Oral 3 AULA TPDokument13 SeitenMicrobiologia Oral 3 AULA TPapi-26429188100% (1)
- Doenças PeriodontaisDokument6 SeitenDoenças Periodontaisapi-26429188100% (3)
- FW Micro Oral Micro-2 - FreqDokument1 SeiteFW Micro Oral Micro-2 - Freqapi-26429188Noch keine Bewertungen
- HepatiteDokument3 SeitenHepatiteapi-26429188Noch keine Bewertungen
- Exame de Micro Geral - Fevereiro de 2005 MDDokument8 SeitenExame de Micro Geral - Fevereiro de 2005 MDapi-26429188Noch keine Bewertungen
- Ex Ames 1Dokument13 SeitenEx Ames 1api-26429188Noch keine Bewertungen
- Esquema Protocolo 4 SEMANADokument3 SeitenEsquema Protocolo 4 SEMANAapi-26429188Noch keine Bewertungen
- Esquema Protocolo 5 SEMANADokument7 SeitenEsquema Protocolo 5 SEMANAapi-26429188Noch keine Bewertungen
- Microbiologia Oral Esquema Protocolo 10 - SEMANA API20ADokument7 SeitenMicrobiologia Oral Esquema Protocolo 10 - SEMANA API20Aapi-26429188Noch keine Bewertungen
- Exame de Micro - Fev2004Dokument6 SeitenExame de Micro - Fev2004api-26429188Noch keine Bewertungen
- Esquema - Protocolo 3 SemanaDokument3 SeitenEsquema - Protocolo 3 Semanaapi-26429188Noch keine Bewertungen
- Escolha Multipla MICRO ORAL 1º Teste PraticoDokument2 SeitenEscolha Multipla MICRO ORAL 1º Teste Praticoapi-26429188Noch keine Bewertungen
- Doenças PeriodontaisDokument6 SeitenDoenças Periodontaisapi-26429188100% (3)
- Escolha Multipla MICRO ORAL 1º Teste PraticoDokument2 SeitenEscolha Multipla MICRO ORAL 1º Teste Praticoapi-26429188Noch keine Bewertungen
- Microbiologia Oral Microbiologia Oral ApontamentosDokument6 SeitenMicrobiologia Oral Microbiologia Oral Apontamentosapi-26429188100% (2)
- Escolha Multipla MICRO ORAL 1º Teste PraticoDokument2 SeitenEscolha Multipla MICRO ORAL 1º Teste Praticoapi-26429188Noch keine Bewertungen
- CarieDokument5 SeitenCarieapi-26429188Noch keine Bewertungen
- 2 Freq MicroDokument5 Seiten2 Freq Microapi-26429188Noch keine Bewertungen
- Doenças PeriodontaisDokument6 SeitenDoenças Periodontaisapi-26429188100% (3)
- BactériasDokument2 SeitenBactériasapi-26429188Noch keine Bewertungen
- 3 Aula TPDokument23 Seiten3 Aula TPapi-26429188Noch keine Bewertungen
- 2 Freq MicroDokument5 Seiten2 Freq Microapi-26429188Noch keine Bewertungen
- Exercicios para Desvios de JoelhoDokument5 SeitenExercicios para Desvios de JoelhoAndressa Souza100% (1)
- Skill TrainingDokument13 SeitenSkill TrainingDIOGO FRANCO PUREZANoch keine Bewertungen
- Assessoria Esportiva Twin: Treino ADokument4 SeitenAssessoria Esportiva Twin: Treino AJoão PauloNoch keine Bewertungen
- Revisão Músculos e ArticulaçõesDokument8 SeitenRevisão Músculos e ArticulaçõesLarissa SenaNoch keine Bewertungen
- Força muscular: avaliação e testesDokument52 SeitenForça muscular: avaliação e testesCaroline Menezes63% (8)
- Biomecânica Aula - Ligamentos e TendãoDokument28 SeitenBiomecânica Aula - Ligamentos e TendãoAnonymous LDLu9QrZd100% (2)
- Gestão equinoculturaDokument32 SeitenGestão equinoculturaJoao Francisco Pires LuizNoch keine Bewertungen
- Biofísica Músculo ContraçãoDokument30 SeitenBiofísica Músculo ContraçãoJô Joserlane Xavier100% (3)
- Contração MuscularDokument36 SeitenContração MuscularDiego FélixNoch keine Bewertungen
- Aula IV - Músculos Da Região Do QuadrilDokument18 SeitenAula IV - Músculos Da Região Do Quadrilapi-3729014100% (7)
- Ficha de Treino Klailson Robert Dos Santos CorreaDokument1 SeiteFicha de Treino Klailson Robert Dos Santos CorreaK Robert Correa100% (2)
- Aula de Miologia + RoteiroDokument36 SeitenAula de Miologia + RoteiroEdwin Te vendeNoch keine Bewertungen
- Joelho: Exame Físico CompletoDokument5 SeitenJoelho: Exame Físico CompletoLucas TelesNoch keine Bewertungen
- Importância dos ossos, articulações e músculosDokument30 SeitenImportância dos ossos, articulações e músculosmldexterNoch keine Bewertungen
- 5 MiologiaDokument72 Seiten5 MiologiasgtwelberNoch keine Bewertungen
- Resumo Tecido Muscular - JunqueiraDokument4 SeitenResumo Tecido Muscular - JunqueiraLucas Thiago BorgesNoch keine Bewertungen
- Controle Neuromuscular Do MovimentoDokument45 SeitenControle Neuromuscular Do MovimentoNavegantes Silva de OliveiraNoch keine Bewertungen
- Aula Cotovelo - Punho - MaoDokument87 SeitenAula Cotovelo - Punho - MaoSuely Suzuki VeraNoch keine Bewertungen
- Seção+2 4+-+sistema+muscular+origem,+organização+geral+e+histologiaDokument23 SeitenSeção+2 4+-+sistema+muscular+origem,+organização+geral+e+histologiamegamenteNoch keine Bewertungen
- Treino musculação intermediáriosDokument18 SeitenTreino musculação intermediáriosMarius ViníciusNoch keine Bewertungen
- Anatomia e Fisiologia do Sistema MuscularDokument27 SeitenAnatomia e Fisiologia do Sistema MuscularAdão 21Noch keine Bewertungen
- Atividade de Aprendizagem. MuscularDokument17 SeitenAtividade de Aprendizagem. Muscularmarcosbigandrade89% (9)
- Resumo do Aparelho LocomotorDokument6 SeitenResumo do Aparelho LocomotorCaroline LimaNoch keine Bewertungen
- Alongamento Excêntrico X Alongamento PassivoDokument9 SeitenAlongamento Excêntrico X Alongamento PassivoGabriel LopesNoch keine Bewertungen
- Sistema muscular: propriedades, tipos e ação dos músculosDokument2 SeitenSistema muscular: propriedades, tipos e ação dos músculosmaria eduardaNoch keine Bewertungen
- Biomecânica Da Cintura Escapular e OmbroDokument7 SeitenBiomecânica Da Cintura Escapular e OmbroMagnunLanfranco100% (2)
- Tratamento não cirúrgico da dor femoropatelarDokument2 SeitenTratamento não cirúrgico da dor femoropatelarTainá OrestesNoch keine Bewertungen
- Biomecanica Do Tornozelo e PeDokument39 SeitenBiomecanica Do Tornozelo e PeArquivos de Fisioterapia100% (4)
- Tecido MuscularDokument62 SeitenTecido MuscularThiago Pimenta100% (1)
- Treino ABC 2X AdaptaçãoDokument6 SeitenTreino ABC 2X AdaptaçãobambambigelowNoch keine Bewertungen