Beruflich Dokumente
Kultur Dokumente
Materiales Semiconductores
Hochgeladen von
Néstor E. B. IndilíCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Materiales Semiconductores
Hochgeladen von
Néstor E. B. IndilíCopyright:
Verfügbare Formate
Materiales Semiconductores
Al estudiar la naturaleza de los materiales conductores, semiconductores y aislantes, se establece que: - Los materiales aislantes se caracterizaban por poseer una Banda Prohibida muy ancha, la cual impide el paso de electrones de la Banda de Valencia a la de Conduccin. - En los materiales semiconductores, la Banda Prohibida es mucho menos ancha que en los aislantes. Por lo general, a 0 K los materiales semiconductores se comportan como aislantes. Pero a medida que aumenta la temperatura lo hace su capacidad de conduccin, ya que este aporte de energa sirve para que los electrones puedan saltar de la Banda de Valencia a la de Conduccin. La anchura de la Banda Prohibida condiciona la energa que debe aportarse a los electrones para que pasen de la Banda de Valencia a la de Conduccin. El aporte de energa debe superar los 0,785 eV (Electrn - Voltios) en el caso del germanio y los 1,21 eV para el silicio. Al saltar de la Banda de Valencia a la de Conduccin, los electrones dejan un hueco. Por lo tanto, se establecen dos corrientes: una producida por los electrones situados en la Banda de Conduccin y otra originada por los huecos (en el proceso de recombinacin). Los semiconductores intrnsecos son puros, en los que la conduccin se debe al aumento de electrones en la banda de conduccin originado por la temperatura. Los portadores de carga son los electrones y los huecos. Los semiconductores intrnsecos no presentan impurezas en su estructura, y estn constituidos nicamente por el elemento tetravalente semiconductor (del grupo IV de la tabla peridica): silicio o germanio puro. Los semiconductores extrnsecos contienen impurezas. Si en una red cristalina se introducen tomos de impureza, aparecen estados de energa o bandas auxiliares en el interior de la banda prohibida. Estos nuevos niveles contribuyen a la conduccin. Para obtenerlos se recurre al dopaje o impurificacin del semiconductor (por mtodos de difusin o epitaxias) con elementos pentavalentes o trivalentes. La presencia de estas impurezas se traduce en el aumento del nmero de portadores de carga. Si el dopaje se realiza con un elemento trivalente (elementos del grupo III que slo tienen tres electrones en la ltima capa), la estructura que se obtiene se denomina semiconductor tipo p. Al introducir impurezas de esta ndole es como si en realidad se aportaran huecos, puesto que se originar un defecto de electrones. Como quiera que el semiconductor es un elemento tetravalente, al elemento impurificado trivalente le faltarn electrn para realizar la covalencia con el semiconductor; por lo tanto, habr un hueco en la Banda de Valencia disponible para establecer la conduccin. Las impurezas crean una banda suplementaria: el llamado nivel de energa aceptor. Si un material semiconductor (como el germanio o silicio) es dopado con un elemento pentavalente (elementos cuyos tomos tienen cinco electrones en la ltima capa), se obtiene un semiconductor tipo n. De los cinco electrones que aporta la impureza, cuatro formarn enlace covalente, mientras que un electrn quedar libre en la Banda de Conduccin. En esta situacin, el nmero de electrones supera al nmero de huecos. La impurificacin con elementos pentavalentes (donadores) crea en el semiconductor una
banda auxiliar de electrones, situada junto a la Banda de Conduccin, que recibe el nombre de nivel de energa donador. De esta forma, con muy poca energa que se suministre, los electrones de la banda suplementaria pasarn a la Banda de Conduccin. El enlace covalente consiste en el compartimiento de pares de electrones por dos tomos, dando lugar a molculas y puede ser polar o no polar. El enlace covalente puede dar lugar a compuestos slidos cristalinos de malla rgida tridimensional que une a cada uno de los tomos con todos los dems, en los que la totalidad del cristal es una sola molcula (p. ej., el cuarzo y el diamante), o bien a molculas discretas que, en estado slido, estn unidas por fuerzas intermoleculares y reciben el nombre de cristales moleculares. Estos compuestos, en cualquiera de los estados de agregacin, estn formados por las mismas molculas y slo se diferencian en la ordenacin de stas. El modelo de enlace entre iones no se puede utilizar para explicar la unin entre cualquier pareja de tomos. Si dos tomos son iguales, no existe ninguna razn que justifique que uno de estos tomos se transforme en in. Para justificar estas situaciones se utiliza otro modelo de enlace. Cuando los tomos que forman un enlace comparten sus electrones con la finalidad de cumplir con la regla de los ocho, se forma un enlace. El tipo de enlace que se observa en la molcula de hidrgeno y en otras molculas en que los electrones son compartidos por los dos ncleos se llama enlace covalente. En la molcula de H2 los electrones residen principalmente en el espacio entre los ncleos en donde son atrados de manera simultnea por ambos protones. El aumento de fuerzas de atraccin en esta zona provoca la formacin de la molcula de H2 a partir de dos tomos de hidrgeno separados. La formacin de un enlace entre los tomos de hidrgeno implica que la molcula H2O es ms estable por determinada cantidad de energa, que dos tomos separados (energa de enlace). Otros tipos de enlaces covalentes entre los tomos Hasta el momento se han considerado dos tipos de enlace extremos. En el enlace inico, los tomos que participan son tan distintos que ganan o pierden uno o ms electrones para formar iones con carga opuesta. El enlace se debe a las atracciones entre los iones. En el enlace covalente dos tomos idnticos comparten electrones de manera igual. La formacin del enlace se debe a la atraccin mutua de los dos ncleos hacia los electrones compartidos. Entre estos extremos se encuentran casos intermedios en los cuales los tomos no son tan distintos que ganen o pierdan electrones en su totalidad, pero son bastante distintos para que haya un compartimento desigual de electrones y se forme lo que se conoce como enlace covalente polar. La molcula de fluoruro de hidrgeno (HF) contiene este tipo de enlace en el cual existe la siguiente distribucin de carga: Enlace covalente mltiple Hasta ahora hemos analizado la formacin de enlaces sencillos, es decir aquellos en que se comparten un solo par de electrones entre los tomos, como en el hidrgeno. Alguno elementos del sistema peridico tienen la particularidad de poder establecer uniones covalentes en las que se comparten varios electrones formndose enlaces covalentes mltiples. Este es el caso, por ejemplo, de las molculas de oxgeno y nitrgeno. En efecto, el oxgeno es un elemento que se encuentra en la sexta columna del sistema peridico por lo que tiene seis electrones de valencia y le faltan dos para completar el octeto.
Enlace covalente coordinado Cuando el par de electrones compartidos pertenece solo a uno de los tomos se presenta un enlace covalente coordinado o dativo. El tomo que aporta el par de electrones se llama donador y el que los recibe receptor o aceptor. El donador ser siempre el elemento menos electronegativo, tal como se muestra en el ejemplo entre el oxgeno y el azufre, que puede dar lugar a las molculas correspondientes a distintos xidos de azufre. Este enlace una vez formado no se diferencia para nada del enlace covalente normal. Sin embargo debido a cmo se origina se le puede denominar enlace covalente dativo o coordinado. Conviene tener en cuenta que no siempre las molculas que tericamente se podran formar utilizando este tipo de enlace, existen en la realidad, ya que en ello intervienen tambin otros factores que aqu no hemos tenido en cuenta, como por ejemplo, el tamao de los tomos que van a enlazarse y la propia geometra o forma de las molculas. Conductividad del enlace covalente La falta de conductividad en estas sustancias se puede explicar porque los electrones de enlace estn fuertemente localizados atrados por los dos ncleos de los tomos enlazados. La misma explicacin se puede dar para las disoluciones de estas sustancias en disolventes del tipo del benceno, donde se encuentran las molculas individuales sin carga neta movindose en la disolucin. Dada la elevada energa necesaria para romper un enlace covalente, es de esperar un elevado punto de fusin cuando los tomos unidos extiendan sus enlaces en las tres direcciones del espacio como sucede en el diamante; no obstante, cuando el nmero de enlaces es limitado como sucede en la mayor parte de las sustancias (oxgeno, hidrgeno, amonaco, etc.) con enlaces covalentes, al quedar saturados los tomos enlazados en la molcula, la interaccin entre molculas que se tratar ms adelante, ser dbil, lo que justifica que con frecuencia estas sustancias se encuentren en estado gaseoso a temperatura y presin ordinarias y que sus puntos de fusin y ebullicin sean bajos.
Das könnte Ihnen auch gefallen
- Media Tensión (Los Poetas) - ModelDokument1 SeiteMedia Tensión (Los Poetas) - ModelNéstor E. B. IndilíNoch keine Bewertungen
- Cálculo de Caída de Tensión AP para AluminioDokument1 SeiteCálculo de Caída de Tensión AP para AluminioNéstor E. B. IndilíNoch keine Bewertungen
- Memoria Tecnica CafeteriaDokument11 SeitenMemoria Tecnica CafeteriaNéstor E. B. IndilíNoch keine Bewertungen
- Murete 200 A 600Dokument1 SeiteMurete 200 A 600Néstor E. B. IndilíNoch keine Bewertungen
- Catalogo SquareDokument298 SeitenCatalogo SquareCesar Castro SarabiaNoch keine Bewertungen
- Lampara Supralux, HCXDokument10 SeitenLampara Supralux, HCXNéstor E. B. IndilíNoch keine Bewertungen
- Soluciones de Energía RenovableDokument4 SeitenSoluciones de Energía RenovableNéstor E. B. IndilíNoch keine Bewertungen
- EcuacionesDokument1 SeiteEcuacionesNéstor E. B. IndilíNoch keine Bewertungen
- Programacion Andres y BañosDokument15 SeitenProgramacion Andres y BañosNéstor E. B. IndilíNoch keine Bewertungen
- Modelo Termico Con Una Red Neuronal de RetropropagacionDokument182 SeitenModelo Termico Con Una Red Neuronal de RetropropagacionJose AntonioNoch keine Bewertungen
- PreguntasDokument6 SeitenPreguntasNéstor E. B. IndilíNoch keine Bewertungen
- Funcionamiento de Los GraficadoresDokument5 SeitenFuncionamiento de Los GraficadoresNéstor E. B. IndilíNoch keine Bewertungen
- DEFINICION Tipod de DiodosDokument27 SeitenDEFINICION Tipod de DiodosNéstor E. B. IndilíNoch keine Bewertungen
- Práctica 2Dokument6 SeitenPráctica 2Néstor E. B. IndilíNoch keine Bewertungen
- Mecanica de Fluidos (1) 1 (1) AaDokument14 SeitenMecanica de Fluidos (1) 1 (1) AaMelker Llamo VasquezNoch keine Bewertungen
- 1 Ensayos de LaboratorioDokument57 Seiten1 Ensayos de LaboratoriocaucaNoch keine Bewertungen
- Fisica Primero 5tDokument8 SeitenFisica Primero 5tJuan Carlos Rengel RomanNoch keine Bewertungen
- La Paradoja de SchrödingerDokument4 SeitenLa Paradoja de SchrödingerAlex100% (3)
- Diseño de La Investigación Científica para El Primer Capítulo 1Dokument61 SeitenDiseño de La Investigación Científica para El Primer Capítulo 1Jhon Alder Calderon QuispeNoch keine Bewertungen
- Balance Macroscopico de MateriaDokument13 SeitenBalance Macroscopico de MateriaYosy SNNoch keine Bewertungen
- 2022 Serie 9 Gases IQ IEM FINALDokument14 Seiten2022 Serie 9 Gases IQ IEM FINALJulian CabezasNoch keine Bewertungen
- Balance de Energia - Procesos Industriales - Ejercicios PDFDokument11 SeitenBalance de Energia - Procesos Industriales - Ejercicios PDFGabriel E. Garcia Mendoza100% (2)
- FUERZAS IntermolecularesDokument11 SeitenFUERZAS IntermolecularesFabiola Del Pilar CuroNoch keine Bewertungen
- Tap 5Dokument4 SeitenTap 5fidelNoch keine Bewertungen
- Ejercicios de Repaso Examen 2 Equilibrio QuímicoDokument2 SeitenEjercicios de Repaso Examen 2 Equilibrio QuímicoPabloNoch keine Bewertungen
- Equilibrio de Solubilidad y ElectroquímicaDokument6 SeitenEquilibrio de Solubilidad y ElectroquímicaR_M92Noch keine Bewertungen
- Manual de Instalaciones ElectDokument73 SeitenManual de Instalaciones ElectLuis Cesar VaPiNoch keine Bewertungen
- Practica 4Dokument5 SeitenPractica 4Miguel Angel HernandezNoch keine Bewertungen
- Robotica - Control - Cinematico 2019Dokument62 SeitenRobotica - Control - Cinematico 2019Royeiro Xavi DuduNoch keine Bewertungen
- CINEMATICADokument3 SeitenCINEMATICALenny Cerezo TolabaNoch keine Bewertungen
- TORSIÓNDokument16 SeitenTORSIÓNFernando Sosa AbreguNoch keine Bewertungen
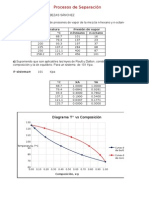
- Procesos de Separacion-Cabezas SanchezDokument12 SeitenProcesos de Separacion-Cabezas SanchezSalustria Cabezas SánchezNoch keine Bewertungen
- Ipn Esime Zac Práctica 3 MenesesDokument7 SeitenIpn Esime Zac Práctica 3 MenesesDavid VNoch keine Bewertungen
- Elementos de Corriente AlternaDokument30 SeitenElementos de Corriente Alternaaris09yekofNoch keine Bewertungen
- RgrtyDokument8 SeitenRgrtyOSCAR GUIOBANNI GUILLEN ALBORNOZNoch keine Bewertungen
- ACTIVIDAD ENTREGABLE 1 Fisica QuimicaDokument7 SeitenACTIVIDAD ENTREGABLE 1 Fisica QuimicaFRANK YHORDY HUILLCA APAZANoch keine Bewertungen
- Trabajo de Fisica Vibraciones y OndasDokument18 SeitenTrabajo de Fisica Vibraciones y OndasNicole AvileNoch keine Bewertungen
- Banda ProhibidaDokument17 SeitenBanda ProhibidaLeonardo SandovalNoch keine Bewertungen
- Tarea 1.2 VictorEuceda 11211125Dokument10 SeitenTarea 1.2 VictorEuceda 11211125Víctor EucedaNoch keine Bewertungen
- Ejercicios ResueltosDokument34 SeitenEjercicios ResueltosLeandro Carhuchuco Josmell GenixNoch keine Bewertungen
- PhysicsDokument22 SeitenPhysicsLUIS MANUEL MUJICA DAVILANoch keine Bewertungen
- Ejercicios Potencial EléctricoDokument3 SeitenEjercicios Potencial EléctricoDaniel Sebastian100% (2)
- Trabajo de TermodinamicaDokument39 SeitenTrabajo de Termodinamicajuan100% (6)