Beruflich Dokumente
Kultur Dokumente
Piled Ani Ell
Hochgeladen von
Mohsen ArfaouiCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Piled Ani Ell
Hochgeladen von
Mohsen ArfaouiCopyright:
Verfügbare Formate
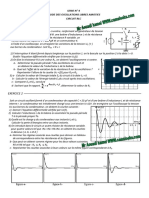
Etude de la pile Daniell
Prsentation de la pile Daniell
La pile Daniell est constitue de deux compartiments appels demi-piles. Chaque demi-pile renferme un couple rdox : *Une demi-pile comprend une lame de cuivre plongeant dans une solution de sulfate de cuivre *L'autre demi-pile comprend une lame de zinc plongeant dans une solution de sulfate de zinc les deux demi-piles sont relies par un pont de jonction dit pont lectrolytique ou pont salin.
Schma et symbole de la pile A une pile,on peut associer deux schmas et deux symboles selon qu'on met gauche le couple Cu2+/Cu ou Zn2+/Zn.
Schma
Symbole
Cu ICu
2+
(1molL ) IIZn (1molL )IZn
-1
2+
-1
Zn I Zn (1molL ) II Cu
2+
-1
2+
(1molL )ICu
-1
Equation associe
Cu + Zn 2+<=> Cu 2++ Zn
Zn+Cu2+<=>Zn2++ Cu
CONVENTION: L'quation chimique est crite de sorte que chaque rducteur doit tre du mme cot (droite ou gauche)dans l'quation chimique et dans la reprsentation de la pile .
MAHMOUD GAZZAH
gazzahsp
Etude de la pile Daniell
Principe de fonctionnement de la pile Daniell
On relie la borne (+) du milliampremtre la lame de cuivre On constate que l'aiguille du milliampremtre dvie. Le passage du courant lectrique, l'extrieur de la pile, s'effectue de la lame de cuivre vers la lame de zinc. la lame de cuivre est le pole (+) de la pile la lame de zinc est le pole (-) de la pile Le dplacement des lectrons est dans le sens inverse de celui du courant.
Bilan des transformations chimiques A llectrode de zinc : Zn A llectrode de cuivre : Dans la pile : Cu 2+ + 2eZn + Cu 2+
Zn 2+ Cu
+2e- (oxydation) (rduction)
Zn2+ + Cu
Le pont salin permet de : -fermer le circuit lectrique tout en vitant le mlange des deux solutions -assurer la neutralit lectrique dans les deux compartiments de la pile.
MAHMOUD GAZZAH
gazzahsp
Etude de la pile Daniell
La fm d'une pile est la tension entre le ple (quand elle ne dbite pas de courant).
de droite et le ple de gauche de cette pile vide
La f..m de la pile est : E = VbD -VbG VbD:le potentiel lectrique de la borne de droite VbG:le potentiel lectrique de la borne de gauche
E = VbZn -VbCu = - 1,1V < 0 E <0 VbZn < VbCu
E = VbCu -VbZn = + 1,1V > 0 E >0E VbCu > VbZn
MAHMOUD GAZZAH
gazzahsp
Etude de la pile Daniell
En changeant le schma de la pile:
* l'quation associe change. *le symbole change . *les polarits des bornes ne changent pas. *la raction qui se produit dans la pile ne change pas. Zn + Cu 2+ Zn2+ + Cu Le sens de circulation des lectrons (dans le circuit extrieur) indique le sens de la raction qui se produit spontanment dans la pile.
-Lorsque la pile dbite: /E/ diminue ; [Zn2+ ] augmente et [Cu2+ ] diminue . -La fonction des concentrations relative l'quation Zn + Cu2+<====>Zn2++ Cu =[Zn2+ ] / [Cu2+ ] augmente
MAHMOUD GAZZAH
gazzahsp
Das könnte Ihnen auch gefallen
- Piles Electrochimiques PDFDokument12 SeitenPiles Electrochimiques PDFAzizElheni100% (1)
- CHAP 8 Piles Et Potentiels RedoxDokument2 SeitenCHAP 8 Piles Et Potentiels Redoxtoto TOTOROTONoch keine Bewertungen
- Résumé de Cours Sur Les Piles Électrochimiques Pile DaniellDokument6 SeitenRésumé de Cours Sur Les Piles Électrochimiques Pile DaniellchadaNoch keine Bewertungen
- 1CHAP 8 Piles Et Potentiels RedoxDokument2 Seiten1CHAP 8 Piles Et Potentiels Redoxtoto TOTOROTONoch keine Bewertungen
- LectrochimieDokument12 SeitenLectrochimieBrahim JabalNoch keine Bewertungen
- Les PilesDokument5 SeitenLes PilesMål ÆkNoch keine Bewertungen
- TP Chimie PhysiqueDokument9 SeitenTP Chimie PhysiquekhaledrevialNoch keine Bewertungen
- Pile de DanielleDokument3 SeitenPile de DanielleAnis NissouNoch keine Bewertungen
- PilesDokument21 SeitenPilesMohamed El Amine SELMANINoch keine Bewertungen
- I. Principes de Piles Galvaniques: Demi-PileDokument15 SeitenI. Principes de Piles Galvaniques: Demi-PileMOHAMMED ZOUININoch keine Bewertungen
- Cours 1 Les Piles Et Récupération D'énergieDokument6 SeitenCours 1 Les Piles Et Récupération D'énergieBOURASSNoch keine Bewertungen
- ch12 1pilesDokument4 Seitench12 1pilesBelgasem AsselNoch keine Bewertungen
- Piles C3a9lectrochimiquesDokument3 SeitenPiles C3a9lectrochimiquesMohamed ElouakilNoch keine Bewertungen
- 1 - Transformation Spontanées Dans Le Piles Et Production D'énergieDokument7 Seiten1 - Transformation Spontanées Dans Le Piles Et Production D'énergieTaha BoulmaneNoch keine Bewertungen
- TD Électrochimie de Chimie Analytique 2eme Année Pharmacie DR DJAOUDokument5 SeitenTD Électrochimie de Chimie Analytique 2eme Année Pharmacie DR DJAOUmoh moh100% (1)
- Tspec2020 CS TP9 PilesDokument5 SeitenTspec2020 CS TP9 Pilesismahene KafiNoch keine Bewertungen
- 26 Electrolyse Td-CorrigeDokument10 Seiten26 Electrolyse Td-CorrigeChiboubNoch keine Bewertungen
- ElectroDokument30 SeitenElectrofatimazahragramziNoch keine Bewertungen
- Pile DaniellDokument16 SeitenPile DaniellYassir IbralNoch keine Bewertungen
- Chimie C Chap10 Les PilesDokument7 SeitenChimie C Chap10 Les PilesImed LatrechNoch keine Bewertungen
- 7 Les PilesDokument4 Seiten7 Les PilesDalmareen CusubNoch keine Bewertungen
- Hiba PresentationDokument36 SeitenHiba Presentationmostapha lamchichiNoch keine Bewertungen
- Les PilesDokument4 SeitenLes PilesHaider BouzidNoch keine Bewertungen
- C8Chim Les Piles PDFDokument3 SeitenC8Chim Les Piles PDFAzizElheniNoch keine Bewertungen
- Chap7 BtsDokument16 SeitenChap7 BtsImen HammoudaNoch keine Bewertungen
- Présentation1 Les PilesDokument13 SeitenPrésentation1 Les PilesItz SimoNoch keine Bewertungen
- La, PileDokument7 SeitenLa, PileBoukhelif BoualemNoch keine Bewertungen
- Chapitre-7 - Transformations Spontanés Dans Les PilesDokument7 SeitenChapitre-7 - Transformations Spontanés Dans Les Pilesa houssNoch keine Bewertungen
- Site TS C 08 Les PilesDokument9 SeitenSite TS C 08 Les PilesPecorellaNoch keine Bewertungen
- 10 - Oxydoréduction, Piles, Accumulateurs Et Piles À Combustible - CoursDokument2 Seiten10 - Oxydoréduction, Piles, Accumulateurs Et Piles À Combustible - CoursMrt KikxNoch keine Bewertungen
- Exercices 10 Les Piles Et Récupération D'énergieDokument1 SeiteExercices 10 Les Piles Et Récupération D'énergiemadaniNoch keine Bewertungen
- Cours 10 Notion de Potentiel D'oxydoréductionDokument3 SeitenCours 10 Notion de Potentiel D'oxydoréductionBeatrice Florin100% (3)
- Les Pile Et Les AccumulateursDokument13 SeitenLes Pile Et Les Accumulateursch abdeNoch keine Bewertungen
- Electro Lys eDokument4 SeitenElectro Lys eالغزيزال الحسن EL GHZIZAL HassaneNoch keine Bewertungen
- Cadre Théorique - New2Dokument21 SeitenCadre Théorique - New2Oumar TraoréNoch keine Bewertungen
- Série N°11 Chimie Les Piles 2013 2014)Dokument4 SeitenSérie N°11 Chimie Les Piles 2013 2014)Amen RouissiNoch keine Bewertungen
- C8Chim - Les - Piles - Exos - Alessandro Volta PDFDokument4 SeitenC8Chim - Les - Piles - Exos - Alessandro Volta PDFAzizElheniNoch keine Bewertungen
- Cours S5 Chapitre 5 Pile Daniel PDFDokument10 SeitenCours S5 Chapitre 5 Pile Daniel PDFSabeur KhemakhemNoch keine Bewertungen
- Cours Les Piles Elouarde 2biofDokument9 SeitenCours Les Piles Elouarde 2biofabderrazak boubekriNoch keine Bewertungen
- Ex - Pile DaniellDokument1 SeiteEx - Pile DaniellGadour MbarkiNoch keine Bewertungen
- Electrochimie 2Dokument51 SeitenElectrochimie 2maian saja100% (1)
- Chapitre 11 Piles CORRIGEDokument7 SeitenChapitre 11 Piles CORRIGECharles GoNoch keine Bewertungen
- Chapitre 12 Pile AlcalineDokument13 SeitenChapitre 12 Pile AlcalineIinneess ChNoch keine Bewertungen
- Potentiometrie BtsDokument31 SeitenPotentiometrie BtsBenito BenitoNoch keine Bewertungen
- ElectrochimieDokument22 SeitenElectrochimieVinoc MputuNoch keine Bewertungen
- Chapitre 2 - Piles ElectrochimiquesDokument38 SeitenChapitre 2 - Piles ElectrochimiquesabdellatifNoch keine Bewertungen
- Série Pile Math 1 SCDokument3 SeitenSérie Pile Math 1 SCScriblouNoch keine Bewertungen
- Leçon 6 Classification Quantitative Des Couples Oydant-RéducteurDokument4 SeitenLeçon 6 Classification Quantitative Des Couples Oydant-RéducteurN'golo Ismaël CoulibalyNoch keine Bewertungen
- Les PilesDokument17 SeitenLes Pilesbrahim_mdNoch keine Bewertungen
- C9Chim Transformations Forcees PDFDokument2 SeitenC9Chim Transformations Forcees PDFAzizElheni100% (1)
- Cours - Chimie Electrolyse - Bac Technique (2011-2012) MR Ouerghemmi PDFDokument5 SeitenCours - Chimie Electrolyse - Bac Technique (2011-2012) MR Ouerghemmi PDFLotfi Bouchareb100% (3)
- Réactions Électrochimiques Et Courbes Intensité - Potentiel: I) Definitions Generales I-1 ElectrodeDokument47 SeitenRéactions Électrochimiques Et Courbes Intensité - Potentiel: I) Definitions Generales I-1 ElectrodemugiNoch keine Bewertungen
- Transformations Spontanees Dans Les Piles Et Production D Energie Resume de Cours 1 1Dokument2 SeitenTransformations Spontanees Dans Les Piles Et Production D Energie Resume de Cours 1 1Amine AlaoUii AlaouiNoch keine Bewertungen
- RapportDokument7 SeitenRapportMed Outaghjijte0% (1)
- RedoxDokument4 SeitenRedoxCidss CssNoch keine Bewertungen
- Serie 16 ElectrolyseDokument3 SeitenSerie 16 Electrolysee.maskarNoch keine Bewertungen
- Pile Électrochimique2024Dokument15 SeitenPile Électrochimique2024Barhoumi MouradNoch keine Bewertungen
- 1piles ÉlectrochimiquesDokument19 Seiten1piles ÉlectrochimiquesSoufiane El GourineNoch keine Bewertungen
- Devoir de Contrôle N°3 - Sciences Physiques - 3ème Informatique (2021-2022) Mme Mhaouek SoniaDokument4 SeitenDevoir de Contrôle N°3 - Sciences Physiques - 3ème Informatique (2021-2022) Mme Mhaouek SoniaMohsen ArfaouiNoch keine Bewertungen
- Devoir de Synthèse N°2 - Sciences Physiques - 2ème TI (2016-2017) MR Amari Abdelkrim PDFDokument3 SeitenDevoir de Synthèse N°2 - Sciences Physiques - 2ème TI (2016-2017) MR Amari Abdelkrim PDFMohsen ArfaouiNoch keine Bewertungen
- MVT Dans Un Champ Electrique Uniforme 3eme Science 2023Dokument10 SeitenMVT Dans Un Champ Electrique Uniforme 3eme Science 2023Mohsen ArfaouiNoch keine Bewertungen
- Série Récepteur Actif (2ème Année) - 1 PDFDokument2 SeitenSérie Récepteur Actif (2ème Année) - 1 PDFMohsen ArfaouiNoch keine Bewertungen
- Devoir de Synthèse N°2 - Sciences Physiques - 2ème Informatique (2017-2018) MR Khedimi Sami PDFDokument2 SeitenDevoir de Synthèse N°2 - Sciences Physiques - 2ème Informatique (2017-2018) MR Khedimi Sami PDFMohsen ArfaouiNoch keine Bewertungen
- Rottion 1Dokument5 SeitenRottion 1Mohsen ArfaouiNoch keine Bewertungen
- Devoir de Contrôle N°2 - Sciences Physiques - 2ème Informatique (2019-2020) MR Sdiri PDFDokument1 SeiteDevoir de Contrôle N°2 - Sciences Physiques - 2ème Informatique (2019-2020) MR Sdiri PDFMohsen ArfaouiNoch keine Bewertungen
- Devoir de Contrôle N°1 - Sciences Physiques - 3ème Technique (2014-2015) MR Adam BoualiDokument2 SeitenDevoir de Contrôle N°1 - Sciences Physiques - 3ème Technique (2014-2015) MR Adam BoualiMohsen ArfaouiNoch keine Bewertungen
- Devoir de Synthèse N°1 - Sciences Physiques - 3ème Technique (2019-2020) MR Foued BahlousDokument4 SeitenDevoir de Synthèse N°1 - Sciences Physiques - 3ème Technique (2019-2020) MR Foued BahlousMohsen ArfaouiNoch keine Bewertungen
- Controle 1 2022 2 SCDokument2 SeitenControle 1 2022 2 SCMohsen ArfaouiNoch keine Bewertungen
- Rottion 3Dokument2 SeitenRottion 3Mohsen ArfaouiNoch keine Bewertungen
- Transistor TD CorrigeDokument8 SeitenTransistor TD CorrigeMohsen ArfaouiNoch keine Bewertungen
- Circuit RLC PDFDokument4 SeitenCircuit RLC PDFBarhoumi Mourad100% (2)
- BAC Informatique Tunisie 2016 Correction - Principale PDFDokument53 SeitenBAC Informatique Tunisie 2016 Correction - Principale PDFMohsen ArfaouiNoch keine Bewertungen
- Devoir de Contrôle N°3 - Sciences Physiques - 2ème Informatique (2016-2017) MR Amari AbdelkrimDokument2 SeitenDevoir de Contrôle N°3 - Sciences Physiques - 2ème Informatique (2016-2017) MR Amari AbdelkrimMohsen ArfaouiNoch keine Bewertungen
- Resumé Ondes2020Dokument3 SeitenResumé Ondes2020Mohsen ArfaouiNoch keine Bewertungen
- Matière Philosophie Bac Tunisie 2017 Bac InformatiqueDokument1 SeiteMatière Philosophie Bac Tunisie 2017 Bac InformatiqueMohsen ArfaouiNoch keine Bewertungen
- ChimiebacmathDokument336 SeitenChimiebacmathMohsen ArfaouiNoch keine Bewertungen
- 6 Spectre Atomique 4sc 1Dokument9 Seiten6 Spectre Atomique 4sc 1Mohsen Arfaoui0% (1)
- ChimiebacinfoDokument160 SeitenChimiebacinfoMohsen ArfaouiNoch keine Bewertungen
- Devoir de Contrôle N°2 - Sciences Physiques - 2ème Sciences (2016-2017) MR Foued BahlousDokument3 SeitenDevoir de Contrôle N°2 - Sciences Physiques - 2ème Sciences (2016-2017) MR Foued BahlousMohsen ArfaouiNoch keine Bewertungen
- Série D'exercices ElectrostatDokument2 SeitenSérie D'exercices ElectrostatKheria Zitouni100% (3)
- Chapitre 3 - Régime Transitoire (Série 2)Dokument3 SeitenChapitre 3 - Régime Transitoire (Série 2)fahd10lassalNoch keine Bewertungen
- Qualification de Revetements de SurfaceDokument4 SeitenQualification de Revetements de SurfaceZANZANNoch keine Bewertungen
- Hydrocarbures Aromatiques BisDokument2 SeitenHydrocarbures Aromatiques BisNlem NdongoNoch keine Bewertungen
- Devoir 2 TS 2015 2016Dokument4 SeitenDevoir 2 TS 2015 2016rranjalalaoNoch keine Bewertungen
- W2941-22 MigDokument260 SeitenW2941-22 MigMohammed DIABNoch keine Bewertungen
- Mécanique Analytique Cours en Français 2020-2021Dokument105 SeitenMécanique Analytique Cours en Français 2020-2021Marius BrunetNoch keine Bewertungen
- Referentiels Non Galileens ExercicesDokument6 SeitenReferentiels Non Galileens ExercicesRobio GaminGNoch keine Bewertungen
- 08 Evolution SpontaneeDokument3 Seiten08 Evolution SpontaneeChartier JulienNoch keine Bewertungen
- Échange D'ions - Principes de BaseDokument22 SeitenÉchange D'ions - Principes de BaseKFJDONoch keine Bewertungen
- Crushing FinalDokument57 SeitenCrushing Finalsheritier80Noch keine Bewertungen
- CCP 2003Dokument13 SeitenCCP 2003Hamza Filali BabaNoch keine Bewertungen
- Partie I ElectromagnétiqueDokument31 SeitenPartie I Electromagnétiquealeatoire buzzNoch keine Bewertungen
- Bonneau-Jeanmotte-Leon TDC Rapport Edk CompressedDokument59 SeitenBonneau-Jeanmotte-Leon TDC Rapport Edk Compressedapi-638155363Noch keine Bewertungen
- SP00700 DG 1 Water AnalysisDokument4 SeitenSP00700 DG 1 Water AnalysisMick VNoch keine Bewertungen
- 5 Déversement CommentairesDokument105 Seiten5 Déversement CommentairesRussel Kamwa SohNoch keine Bewertungen
- DS1 Chap1Dokument1 SeiteDS1 Chap1valdxNoch keine Bewertungen
- CTP Absorbeur Alcoll EthyliqueDokument17 SeitenCTP Absorbeur Alcoll EthyliqueRemy Blondel100% (1)
- Équipements de Chauffage Et Locaux TechniqueDokument13 SeitenÉquipements de Chauffage Et Locaux Techniquebaho btwNoch keine Bewertungen
- Culture Cellulaire COUR 1Dokument10 SeitenCulture Cellulaire COUR 1Hadjer AdaidaNoch keine Bewertungen
- ThermodynamiqueDokument65 SeitenThermodynamiqueulrich victor kuateNoch keine Bewertungen
- Amines AliphatiquesDokument7 SeitenAmines AliphatiquesOussam OuadidiNoch keine Bewertungen
- Actions Sur ParoiDokument9 SeitenActions Sur ParoiMed ElouartiNoch keine Bewertungen
- Fiche Transport Addition de Poids ExerciceDokument11 SeitenFiche Transport Addition de Poids ExercicezfodhilNoch keine Bewertungen
- Physique 1ereDTI Eval4 Lycee Classique Dschang 2019 2020Dokument2 SeitenPhysique 1ereDTI Eval4 Lycee Classique Dschang 2019 2020brice mouadjeNoch keine Bewertungen
- Travail Pratique Sur L'Acidification Et La FermentationDokument8 SeitenTravail Pratique Sur L'Acidification Et La FermentationmushiziNoch keine Bewertungen
- Résumé Chapitre 1 - Force Et Charge ÉlectriquesDokument3 SeitenRésumé Chapitre 1 - Force Et Charge ÉlectriquesHicham noble100% (1)
- Les Mesures en ChimieDokument6 SeitenLes Mesures en ChimieamalNoch keine Bewertungen
- Travaux Pratique SMC3 Chimie Descriptiv1Dokument3 SeitenTravaux Pratique SMC3 Chimie Descriptiv1Yassine RakchoNoch keine Bewertungen
- Chapitre 9 Transferts ThermiquesDokument7 SeitenChapitre 9 Transferts ThermiquesDina DekhilNoch keine Bewertungen