Beruflich Dokumente
Kultur Dokumente
Cours Thermodynamique
Hochgeladen von
Hichem FakhfekhOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Cours Thermodynamique
Hochgeladen von
Hichem FakhfekhCopyright:
Verfügbare Formate
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
PROPRIETES THERMODYNAMIQUES
Il est important dvaluer les proprits des substances.
Exemple : H et U W et Q
Un petit nombre des proprits est mesurable : T, P, V, m.
Dautres peuvent tre mesures indirectement calorimtrie
C
P
et C
V
Question : comment dterminer u, h, g ?
Rponse :
Combinaison du premier et deuxime principe
Utilisation des proprits math. des fonctions d'tat
Utilisation dquations dtat
Relation de Gibbs (Relation fondamentale de la thermo.)
1
er
et 2
ime
Principes
dv P ds T du
Valable lorsque seul le travail des forces de pression est mis en
jeu modifier pour tenir compte de travaux dautres forces
(lectriques, de surface, etc.)
Intrt de la relation de Gibbs : elle ne fait intervenir que des
fonctions d'tat du systme.
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 1
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
Potentiels thermodynamiques
P, T, v, u et s sont suffisantes pour exprimer toutes les
relations en thermodynamique
Mais certaines combinaisons de ces proprits appariassent
souvent il est plus commode de les dfinir comme de
nouvelles fonctions d'tat
Enthalpie
v P u h +
Energie libre d Helmoltz s T u a
Energie libre de Gibbs
s T h g
Les fonctions h, a et g sont des fonctions dtat
Ces fonctions ont des valeurs minimales l'tat d'quilibre
lorsque le systme est soumis diverses contraintes elles
sont appeles potentiels thermodynamiques.
A lquilibre lorsque (contraintes) Forme diffrentielle
u est minimale s = cste et v = cste
dv P ds T du
h est minimale s = cste et P = cste
dP v ds T dh +
a est minimale T = cste et v = cste
dv P dT s da
g est minimale T = cste et P = cste dP v dT s dg +
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 2
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
Rappels mathmatiques
Soit z une fonction deux variables x et y z = z(x , y)
Si z est continue et drivable autant de fois que lon veut on a :
dy
y
z
dx
x
z
dz
x y
,
_
,
_
On peut crire :
dy ) y , x ( N dx ) y , x ( M dz +
Avec :
x y
y
z
) y , x ( N et
x
z
) y , x ( M
,
_
,
_
On peut montrer les relations suivantes :
y x
x
N
y
M
,
_
,
_
1
x
y
y
x
z z
,
_
,
_
1
x
z
z
y
y
x
y x z
,
_
,
_
,
_
La dernire relation (relation du triple produit) est trs utile elle
permet dliminer des drives une contrainte non favorable.
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 3
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
Relations de Maxwell
A partir des relations ci-dessus on peut tablir les relations trs
utiles ci-aprs :
Diffrentielle Relations de
Maxwell
u du = Tds Pdv
s v
v
u
P et
s
u
T
,
_
,
_
s v
T
v
P
s
,
_
,
_
h dh = Tds + vdP
s P
P
h
v et
s
h
T
,
_
,
_
s P
T
P
v
s
,
_
,
_
a da = - sdT Pdv
T v
v
a
P et
T
a
s
,
_
,
_
v T
T
P
v
s
,
_
,
_
g dg = - sdT +vdP
T P
P
g
v et
T
g
s
,
_
,
_
P T
T
v
P
s
,
_
,
_
Ces relations fournissent des dfinitions thermodynamiques de
T et P.
Les relations de Maxwell peuvent tre utilises pour dterminer
lentropie s en fonction des grandeurs mesurables T, v et P.
Diffrentielles des proprits thermodynamiques
Les variations de u, h, a et g sont importantes dans beaucoup
de situations pratiques
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 4
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
Les relations de Maxwell seront dune grande utilit pour
tablir les relations permettant de calculer ces variations en
fonction des grandeurs mesurables T, P, v, C
v
et C
P
..
Proprit Forme diffrentielle
Energie interne, u
dv P
T
P
T dT C du
v
v 1
]
1
,
_
+
Enthalpie, h
dP
T
v
T v dT C dh
P
P 1
]
1
,
_
+ +
E
n
t
r
o
p
i
e
,
s
Variables T et v
dv
T
P
dT
T
C
ds
v
v
,
_
+
Variables T et P
dP
T
v
dT
T
C
ds
P
P
,
_
Variables v et P
dP
P
T
T
C
dv
v
T
T
C
ds
v
v
P
P
,
_
,
_
Remarque
Les expressions obtenues pour du, dh, et ds en fonction de
grandeurs mesurables peuvent tre utilises pour obtenir des
relations similaires pour da et dg en utilisant les dfinitions de a
et g.
Coefficients de Joule-Thomson et dEuken
Coefficient de Joule-Thomson degr de rduction de T
suite une dtente isenthalpique.
h
P
T
,
_
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 5
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
Il est ais de montrer que :
P
h
h
C
v
P
T
T
P
T
,
_
,
_
Coefficient dEuken variation de T suite une dtente
nergie interne constante
u
v
T
,
_
Il est ais de montrer que :
v
v
u
C
P
T
P
T
v
T
,
_
,
_
Variation de C
P
et C
V
avec P et v
dP
T
v
T v dT C dh
P
P 1
]
1
,
_
+ +
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 6
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
P
T
T
,
_
1
]
1
,
_
,
_
P
P
T
v
T v
P
C
P
2
2
T
P
T
v
P
C
,
_
,
_
dv P
T
P
T dT C du
v
v 1
]
1
,
_
+
V
T
T
P
,
_
1
]
1
,
_
,
_
v
v
T
P
T
v
C
v
2
2
T
v
T
P
v
C
,
_
,
_
Expressions gnrales des drives
On 8 variables thermodynamiques T, P, v, s, u, h, a et g
168 drives diffrentes (sans compter les drives inverses)
Ces drives mettent en jeu 3 variables la fois.
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 7
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
Par exemple
,
v
a
,
s
h
,
v
P
s g T
,
_
,
_
,
_
etc.
Le nombre de relations qui relient ces drives est trs grand
on se limite aux relations mettant en jeu T, P, v et C
P
et C
v
(grandeurs mesurables)
Voir polycopi pour la technique utilise pour valuer les
168 drives en termes de T, P, v et C
P
et C
v
Expression de la diffrence des capacits calorifiques
v
v
T
s
T C
,
_
et dP
T
v
dT
T
C
ds
P
P
,
_
1
]
1
,
_
,
_
,
_
v v
v
T T
T
P
T
v T
T
C
C
P
P
De lexpression ci-dessus on dduit :
v P
v P
T
P
T
v
T C C
,
_
,
_
La diffrence des capacits calorifiques sexprime en fct de T,
P et v
Proprits thermodynamique dun gaz parfait
Equation dtat dun gaz parfait (pour une mole) :
T R v P
Capacits calorifiques
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 8
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
0
,
_
T
P
C
P
C
P
dun gaz parfait ne dpend pas de la pression
0
,
_
T
v
C
v
C
V
dun gaz parfait ne dpend pas du volume
Pour un gaz parfait on a la relation dite de Meyer :
R C C
V P
Les capacits calorifiques dun gaz parfait ne dpendent ni de P ni
de v et sont tout au plus dpendantes de la temprature
Pour les GP polyatomiques : C
P
et C
V
sont des fonction de T (quon
approxime souvent par des formes polynomiales). Mais la relation
de Meyer C
P
C
v
= R, reste valable
Pour un gaz parfait form de molcules monoatomiques
rigides il peut tre montr partir de calculs de mcanique
statistique que les capacits calorifiques pression, et
volume constants sont indpendantes de la temprature et
sont donc de vraies constantes.
Proprits thermodynamique dun gaz parfait
(suite)
Energie
interne
dT C du
v
Lnergie interne dun GP ne dpend que de la
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 9
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
temprature
Enthalpie dT C dh
P
Lnthalpie dun GP ne dpend que de la
temprature
Entropie
( ) ( ) lnv d R lnT d C
v
dv
R
T
dT
C ds
v v
+ +
( ) ( ) lnP d R lnT d C
P
dP
R
T
dT
C ds
P P
Coefficient
de Joule-
Thomson
0
,
_
GP
h
P
T
La temprature dun gaz parfait ne change pas
durant une dtente adiabatique dans le vide
Coefficient
dEuken
0
v
T
GP
u
,
_
La temprature dun gaz parfait ne change pas
durant une dtente isenthalpique
Proprits thermodynamiques des gaz rels
Equations dtat
Lexprience montre que seul un nombre rduit de
proprits est suffisant pour la description de ltat dun
systme.
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 10
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
Pour un systme constitu dune substance pure sous forme
dune seule phase deux variables suffisent pour la
description complte du systme 3 variables sont lies
par une quation dtat
Les variables gnralement choisie sont T, P et v (volume
molaire ou massique) lquation dtat sexprime par
une relation du type : f(P, v, T) = 0
Exemple : Lquation dtat des gaz parfaits : Pv = RT
Dduite de lexprience sur le comportement des gaz
basses pressions
Etablie partir du modle molculaire
Molcules sont assimilables des points matriels
Interactions molculaires rduites de simple chocs
lastiques.
Modle trs simplifi ne permet pas de dcrire le
comportement des gaz rels domaine d'application
fort limit
Des quations dtat plus aptes dcrire le comportement des
gaz dans sous diverses conditions ont t et continuent dtre
dveloppes
Donnes exprimentales
Modles molculaires
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 11
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
Facteur de compressibilit
T R
v P
Z
La dviation du facteur de compressibilit de lunit est une
mesure de lcart par rapport au comportement des GP
Equation dtat de van der Waals propose pour tenir
compte :
des interactions molculaires
de la taille des molcules
( ) T R b v
v
a
P
2
,
_
+
Deux paramtres a et b
La dtermination des constantes a et b peut se faire partir de
lobservation empirique : Lisotherme critique des substances
relles admet un point dinflexion horizontal la pression
critique dans un diagramme (P, v)
Mathmatiquement on a au point critique :
0
v
P
v
P
c c
T
2
T
,
_
,
_
Lutilisation de ces relations et lqt de van der Waals
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 12
Interactions entre
molcules
Taille des molcules
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
c
2
c
2
P
T
R
64
27
a
3
v
P 8
T R
b
c
c
c
0.375
8
3
T R
V P
Z
c
c c
c
Lqt de VW prvoit un facteur de compressibilit critique de
0.375 non-conforme la ralit
On peut se contenter de traiter a et b comme des
paramtres dajustement quon obtient en minimisant lcart
par rapport aux donnes exprimentales
En termes des variables rduites:
c
r
c
r
c
r
v
v
v
P
P
P
T
T
T
Lqt de VW scrit :
( )
r r
2
r
T 8 1 v 3
v
a
P
r
,
_
+
en termes des variables rduites on obtient une quation
universelle dont les paramtres sont indpendants de la
substance.
Lquation dtat de VW fait partie des quations dtats dites
cubiques.
( )
( )
( ) ( ) v v b v
- v
b v
T R
P
2
+ +
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 13
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
( )
( )
( ) ( ) v v b v
- v v
T R
b v
v
Z
2
+ +
,
_
Le facteur de compressibilit est solution de lquation
cubique adimensionnelle suivante :
( ) ( ) [ ] ( ) [ ] 0 ' ' 1 B' ' Z 1 B' ' ' ' Z 1 B' ' Z
2 3
+ + + + + +
Avec :
T R
P b
B'
T R
P
'
( )
2
T R
P
'
2
T R
P
'
,
_
T R
P
'
Equation Paramtres
Van der
Waals
0 0
a(T
r
)
b ; a
Redlich-
Wong
b b 0
a(T
r
) b ; a
Redlich-
Wong-Soave
b b 0
a(T
r
)
; b ; a
Peng-Robinson
2b b -b
2
a(T
r
)
; b ; a
Equation
(T
r
)
Van der Waals 1
Redlich-Wong
r
T
1
Redlich-Wong-
Soave
( ) ( ) [ ]
2
r
2
T 1 0.176 1.574 0.48 1 + +
Peng-Robinson
( ) ( ) [ ]
2
r
2
T 1 0.2699 1.54226 0.37464 1 + +
Equation
Z
c
c
c
T R
P b
c
c
T R
P
2
c
c
T R
P
,
_
( )
2
c
c
T R
P a
Van der Waals
0.375 0.125 0 0 0.42188
Redlich-Kwong
0.333
3
0.0866
4
0.08664 0 0.42748
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 14
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
Redlich-Kong-
Soave
0.333
3
0.0866
4
0.08664 0 0.42748
Peng-Robinson
0.307
0
0.0778 0.15559 - 0.006053 0.45724
Equation dtat du viriel
En terme de P
... P (T) D' P (T) C' P (T) B' 1
T R
v P
Z
3 2
+ + + +
ou en terme de 1/v :
...
v
D(T)
v
C(T)
v
B(T)
1
T R
v P
Z
3 2
+ + + +
Les coefficients B, C, D, B, C, D, sont des fonctions de
la temprature uniquement.
Ils dcrivent les interactions molculaires, ainsi B dcrit les
interactions entres des pairs de molcules, C dcrit les
interactions entre triplets de molcules etc.
La mcanique statistique relations pour calculer B, C, D
etc. mais complexes sont traits comme des paramtres
dajustement que lon obtient exprimentalement.
Principe des tats correspondants
Diagramme du facteur de compressibilit gnralis
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 15
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
Des gaz ayant la mme temprature rduite et la mme pression
rduite sont dits tre dans des tats correspondants
Principe des tats correspondant des gaz dans des tats
correspondants ont le mme volume rduit (v
r
est une fonction
universelle de T
r
et P
r
)
Les donnes exprimentales montrent que le principe des tats
correspondants peut tre utilise avec une approximation
acceptable dans beaucoup de situations prsentant un intrt
pratique
Etant donn que lon peut crire :
r
r r
c
T
v P
Z Z
Et que pour la plupart des gaz rels, le facteur de compressibilit
critique est confin un domaine restreint :
( ) 0.31 Z 0.25
c
Un diagramme gnralis pour le facteur de compressibilit, Z, est
tabli en utilisant une valeur moyenne de Z
c
(Z
c
= 0.27)
Proprits thermodynamiques
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 16
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
partir des quations dtat
Gaz parfaits
dT C du
V
dT C dh
P
( ) ( ) lnv d R lnT d C
v
dv
R
T
dT
C ds
V V
+ +
( ) ( ) lnP d R lnT d C
P
dP
R
T
dT
C ds
P P
Si les capacits calorifiques sont de vraies constantes on
a pour un processus isentropique :
1
i
f
1
i
f
i
f
v
v
P
P
T
T
,
_
,
_
Proprits des gaz rels partir dquations dtat
Pour un gaz rel le calcul des proprits thermodynamique doit
se faire partir des formes diffrentielles :
dv P
T
P
T dT C du
v
V 1
]
1
,
_
+
dP
T
v
T v dT C dh
P
P 1
]
1
,
_
+ +
dv
T
P
dT
T
C
ds
v
V
,
_
+
dP
T
v
dT
T
C
ds
P
P
,
_
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 17
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
Equation dtat explicite en volume
P) , (T v v
.
On commence par calculer lenthalpie et lentropie en
choisissant T et P comme variables indpendantes
On choisit un chemin dintgration commode
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 18
a
b
P
T
P
*
f
i
P
i
T
i
T
f
P
f
1
]
1
,
_
*
i
P
P
P
i
a
i
a i
dP
T
v
T v dh h
,
_
*
i
P
P
P
a
i
a i
dP
T
v
ds s
f
i
T
T
*
P
b
a
b a
dT C dh h
f
i
T
T
*
P
b
a
b a
dT
T
C
ds s
1
]
1
,
_
f
*
P
P
P
f
f
b
f b
dP
T
v
T v dh h
,
_
f
*
P
P
P
f
b
f b
dP
T
v
ds s
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
Les variations des autres proprits (u, a et g) se fait en
utilisant les relations de dfinitions : u = h - Pv, g = h Ts etc.
Equation dtat explicite en pression
v) , (T P P
On commencer par calculer lnergie interne et lentropie
en choisissant T et v comme variables indpendantes
On choisi un chemin dintgration commode
Le calcul des proprits thermodynamique ncessite :
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 19
v
v
f
v
i
T
f
T
i
T
f
i
b
a
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
le comportement volumtrique du gaz (une eqt dtat)
le comportement calorifique du gaz (
*
P
C
et
*
v
C
)
Fugacit et coefficient de fugacit
Lnergie libre de Gibbs (et une grandeur thermodynamique
qui lui est associe : la fugacit) jouent un rle essentiel dans la
thermo des quilibres entre phases.
Rappelons la relation :
v
P
g
T
,
_
ste
C T dP v dg
Pour un GP :
( ) dlnP RT
P
dP
RT dg
T
Pour les fluides nobissant pas la loi des gaz parfaits on
aimerait garder la mme forme en introduisant une nouvelle
fonction appele fugacit f(T , P) :
( ) f ln d RT dP v dg
T
Par ailleurs les gaz obissent la loi des gaz parfait aux basses
pressions :
P f
lim
0 P
Il est souvent plus pratique de travailler avec le coefficient de
fugacit, :
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 20
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
P
f
avec
1
lim
0 P
Coefficients de fugacit partir dquations dtat
La dfinition la fugacit est une pression corrige
La correction provient de :
la gomtrie des molcules
les interactions molculaires
la fugacit est lie au coefficient de compressibilit, Z
on peut calculer la fugacit partir dune quation dtat
A partir dquation dtat explicite en volume
,
_
P
0
dP
P
1
RT
v
ln
Calcul de partir dquation dtat explicite en pression
RT
Pv
ln 1
RT
Pv
dv P
v
RT
RT
1
ln
v
+
,
_
Calcul des proprits thermodynamique en utilisant le
principe des tats correspondants
Lquation dtat base sur le principe des tats correspondants
(Z en fonction de P
r
et T
r
) peut tre utilise pour calculer les
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 21
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
carts des proprits thermodynamiques par rapport aux gaz
parfaits. Les diagrammes gnraliss pour lenthalpie,
lentropie et la fugacit, sont donns dans la littrature.
Proprits thermodynamiques partir des quations dtat
cubiques
( )
( ) v v
v
RT
b v
v
Z
2
+ +
Ecart par rapport au comportement dun gaz parfait
Facteur de compressibilit
( )
( ) v v
v
RT
b v
b
Z 1
2
+ +
+
Enthalpie
( )
( )
Z 1
4 2v
4 2v
ln
4 RT
dT
d
T
RT
h h
2
2
2
*
+
1
1
]
1
+ +
+
,
_
Entropie
( )
( )
1
]
1
,
_
1
1
]
1
+ +
+
v
b
1 Z ln
4 2v
4 2v
ln
4 R
dT
d
R
s s
2
2
2
*
Energie libre dHelmoltz
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 22
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
( )
( )
1
]
1
,
_
+
1
1
]
1
+ +
+
v
b
1 Z ln
4 2v
4 2v
ln
4 RT
RT
a a
2
2
2
*
Fugacit
( )
( )
( ) Z 1
v
b
1 Z ln
4 2v
4 2v
ln
4 RT
P
f
ln
2
2
2
1
]
1
,
_
1
1
]
1
+ +
+
,
_
Dans toutes les quations ci-dessus :
Si
0 4
2
les termes :
dT
d
T et
ont
2
v
1
-
+
au lieu de
( )
( ) 1
1
]
1
+ +
+
4 2v
4 2v
ln
4
1
2
2
2
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 23
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
Equilibre des phases dun corps pur
Critre dquilibre entre phases T et P constantes
Un systme constitu dune substance pure se trouve de deux
phases et .
Une petite quantit de matire m est passe de
transfert mettant en jeu un change dnergie sous forme de
travail W et Q avec le milieu extrieur)
Processus est rversible. La situation est illustre ci-dessous :
Systme ferm T et P
Premier principe
Q W dU +
Deuxime principe
T
Q
dS
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 24
Q
W
m
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
La variation des proprits du systme rsultent du transfert de
matire m de sorte que :
Variation de U ( ) m u u dU dU dU
+
Variation de S ( ) m s s dS dS dS
+
Variation de V ( ) m v v dV dV dV
+
Le travail change (deux parties : le travail effectu contre les
forces de pression,
dV P
et le travail utile que lon notera W
*
)
*
W dV P W +
En replaant dans les quations des deux principes
( ) ( ) ( )
*
*
W m s T s T m v v P m u u
dS T W dV P dU
+ +
+ +
Ou encore :
( ) ( ) [ ]
*
W m s T v P u s T v P u
+ +
s T v P u g +
( )
*
W dG m g g
Systme en quilibre pas dchange de travail :
0 dG
g g
Lquilibre entre phases se traduit par :
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 25
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
g g P P T T
Calcul des fugacits des phases condenses
La fugacit joue un rle essentiel dans les calculs des quilibres
entre phases en effet lquilibre entre deux phases et T et P
constante se traduit par la relation :
f f
Lgalit des fugacits est un critre de lquilibre entre
phases au mme titre que lgalit de lnergie libre de Gibbs
spcifique.
La fugacit joue un rle aussi important il est fondamental
de pouvoir lvaluer dans diverses conditions :
- Pour un gaz une quation dtat
- Pour les phases condenses (liquide ou solide) on utilise la
technique ci-dessous. Supposons que lon dsire calculer la
fugacit dun liquide pure T et P
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 26
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
-
A l'tat de vapeur sature on a :
(T) P (T) f
s s s
s
= Coefficient de fugacit pour la vapeur sature, peut
tre calcul moyennant une quation dtat pour la vapeur
sature.
La fugacit du liquide satur est gale celle de la vapeur
sature (phases en quilibre)
Pour passer de la fugacit du liquide satur T et P
s
celle du liquide dans les conditions relles T et P on
utilise la relation :
RT
v
P
lnf
T
,
_
.
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 27
Diminution de la
pression
Liquide pure
T et P
f
l
(T , P)
Liquide
satur T
et P
s
f
ls
Vapeur
sature T
et P
s
f
vs
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
En dfinitive :
dP
RT
v
exp P P) , (T f
P
P
l
s s l
s
Pression de la vapeur saturante T
Coefficient de fugacit de la vapeur saturante T et
s
P
Correction de Poynting (effet de la pression sur la fugacit de
la phase liquide)
En premire approximation la fugacit d'un liquide T est P
est gale la pression de vapeur saturante du liquide T.
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 28
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
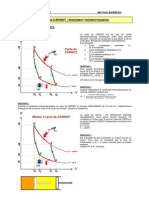
Equations de Clausius-Clapeyron
Diagramme reprsentant les 3 phases dun corps pur
comprend trois courbes sparant les trois phases.
Lquation de Clausius-Clapeyron permet de calculer les
pentes
qui
dT
dP
,
_
( ) T v v
h h
v v
s s
dT
dP
qui.
,
_
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 29
Temprature
P
r
e
s
s
i
o
n
Phase liquide
Phase solide
Phase vapeur
Point triple
Point
critique
Ecole Mohammadia d'Ingnieurs Mohamed TAHIRI ; Ph.D.
__________________________________________________________________________________________
Pour un quilibre liquide-vapeur, lquation de Clausius-
Clapeyron peut tre simplifie et intgre pour donner :
,
_
0
v
0
T
1
T
1
R
h
P
P
ln
Equation dite dAntoine :
B
T
A
P ln +
O A et B sont des constantes.
_______________________________________________________________________________________
Cours de Thermodynamique Applique - Calcul des proprits thermodynamiques Page 30
Das könnte Ihnen auch gefallen
- Cours Thermodunamique Sahnoun PDFDokument59 SeitenCours Thermodunamique Sahnoun PDFiraoui jamal (Ebay)100% (1)
- Exercices d'intégrales et d'équations intégro-différentiellesVon EverandExercices d'intégrales et d'équations intégro-différentiellesNoch keine Bewertungen
- Analyse Mathématique pour l'ingénieur: Analyse Mathématique pour l'ingénieur, #2Von EverandAnalyse Mathématique pour l'ingénieur: Analyse Mathématique pour l'ingénieur, #2Noch keine Bewertungen
- 1-Fonction Machine Frigorifique Partie8 8Dokument26 Seiten1-Fonction Machine Frigorifique Partie8 8said3232Noch keine Bewertungen
- Coefficients ThermoelastiquesDokument12 SeitenCoefficients ThermoelastiquesAsmaa FelidjNoch keine Bewertungen
- TD Machines ThermiquesDokument3 SeitenTD Machines ThermiquesHicham DaoudiNoch keine Bewertungen
- TD 1 - Si - 2018Dokument2 SeitenTD 1 - Si - 2018IngenieurNoch keine Bewertungen
- Projet PfeDokument21 SeitenProjet PfeBADER0% (1)
- Cours Transfert Thermique - Loi de FourierDokument13 SeitenCours Transfert Thermique - Loi de Fourieramjed_de_enimNoch keine Bewertungen
- SMP - S6 - ThermoApp - Kammouni TD Serie 3 SolutionDokument13 SeitenSMP - S6 - ThermoApp - Kammouni TD Serie 3 SolutionMahatNoch keine Bewertungen
- TP 1 TRCHDokument7 SeitenTP 1 TRCHBrahim MouhcineNoch keine Bewertungen
- Cours de Physique Partim Thermo Année 2018-19Dokument87 SeitenCours de Physique Partim Thermo Année 2018-19Moîse Sairys MoîseNoch keine Bewertungen
- Support de Cours FinalDokument19 SeitenSupport de Cours FinalAnass Akrim100% (1)
- Pinch Analysis-2023.pptx - 2Dokument68 SeitenPinch Analysis-2023.pptx - 2Mohamed El AssaliNoch keine Bewertungen
- Cour N°1 Généralités Sur Les Transferts de ChaleurDokument14 SeitenCour N°1 Généralités Sur Les Transferts de Chaleurlauren100% (1)
- Pfe GMDokument95 SeitenPfe GMleomessibarcelonaNoch keine Bewertungen
- Mini ProjetDokument27 SeitenMini ProjetMouhcine AminiNoch keine Bewertungen
- Thermodynamique 1 PDFDokument57 SeitenThermodynamique 1 PDFFalikou TraoreNoch keine Bewertungen
- Conseils Compte Rendu TPDokument2 SeitenConseils Compte Rendu TPAbdelbasset Biaz100% (3)
- Corrigé - TD.Thermochimie 2013Dokument16 SeitenCorrigé - TD.Thermochimie 2013ZerNoch keine Bewertungen
- Chapitre 2Dokument106 SeitenChapitre 2bezaNoch keine Bewertungen
- TP Charge Et Décharge D'un CondensateurDokument3 SeitenTP Charge Et Décharge D'un CondensateurMtibaa MaherNoch keine Bewertungen
- Série TD 1Dokument6 SeitenSérie TD 1Manuel ArzolaNoch keine Bewertungen
- MecaFluides2sur6 PDFDokument32 SeitenMecaFluides2sur6 PDFJeyid Daye100% (1)
- La PhotoconductivitéDokument6 SeitenLa PhotoconductivitéMaryNoch keine Bewertungen
- MCI ExamenDokument1 SeiteMCI Exameninvasion99Noch keine Bewertungen
- TP2 Cycle Rankine Avec RegenerationDokument4 SeitenTP2 Cycle Rankine Avec RegenerationYahya JanatiNoch keine Bewertungen
- Réactivité Chimique: S3 Mip, FST - Fès Année Universitaire 2020/2021Dokument63 SeitenRéactivité Chimique: S3 Mip, FST - Fès Année Universitaire 2020/2021Oumayma IkhlefNoch keine Bewertungen
- SMCS5 Exam 2014 2015 ÉlectrochimieDokument6 SeitenSMCS5 Exam 2014 2015 Électrochimieayyoub dhb0% (1)
- Module 06 Transferts ThermiquesDokument53 SeitenModule 06 Transferts ThermiquesDjamila BenyoucefNoch keine Bewertungen
- °tds Mecanique Solide Fps-Safi Sma4 2020 PDFDokument41 Seiten°tds Mecanique Solide Fps-Safi Sma4 2020 PDFSelma Seniorita50% (2)
- Transfert ThermiqueDokument14 SeitenTransfert ThermiqueMed Chouaybi100% (2)
- Chapitre 3 - Transfert de Chaleur Par Conduction en Régime Permanent PDFDokument80 SeitenChapitre 3 - Transfert de Chaleur Par Conduction en Régime Permanent PDFĶhadija KhadijaNoch keine Bewertungen
- TP Machine Thermique4Dokument12 SeitenTP Machine Thermique4SOUKAINA HANINENoch keine Bewertungen
- Enset - Mohammedia 2017/2018Dokument2 SeitenEnset - Mohammedia 2017/2018amine dalaaNoch keine Bewertungen
- SMP 3 PDFDokument60 SeitenSMP 3 PDFsoufyane el ouahabiNoch keine Bewertungen
- DS 14 15 rtp2Dokument6 SeitenDS 14 15 rtp2Mohammed MarzougNoch keine Bewertungen
- Chapitre 2 + Tdn°1 +tdn°2 Ecoulement Isentropique Unidimensionnel en Conduit A Section VariableDokument33 SeitenChapitre 2 + Tdn°1 +tdn°2 Ecoulement Isentropique Unidimensionnel en Conduit A Section Variableissam N.e100% (1)
- TD 3 Transfert de Chaleur Et de Masse Approfondis M1Dokument9 SeitenTD 3 Transfert de Chaleur Et de Masse Approfondis M1Mohamed BelazilNoch keine Bewertungen
- Université D'angers UFR Sciences L3 - LicenceDokument2 SeitenUniversité D'angers UFR Sciences L3 - LicencemdeelbNoch keine Bewertungen
- TD Thermo5Dokument1 SeiteTD Thermo5Ahlam MimiNoch keine Bewertungen
- Chapitre 4 Transition de Phase Version Simplifiée STDokument45 SeitenChapitre 4 Transition de Phase Version Simplifiée STArmel YmgNoch keine Bewertungen
- td1 Diagrammes Binaires mgf2 Caf2 CorrectionDokument2 Seitentd1 Diagrammes Binaires mgf2 Caf2 CorrectionŘachida Lk100% (2)
- Transfertdechaleur Vol2 PDFDokument120 SeitenTransfertdechaleur Vol2 PDFAbdelhak EL HraichaNoch keine Bewertungen
- CHAP-2-2-1Trsf1 Cond UnidDokument38 SeitenCHAP-2-2-1Trsf1 Cond UnidChaima AghaNoch keine Bewertungen
- Potent21 22Dokument21 SeitenPotent21 22kitty koukaNoch keine Bewertungen
- Tpe Daouas (Réparé)Dokument7 SeitenTpe Daouas (Réparé)Mayssem SouidNoch keine Bewertungen
- Thermo A3Dokument40 SeitenThermo A3Toufik Sam100% (1)
- Moteurs 2Dokument19 SeitenMoteurs 2Sofiane AmmriNoch keine Bewertungen
- BACKSTEPPINGDokument10 SeitenBACKSTEPPINGPÏPØ ABD REZAKNoch keine Bewertungen
- Chap 2 Thermodynamique GAZ REELSDokument39 SeitenChap 2 Thermodynamique GAZ REELSNour El Houda TebbaneNoch keine Bewertungen
- Série2 thermoFI + CorrigéDokument5 SeitenSérie2 thermoFI + Corrigép100% (1)
- ThermodynamiqueDokument146 SeitenThermodynamiqueahmedNoch keine Bewertungen
- Methode - Difference FinieDokument11 SeitenMethode - Difference Finieoussama haj mansourNoch keine Bewertungen
- Examen 2012 CorrigeDokument3 SeitenExamen 2012 CorrigeIssam Mob0% (1)
- TC - Examen - Emd 6 6733Dokument12 SeitenTC - Examen - Emd 6 6733Ha NahNoch keine Bewertungen
- Conversion De L'Énergie Thermique Des Océans: Des différences de température entre les eaux de surface et les eaux profondes de l'océanVon EverandConversion De L'Énergie Thermique Des Océans: Des différences de température entre les eaux de surface et les eaux profondes de l'océanNoch keine Bewertungen