Beruflich Dokumente
Kultur Dokumente
Hidrometalurgia 2
Hochgeladen von
carloto244Originaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Hidrometalurgia 2
Hochgeladen von
carloto244Copyright:
Verfügbare Formate
CURSO
HIDROMETALURGIA
PREPARADO POR:
MARIO GAETE MADARIAGA.
Procesos
Hidrometalrgicos
Condiciones
Termodinmicas favorables
Disminucin de
Energas Libres
Por lo tanto, las limitaciones son de carcter cintico
T bajas
Velocidad de
reaccin baja
Producto
Reactivo
Investigacin Cintica
Medir Concentracin especie de valor a diferentes tiempos
Permite obtener: orden de reaccin, parmetros cinticos y mecanismos de la reaccin.
Mecanismos en Reacciones de Lixiviacin
Sistemas Hidrometalrgicos Sistemas Heterogneos
Reacciones tienen lugar en interfaces en la cual
ocurre transferencia de materia de una fase a la
otra.
Reacciones Heterogneos ms comunes en hidrometalurgia son:
* Reacciones slido lquido
* Reacciones lquido lquido
Lixiviacin, intercambio
inico, cementacin, etc.
Extraccin por Solventes
Tambin sistemas que emplean una fase gaseosa
Ej.: Lixiviacin con Oxgeno
Lixiviacin
Fase slida mineral, concentrado o especie pura
Fase lquida
solucin que contiene agente lixiviante y
elementos metlicos disueltos
Normalmente dos tipos de reacciones pueden ocurrir en lixiviacin:
|A| + <B> productos fluidos (1)
|A| + <B> productos slidos y lquidos (2)
Caso (1) Lixiviacin de especies puras que no
forman residuos slidos como producto
de reaccin Ej: Disolucin de
chalcantita, brochantita, etc
Caso (2) Lixiviacin de especies que forman
residuos slidos, Caso ms frecuente en
lixiviacin. Ej: Disolucion de crisocola,
sulfuros de cobre con iones frricos,
Tambin se puede considerar a los
minerales de baja ley, donde el material
estril o ganga constituye la fraccin
mayoritaria.
ETAPAS ELEMENTALES DE UNA REACCION HETEROGENEA.-
Reaccin Heterognea Global, se tiene:
a|A| + <B> r|R| + s<S>
donde A es la solucin lixiviante propiamente tal
B representa el material slido que contiene el elemento de
inters a disolver
R representa el producto fluido de la reaccin
S el material slido como producto de reaccin
Se pueden definir las siguientes etapas elementales en las que se
puede subdividir el proceso heterogneo:
1.- Transporte del reactivo A por escurrimiento de la masa de fluido
2.- Difusin externa de A, desde el seno de la solucin hasta la superficie de la
partcula, a travs de la capa lmite estacionaria que se crea alrededor de la
partcula.
3.- Difusin interna en la partcula por difusin a travs de los poros
4.- Adsorcin de A sobre un sitio activo, ya sea en la superficie externa de la
partcula o en la superficie interna de los poros
5.- Reaccin en la superficie, es decir, transformacin de los reactivos A y B en los
productos R y S en la fase absorbida. Esta reaccin puede ser de simple
descomposicin (qumica) o de xido - reduccin (electroqumica)
Se pueden definir las siguientes etapas elementales en las que se
puede subdividir el proceso heterogneo:
6.- Desorcin de R desde la superficie externa e interna de la partcula
7.- Difusin interna de R, desde el interior de la partcula por difusin a
travs de los poros.
8.- Difusin externa de R hacia el seno de la fase fluida a travs de la
capa lmite que rodea a la partcula.
9.- Transporte de R hacia el exterior del sistema por escurrimiento de la
masa de fludo.
10 Generacin y transferencia de calor en el interior del grano.
9
8
2
1
La etapa ms lenta, es decir, la de mayor resistencia en las condiciones
de operacin, ser la que controla la transformacin global y se define
como la ETAPA CONTROLANTE.
No siempre se presentan todas las etapas.
Ejemplo:
Si no se forman productos gaseosos, o si la reaccin es irreversible,
las etapas 7 y 8 no contribuyen directamente a la resistencia a la
reaccin.
La etapa 10 generalmente no se considera en el anlisis de una
reaccin de lixiviacin tradicional, aunque en la lixiviacin
bacterial puede presentarse un efecto exotrmico, con incrementos
de T de la solucin de 10 a 15 C.
Las etapas 4, 5 y 6 conforman el proceso global de reaccin y son
difciles de aislar entre s. En un mecanismo simplificado, stas
pueden ser confundidas y analizadas como una sola etapa.
Ejemplo:
La difusin externa define la difusin en fase homognea en
solucin, y queda caracterizada por la Ley de Fick. La difusin
interna es la difusin del reactivo en la capa de producto slido
poroso que se puede formar durante la reaccin. La difusin en
los poros depende de las caractersticas de las molculas que
difunden y del dimetro y longitud del poro; mientras ms largo y
estrecho es el poro, ms difcil es la difusin. Ambos conceptos
pueden ser agrupados como transferencia de masa de fluido en el
film y difusin propiamente tal en la capa de slido.
De esta forma, en un mecanismo simplificado se tendra:
i.- Transferencia de masa en el film de fluido
ii.- Difusin de A a travs del residuo slido poroso
como producto de reaccin
iii.- Reaccin de A con el slido en la superficie de reaccin
iv.- Difusin de los productos formados a travs del residuo slido
hacia la superficie exterior del slido
v.- Transferencia de masa de los productos de reaccin hacia el seno
de la solucin.
Etapa N Relacionada con
Flujo Forzado (1 y 9) Tipo de reactor, tamao y forma de las partculas y con el caudal de la
fase fluida
Difusin Externa (2 y 8)
(Transferencia de masa)
Tamao y forma de las partculas, velocidad relativa entre el fluido y
las partculas y tipo de reactor
Etapas el interior de la
partcula (3, 4, 5, 6, y 7)
Naturaleza fsica y qumica del slido y de la composicin de la fase
fluida. No dependen del tipo de reactor empleado.
Difusin interna (poros) (3 y 7) Tamao y forma de las partculas, porosidad y tamao de los poros.
La difusin en los poros depende del dimetro y longitud del poro, y
de las caractersticas de las molculas que difunden.
Reaccin en la superficie (4, 5 y
6)
Composicin del slido y del fluido, De las caractersticas del slido
(concentracin de defectos puntuales, tamao de grano, impurezas,
etc. De la presin y temperatura, y de la afinidad qumica de A y B).
Escribiendo en general, las reacciones del tipo 1 y 2, de la
forma siguiente:
Mineral + A(l) M(l) + P(l) (reaccin del tipo 1)
Mineral + A(l) M(l) + P(l) + S(s) (reaccin del tipo 2)
donde A representa el reactivo lixiviante, M es la especie de
valor en solucin, P otro producto cualquiera en solucin y S
el producto slido.
Esquemticamente se tiene:
Para reaccin del Tipo 1.-
Figura: Esquema de una reaccin de lixiviacin del
tipo 1, con disolucin completa del mineral.
MINERAL
SOLUCION
[A]s
[A]b
[M]s
[P]s
[M]b
[P]b
a) Para este caso la etapa controlante de la reaccin puede ser una
o una combinacin de las siguientes:
b) Transferencia del reactivo A desde el seno de la solucin hacia
la superficie del mineral.
c) Reaccin del reactivo A en la interfase para formar una especie
soluble.
d) Difusin de la especie metlica soluble M, u otros productos P,
hacia el seno de la solucin.
Para Reaccin del Tipo 2.-
Producto
slido
poroso
Mineral
[A]s
[A]
[A]b
[M]s
[M]
[M]b
[P]s
[P]
[P]b
Figura: Esquema de una reaccin del tipo 2, con
formacin de capa residuo poroso.
Para este caso existen 2 posibilidades:
Difusin del reactivo A a travs de la capa slida
producida por la reaccin (producto poroso)
Difusin de la especie soluble M u otro producto P a
travs de la capa slida formada, hacia el seno de la
solucin
Podemos concluir lo siguiente:
1.- Velocidad de reaccin rea superficial
> velocidad de reaccin < tamao de partculas
2.- Las etapas a) y b) son procesos de difusin en film
lquido y pueden ser descritos por las siguientes ecuaciones:
JA = - DA ||A|b - |A|s| (*)
oA
JM = DM ||M|s - |M|b| (**)
oM
en donde:
JA y JM = flujos en moles /cm
2
seg
DA y DM = coeficientes de difusin, cm
2
/seg
|A|b y |A|s = concentraciones respectivas en el seno de la solucin y en
la interfase mineral/solucin, mol/cm
3
oA y oM = espesor del film lquido en la que se tiene un gradiente lineal
de concentracin, cm.
JA y JM estn relacionados por la estequiometra de la reaccin
Valores de oA y oM pueden no ser iguales y estn determinados por el
transporte en la fase acuosa.
< Flujo difusivo < o aumentando la agitacin
Por lo tanto en procesos controlado por transferencia de masa la velocidad de
reaccin aumenta al aumentar la agitacin.
Industrialmente Lix. Por Agitacin
Optimizar agitacin
Potencia de mezcla del equipo
Estudiando diseo reactor
Lix. por Percolacin aumentar el flujo de las soluciones
3.- Tambin para aumentar velocidad de reaccin, bajo control por transferencia
o difusin homognea aumentar concentracin de reactivo
JA |A|b
Pero puede cambiar el control por transferencia a control qumico, ya que:
Velocidad de Difusin > Velocidad de Reaccin Qumica
Ej. Lixiviacin amoniacal de minerales de cobre y zinc.
4.- Bajo control solo difusional |M|s = solubilidad del metal
Mxima Concentracin del elemento en solucin a la T del
sistema
A dicho valor la disolucin se detiene temporalmente, hasta que
por difusin de los iones, se produce una disminucin de la
concentracin (evitando problemas de saturacin y/o
precipitacin in situ)
Adecuada agitacin
5.- En la etapa 2 (reaccin en la interfase) se consideran las
subetapas siguientes:
Adsorcin de los reactivos en la superficie
Reaccin propiamente tal
Adsorcin de las especies disueltas.
Adsorcin es dependiente de la concentracin de reactivos pero no de
la agitacin.
Adsorcin y reaccin son difciles de aislar, por lo tanto la velocidad no
depende solo de la solucin, si no ms bien de las caractersticas del
slido, tales como:
Concentracin de defectos puntuales
Dislocaciones
Tamao de grano
Contenido de impurezas, etc.
Existen ataques preferenciales, dando lugar a fenmenos de
picado (pittings), ataque de lmites de grano, rupturas de la
partcula, ataque en planos cristalinos seleccionados o efectos
galvnicos en los cuales las partculas de mineral interactan
electroqumicamente para acelerar la disolucin de un mineral
y retardar la de otros.
6.- Al formarse residuos slidos porosos como producto de reaccin,
normalmente la etapa determinante es la difusin a travs de la
fase acuosa contenida en el material poroso.
A mayor material poroso, disminuye la velocidad de lixiviacin.
DIFUSION.-
Difusin en Fase Homognea ms comn en hidrometalrgia.
Difusin = Proceso que tiende a igualar concentraciones
dentro de una fase. El potencial que provoca la difusin es
el gradiente de concentracin dentro de la fase.
1 Ley de Fick.-
Relaciona la cantidad de material que difunde por unidad
de tiempo en una direccin perpendicular a un plano de
referencia de rea unitaria, con la concentracin c, la
coordenada de posicin x (medida perpendicularmente al
plano de referencia), y con el coeficiente de difusin.
J = - Doc si c = moles/cm3 D = cm2/seg y J =moles/seg
ox
Tambin puede expresarse como J = 1 dn
A dt
Donde n = moles ; t es el tiempo; A rea del plano de referencia
Expresin general para 1 Ley de Fick
dn = - D A oc
dt ox
signo negativo indica disminucin de n con el tiempo
si J es constante e integrando 1 dn = - D Ac
A dt Ax
Definiendo el coeficiente de transferencia de masa como hm = D/Ax
Se llega a dn = - A hm Ac
dt
Expresin general para la ley de Fick en trminos de coeficiente de
transferencia de masa hm.
Normalmente en los sistemas hidrometalrgicos se considera
el Coeficiente de difusin constante e independiente de la
concentracin.
En procesos de disolucin o precipitacin de un slido, la
difusin a travs de una zona adyacente a la interfase slido
lquido puede ser controlante de la velocidad.
En condiciones de agitacin constante, el espesor de la zona
adyacente tambin permanece constante, obtenindose una
condicin de estado estacionario, donde lo que entra es igual
a lo que sales.
En la figura siguiente se representa lo dicho anteriormente.
Capa de difusin solucin total
Cb
Slido flujo entrando
concentracin
Cs Ax
Cs
Flujo saliendo
Cb
Distancia
Figura: Capa de difusin en una interfase slido lquido al estado estacionario
Cb - Cs = - J difusin hacia la superficie
Ax D
donde Cb es la concentracin en el seno de la solucin y
Cs es la concentracin en la superficie del slido
Anlogamente
Cb - Cs = J difusin desde la superficie
Ax D
Es posible eliminar la agitacin como variables en un estudio
cintico, si sta es suficientemente enrgica. Sin embargo, la
eliminacin de la agitacin como variables no asegura que la
difusin no sea el paso controlante de la reaccin..
Difusin
Velocidad reaccin superficial o
De condicin lmite
Agitacin de difusin en el film
Velocidad de Reaccin
Experimentalmente y tericamente se encuentra que el espesor de esta
capa lmite de difusin es del orden de 10-3 cm, en condiciones de
agitacin violenta.
Con dicho valor se ha demostrado que la mxima
velocidad que se puede obtener para una reaccin
controlada por difusin en la interfase slido lquido
es aproximadamente 0.1 moles/cm2 h, cuando la
concentracin en el seno de la solucin es 1 M.
Los Coeficientes de difusin dependen de la naturaleza
de las especies que difunden y la T.
En soluciones acuosas D tiene valores entre 0.3 y 3.5
*10-5 cm2/seg, a T ambiente.
DIFUSIN A TRAVES DE UN PRODUCTO.-
Para procesos heterogneos, la difusin a travs de la capa
de slido formado sobre el ncleo reaccionante y/o a travs
de la capa de partculas es un factor importante.
La complejidad del problema depende del tamao de los
poros de slido que reacciona o del residuo slido que se va
formando como producto de la reaccin.
Para poros grandes, que es el caso que interesa en
sistemas hidrometalrgicos, es vlida la ley de Fick:
dn = - Df A dc
dt dx
Donde
c= concentracin en la solucin
Df = coeficiente de difusin efectivo Df = D*E / t
Con D = coeficiente de difusin en la solucin
E = porosidad de la capa de producto
t = tortuosidad de la capa de proyecto
El valor de E es relativamente fcil de determinar, no as el de t,
el que generalmente flucta entre 2 y 10.
REACCION EN LA SUPERFICIE.-
Reaccin en la interfase puede ser parcial o completamente
determinante de la velocidad.
Para el caso de reaccin tipo 2:
a|A| + <B> r| R| + s <S>
la velocidad de reaccin para A y el slido B se puede escribir como:
rA = a rB = - a kr CmACBn (11)
donde
a = factor de estequiometra de la reaccin
m y n = ordenes de reaccin respectivas
kr = constante especfica de velocidad de reaccin
(incluido el rea de reaccin)
Normalmente, el orden de reaccin para los slidos es = 0 y
cercano a 1 para el reactivo
rA = a kr CA
El orden de reaccin es estrictamente una magnitud
experimental que depende de la forma en que la velocidad
se relaciona con la concentracin del o de los reactivos.
Expresando la velocidad de reaccin en funcin de una
potencia, se tiene:
r = k CAoCB| .....
y se dice que es de orden o respecto de A y de orden
| respecto de B, respectivamente.
El orden total de la reaccin ser:
n = o + | + .......
Para una reaccin de 1 orden, se tiene que r = mol/cm2 seg c = mol/cm3
k = cm/seg
Velocidad de reaccin puede representar un valor numrico
diferente, segn la manera como se defina y mida.
Ejemplo: A + 3B 2C
rC = dc = - 2dA = 2 rA
dt dt
y tambin rB = dB = - 3 dA = 3 rA
dt dt
velocidad de formacin de C = 2 velocidad de desaparicin de A
y velocidad de desaparicin de B = 3 velocidad de desaparicin de A
En hidrometalurgia, lo ms usado es representar c v/s t, se
trazan las pendientes para los inicios de la reaccin y se
comparan estas directamente con la ecuacin cintica.
Si una reaccin es de un cierto orden n
r = k Cn o bien
Log r = log k + n log C
Al determinar la velocidad para distintas concentraciones de
reactivo, la representacin grfica del log r v/s log C, debe dar
una lnea recta. En esta caso la pendiente representa el orden
de reaccin respecto al reactivo cuya concentracin va variando,
y la interseccin con el eje correspondiente a log r representa
log k.
Este mtodo puede aplicarse de dos maneras:
1.- Se miden las concentraciones para tiempos iniciales, para lo cual
se emplean distintas concentraciones iniciales de reactivo.
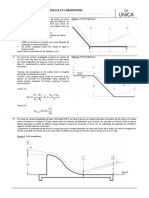
En la figura siguiente se representa esquemticamente este mtodo.
Conc. Log r
del
Reacti
vo
Pendiente
Log k
Tiempo Log C
b) Se representa el logaritmo de la velocidad en
funcin del de la concentracin.
a) Representan los resultados de una sola medida cintica;
se han trazado las pendientes correspondientes a diversas
concentraciones de reactivo.
2.- Se emplea una sola curva correspondiente a una
concentracin inicial definida de reactivo y se miden las
pendientes a diversos tiempos, lo cual corresponde a varios
valores de la concentracin de reactivo.
Conc. Log r
del
Reacti
vo
Pendiente
Log k
Tiempo Log C
b) Representa la concentracin en funcin del
tiempo para diversas concentraciones
iniciales.
b) Se representa los logaritmos de las
pendientes iniciales en funcin de los
logaritmos de las concentraciones iniciales
correspondientes.
Lo anterior puede repetirse para diferentes
temperaturas.
Un grfico de log k v/s 1/T servir para determinar
la energa de activacin del sistema, mtodo
ampliamente utilizado para determinar la etapa
controlante de una reaccin.
Das könnte Ihnen auch gefallen
- Por Una TecnoeticaDokument6 SeitenPor Una TecnoeticaMartin CastellNoch keine Bewertungen
- Guía Básica para Elaborar Un Ensayo Académico Académico.Dokument11 SeitenGuía Básica para Elaborar Un Ensayo Académico Académico.einnerlink100% (1)
- Etica y Moral ProfesionalDokument8 SeitenEtica y Moral Profesionalhitman177Noch keine Bewertungen
- Hidrometalurgia5 1Dokument66 SeitenHidrometalurgia5 1carloto244100% (1)
- Hidrometalurgia 3.4Dokument4 SeitenHidrometalurgia 3.4carloto244Noch keine Bewertungen
- El Ingeniero Frente A La Etica y La TecnicaDokument8 SeitenEl Ingeniero Frente A La Etica y La TecnicaErlin NevadoNoch keine Bewertungen
- Hidrometalurgia 3.1Dokument3 SeitenHidrometalurgia 3.1carloto244Noch keine Bewertungen
- Mapa ConceptualDokument1 SeiteMapa Conceptualcarloto244Noch keine Bewertungen
- Hidrometalurgia 3.3Dokument10 SeitenHidrometalurgia 3.3carloto244Noch keine Bewertungen
- Etica Moral y DerechoDokument14 SeitenEtica Moral y DerechoRobert BrittNoch keine Bewertungen
- Los MormonesDokument11 SeitenLos Mormonescarloto244Noch keine Bewertungen
- Etica Moral y DerechoDokument14 SeitenEtica Moral y DerechoRobert BrittNoch keine Bewertungen
- Cap9a - Fundamentos de EquiposDokument7 SeitenCap9a - Fundamentos de Equiposcarloto244Noch keine Bewertungen
- REACTORESDokument5 SeitenREACTORESGrecia Alejandra Ramirez RicoNoch keine Bewertungen
- Practico Estequiometria 2Dokument6 SeitenPractico Estequiometria 2ailèn camejoNoch keine Bewertungen
- 04 01 Formato 13 - Cuadro Resumen Propuesta Economica - CivilDokument104 Seiten04 01 Formato 13 - Cuadro Resumen Propuesta Economica - CivilRogelio CuroNoch keine Bewertungen
- Tubería sanitaria y alcantarillado precios 2021Dokument21 SeitenTubería sanitaria y alcantarillado precios 2021Manuel Calderon CortesNoch keine Bewertungen
- Quim. San Marcos SM13Dokument4 SeitenQuim. San Marcos SM13Héctor Freddy Diaz MoscolNoch keine Bewertungen
- Flujo laminar y turbulentoDokument5 SeitenFlujo laminar y turbulentoStefany GomezNoch keine Bewertungen
- Ejercicio Tipo 1. 181610, 181735Dokument38 SeitenEjercicio Tipo 1. 181610, 181735Natalia MeloNoch keine Bewertungen
- Medios FiltrantesDokument7 SeitenMedios FiltrantesJorge Jhonatan López CamposNoch keine Bewertungen
- Bombas Centrifugas - Angulo PDFDokument7 SeitenBombas Centrifugas - Angulo PDFCristian Alberto Angulo ParraNoch keine Bewertungen
- Proyecto de Edificación de 2 Niveles Con AzoteaDokument20 SeitenProyecto de Edificación de 2 Niveles Con AzoteaJhon Cruz PaucarNoch keine Bewertungen
- Examen 2 SábadoDokument2 SeitenExamen 2 Sábadokebler kevNoch keine Bewertungen
- Caso Estudio Actividad 2Dokument11 SeitenCaso Estudio Actividad 2LINA SOFIA SOLIS QUINTERONoch keine Bewertungen
- Ejercicios Reactores 2019-2020Dokument11 SeitenEjercicios Reactores 2019-2020Luisa BolañosNoch keine Bewertungen
- Guia+1 OPU 2020Dokument3 SeitenGuia+1 OPU 2020miguelNoch keine Bewertungen
- Metrado Ptar - Tanque Septico Nº1Dokument26 SeitenMetrado Ptar - Tanque Septico Nº1Gabriel Armando Vilchez MArtinezNoch keine Bewertungen
- Filtración QuímicaDokument2 SeitenFiltración QuímicajocolatekNoch keine Bewertungen
- Semana 2 Sesión 1 Ley de Newton ViscosdiadDokument33 SeitenSemana 2 Sesión 1 Ley de Newton ViscosdiadJoyce Perez SeguraNoch keine Bewertungen
- Guia Panasonic PDFDokument54 SeitenGuia Panasonic PDFCeci RoNoch keine Bewertungen
- 2018 - 0 2 Pràctica Calificada - FluidoDokument12 Seiten2018 - 0 2 Pràctica Calificada - FluidoOdar GarciaNoch keine Bewertungen
- 1.3 - Sistema de Alcantarillado - ALT - 01Dokument65 Seiten1.3 - Sistema de Alcantarillado - ALT - 01Manuel Alejandro Chinga RosilloNoch keine Bewertungen
- EJERCICIOSDokument7 SeitenEJERCICIOSAna RamirezNoch keine Bewertungen
- Curva de Duración de CaudalesDokument11 SeitenCurva de Duración de CaudalesEsthefany AndradeNoch keine Bewertungen
- Capítulo 2 - TermodinamicaDokument48 SeitenCapítulo 2 - Termodinamicaestefani cuellar mendozaNoch keine Bewertungen
- Planes de Estudio VigentesDokument2 SeitenPlanes de Estudio Vigenteslabnerhr5288Noch keine Bewertungen
- Transferencia de MasaDokument6 SeitenTransferencia de Masaalc112Noch keine Bewertungen
- Conductividad TérmicaDokument7 SeitenConductividad TérmicaYerlin MedinaNoch keine Bewertungen
- Ingeniero químico con experiencia en tratamiento de aguaDokument6 SeitenIngeniero químico con experiencia en tratamiento de aguaAlexander Jacobo Llaro0% (1)
- Hoja de Presentacion UvDokument20 SeitenHoja de Presentacion UvAlfredo ZuñigaNoch keine Bewertungen
- Grados de LibertadDokument3 SeitenGrados de LibertadMari SalasNoch keine Bewertungen