Beruflich Dokumente
Kultur Dokumente
Combustibles Solidos
Hochgeladen von
Veronica Anahi Zepeda0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
4 Ansichten9 SeitenQuimica
Copyright
© © All Rights Reserved
Verfügbare Formate
PPTX, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenQuimica
Copyright:
© All Rights Reserved
Verfügbare Formate
Als PPTX, PDF, TXT herunterladen oder online auf Scribd lesen
0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
4 Ansichten9 SeitenCombustibles Solidos
Hochgeladen von
Veronica Anahi ZepedaQuimica
Copyright:
© All Rights Reserved
Verfügbare Formate
Als PPTX, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 9
CALOR & TEMPERATURA
Es la transferencia de energa desde un cuerpo que se encuentra a mayor
temperatura hasta otro de menor temperatura.
Cuando ambos cuerpos igualan sus temperaturas se detiene la transmisin
de energa.
El calor se mide en unidades de energa. Por tanto, en el Sistema
Internacional su unidad es el julio (J). Sin embargo, la unidad tradicional para
medir el calor es la caloria (cal). La equivalencia es:
1 cal = 4,184 J 1 J = 0,24 cal
La transmisin de calor siempre ocurre desde el cuerpo ms caliente al ms
fro. Se puede dar por tres mecanismos: Conduccin, conveccin y radiacin.
El proceso por el que se transmite calor de un punto a otro de un slido se
llama Conduccin.
El calor es el proceso de transferencia de energa entre diferentes cuerpos o
diferentes zonas de un mismo cuerpo que se encuentran a distintas
temperaturas. Este flujo siempre ocurre desde el cuerpo de mayor
temperatura hacia el cuerpo de menor temperatura, ocurriendo la
transferencia hasta que ambos cuerpos se encuentren en equilibrio trmico
(ejemplo: una bebida fra dejada en una habitacin se entibia).
CALOR & TEMPERATURA
El calor especfico es la energa necesaria para elevar 1 C la temperatura de un gramo de materia. El concepto de capacidad
calorfica es anlogo al anterior pero para una masa de un mol de sustancia (en este caso es necesario conocer la estructura
qumica de la misma).
El calor especfico de un material depende de su temperatura; no obstante, en muchos procesos termodinmicos su variacin
es tan pequea que puede considerarse que el calor especfico es constante. Asimismo, tambin se diferencia del proceso que
se lleve a cabo, distinguindose especialmente el "calor especfico a presin constante" (en un proceso isobrico) y "calor
especfico a volumen constante (en un proceso isocrico).
De esta forma, y recordando la definicin de calora, se tiene que el calor especfico del agua es aproximadamente:
Calor especfico molar; El calor especfico de una sustancia es un ndice importante de su constitucin molecular interna, y a
menudo da informacin valiosa de los detalles de su ordenacin molecular y de las fuerzas intermoleculares. En este sentido,
con frecuencia es muy til hablar de calor especfico molar denotado por cm, y definido como la cantidad de energa necesaria
para elevar la temperatura de un mol de una sustancia en 1 grado es decir, est definida por:
donde n indica la cantidad de moles en la sustancia presente.
Capacidad calorfica: La capacidad calorfica de una sustancia es una magnitud que indica la mayor o menor dificultad que
presenta dicha sustancia para experimentar cambios de temperatura bajo el suministro de calor. Se denota por , se acostumbra
a medir en J/K, y se define como: De igual forma se puede definir la capacidad calrica molar como:
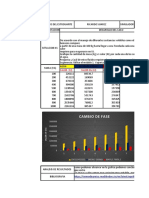
Cambios de fase;
de estado slido a lquido, llamado fusin,
de estado lquido a slido, llamado solidificacin,
de estado lquido a gaseoso, llamado evaporacin o vaporizacin,
de estado gaseoso a lquido, llamado condensacin
de estado slido a gaseoso, llamado sublimacin progresiva,
de estado gaseoso a slido, llamado sublimacin regresiva o deposicin,
de estado gaseoso a plasma, llamado ionizacin.
TEMPERATURA
La temperatura es una magnitud referida a las nociones comunes de caliente, tibio, fro que puede ser
medida, especficamente, con un termmetro. En fsica, se define como una magnitud escalar
relacionada con la energa interna de un sistema termodinmico, definida por el principio cero de la
termodinmica.
Ms especficamente, est relacionada directamente con la parte de la energa interna conocida como
energa cintica, que es la energa asociada a los movimientos de las partculas del sistema, sea en
un sentido traslacional, rotacional, o en forma de vibraciones.
A medida de que sea mayor la energa cintica de un sistema, se observa que ste se encuentra ms
caliente; es decir, que su temperatura es mayor.
En el caso de un slido, los movimientos en cuestin resultan ser las vibraciones de las partculas en
sus sitios dentro del slido. En el caso de un gas ideal monoatmico se trata de los movimientos
traslacionales de sus partculas (para los gases multiatmicos los movimientos rotacional y vibracional
deben tomarse en cuenta tambin).
El desarrollo de tcnicas para la medicin de la temperatura ha pasado por un largo proceso histrico,
ya que es necesario darle un valor numrico a una idea intuitiva como es lo fro o lo caliente.
Multitud de propiedades fisicoqumicas de los materiales o las sustancias varan en funcin de la
temperatura a la que se encuentren, como por ejemplo su estado (slido, lquido, gaseoso, plasma, su
volumen, la solubilidad, la presin de vapor, su color o la conductividad elctrica. As mismo es uno de
los factores que influyen en la velocidad a la que tienen lugar las reacciones qumicas.
La temperatura se mide con termmetros, los cuales pueden ser calibrados de acuerdo a una multitud
de escalas que dan lugar a unidades de medicin de la temperatura.
REACCIONES EXOTERMICAS
El prefijo exo significa hacia fuera. Por lo tanto entendemos que las
reacciones exotrmicas son aquellas que liberan energa en forma de calor.
El esquema general de una reaccin exotrmica puede ser escrito de la manera
siguiente, donde A, B, C y D representan sustancias genricas.
A partir de la Ley de la Conservacin de Energa, podemos afirmar que La
energa total de los reactivos es igual a la energa total de los productos.
En otras palabras, toda la energa que entr en el primer miembro de la
ecuacin qumica, debe salir ntegramente en el segundo miembro de la
ecuacin.
De donde obtenemos la siguiente conclusin: si una reaccin es exotrmica,
entonces la entalpa de los reactivos (Hr ) es mayor que la entalpa de los
productos(Hp ), pues una parte de la energa que estaba contenida en los
reactivos fue liberada para el medio ambiente en forma de calor y apenas otra
parte de esa energa qued contenida en los productos. Entonces en una
reaccin exotrmica: Hr > Hp
No es posible determinar directamente la entalpa de cada sustancia
participante de una reaccin, pero podemos determinar experimentalmente la
variacin de entalpa H, que ocurre cuando una reaccin qumica es realizada.
Como en la reaccin exotrmica Hr > Hp , entonces en este tipo de reaccin el
valor de H ser siempre negativo. Siendo que la reaccin exotrmica: H >
0.
Observa que no existe energa negativa; un sistema contiene energa. El signo
negativo de DH quiere decir apenas que la energa fue liberada.
REACCIONES ENDOTERMICAS
El prefijo endo significa hacia adentro. Por lo tanto se entiende que las reacciones endotrmicas son aquellas que
absorben energa en forma de calor.
El esquema general de una reaccin endotrmica puede ser escrito de la siguiente manera, donde A, B, C y D
representan sustancias genricas.
Una vez que la energa total se conserva del primer para el segundo miembro de cualquier reaccin qumica,
podemos afirmar que:
si una reaccin es endotrmica, la entalpa de los productos Hp es mayor que la entalpa de los reactivos Hr , pues
una determinada cantidad de energa fue absorbida por los reactivos en forma de calor, durante la reaccin,
quedando contenida en los productos. Siendo que en la reaccin endotrmica: Hp > Hr.
Y siendo DH = Hp Hr , entonces en la reaccin endotrmica el valor de H ser siempre positivo. Siendo que en la
reaccin endotrmica: H > 0. Las reacciones endotrmicas suelen estar asociadas a la disociacin de las molculas.
Esto ltimo puede medirse por el incremento de la entropa del sistema. El efecto neto de la tendencia a formar
enlaces fuertes y la tendencia de las molculas e iones a disociarse se puede medir por el cambio en la energa libre
del sistema.
Todo cambio espontneo a temperatura y presin constantes implica un incremento de la energa libre, acompaado
de un aumento de la fuerza del enlace.
Una reaccin qumica es el proceso en el que una o ms sustancias se transforman en otras sustancias diferentes
los productos de la reaccin. Un ejemplo de reaccin qumica es la formacin de xido de hierro producida al
reaccionar el oxgeno del aire con el hierro.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la
reaccin qumica.
No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar segn cambien las
condiciones, determinadas cantidades permanecen constantes en cualquier reaccin qumica. Estas cantidades
constantes, que reciben el nombre de magnitudes conservadas, incluyen el nmero de cada tipo de tomo presente,
la carga elctrica y la masa total.
CALORES DE REACCIN
Una gran cantidad de las industrias qumicas utilizan ampliamente la transferencia de calor en sus procesos. Si bien es cierto
que la Termoqumica establece las bases tericas del manejo del calor como una forma de la energa en las reacciones
qumicas, desde el punto de vista experimental, la calorimetra nos permite saber calor como una forma de la energa absorbida
o desprendida est presente en una reaccin, lo cual resulta de particular importancia.
Determinar esta energa absorbida o desprendida en una reaccin es posible bajo dos condiciones termodinmicas; ya sea a
presin constante, o a volumen constante.
Para determinar en un calormetro, la energa absorbida o desprendida de una reaccin como es el caso particular del calor de
descomposicin del perxido de hidrgeno, es conveniente primero que todo, plantear una ecuacin del balance general de
calor en el sistema.
En esta ecuacin es necesario distinguir, quin gana energa en el sistema y quin la cede. En un caso general que nos
planteara cualquier proyecto experimental, "la reaccin de descomposicin", sera de la forma:
AB (ac) A (ac) + B (ac) + Q descomposicin (2)
notamos que al descomponerse el compuesto AB; es esta reaccin la que cede el calor, y por lo tanto la ecuacin (1) se
transforma en:
ahora, si analizamos "Qganado" ste debe corresponder a la cantidad de calor que absorbe el calormetro y el agua contenida en
donde se agrega "AB", para realizar la reaccin de descomposicin, por lo tanto tenemos que.
Si el proceso se realiza a "P = cte." entonces:
Aqu los valores de "m Cp" podemos definirlos como la constante del calormetro, que es la cantidad de calor que absorbe el
calormetro, cuando se incrementa la temperatura (T).
El trmino siguiente corresponde al calor que absorbe el agua cuando se incrementa la temperatura de la misma. Por lo tanto la
ecuacin (4) se transforma en la ecuacin (6), y que nos permite determinar el calor de la reaccin de descomposicin del
compuesto "AB".
LEYES DE LA TERMODINAMICA
Primera ley de la termodinmica
Tambin conocida como principio de conservacin de la energa para la termodinmica en realidad el primer
principio dice ms que una ley de conservacin, establece que si se realiza trabajo sobre un sistema o bien ste
intercambia calor con otro, la energa interna del sistema cambiar.
En palabras llanas: "La energa ni se crea ni se destruye: Solo se transforma".
Visto de otra forma, esta ley permite definir el calor como la energa necesaria que debe intercambiar el sistema para
compensar las diferencias entre trabajo y energa interna.
Fue propuesta por Nicolas Lonard Sadi Carnot en 1824, en su obra Reflexiones sobre la potencia motriz del fuego y
sobre las mquinas adecuadas para desarrollar esta potencia, en la que expuso los dos primeros principios de la
termodinmica. Esta obra fue incomprendida por los cientficos de su poca, y ms tarde fue utilizada por Rudolf
Clausius y Lord Kelvin para formular, de una manera matemtica, las bases de la termodinmica.
Segunda ley de la termodinmica
Esta ley marca la direccin en la que deben llevarse a cabo los procesos termodinmicos y, por lo tanto, la
imposibilidad de que ocurran en el sentido contrario (por ejemplo, que una mancha de tinta dispersada en el agua
pueda volver a concentrarse en un pequeo volumen).
Tambin establece, en algunos casos, la imposibilidad de convertir completamente toda la energa de un tipo en otro
sin prdidas.
De esta forma, la segunda ley impone restricciones para las transferencias de energa que hipotticamente pudieran
llevarse a cabo teniendo en cuenta slo el primer principio.
Esta ley apoya todo su contenido aceptando la existencia de una magnitud fsica llamada entropa, de tal manera
que, para un sistema aislado (que no intercambia materia ni energa con su entorno), la variacin de la entropa
siempre debe ser mayor que cero.
LEYES DE LA TERMODINAMICA
.Tercera ley de la termodinmica
La tercera de las leyes de la termodinmica, propuesta por Walther Nernst, afirma que es imposible alcanzar una
temperatura igual al cero absoluto mediante un nmero finito de procesos fsicos.
Puede formularse tambin como que a medida que un sistema dado se aproxima al cero absoluto, su entropa tiende a un
valor constante especfico. La entropa de los slidos cristalinos puros puede considerarse cero bajo temperaturas iguales
al cero absoluto.
No es una nocin exigida por la termodinmica clsica, as que es probablemente inapropiado tratarlo de ley.
Es importante remarcar que los principios o leyes de la termodinmica son vlidas siempre para los sistemas
macroscpicos, pero inaplicables a nivel microscpico.
La idea del demonio de Maxwell ayuda a comprender los lmites de la segunda ley de la termodinmica jugando con las
propiedades microscpicas de las partculas que componen un gas.
Sistema Se puede definir un sistema como un conjunto de materia, que est limitado por una superficie, que le pone el
observador, real o imaginaria. Si en el sistema no entra ni sale materia, se dice que se trata de un sistema cerrado, o
sistema aislado si no hay intercambio de materia y energa, dependiendo del caso. En la naturaleza, encontrar un sistema
estrictamente aislado es, por lo que sabemos, imposible, pero podemos hacer aproximaciones. Un sistema del que sale y/o
entra materia, recibe el nombre de abierto. Ponemos unos ejemplos:
Un sistema abierto: es cuando existe un intercambio de masa y de energa con los alrededores; es por ejemplo, un
coche. Le echamos combustible y l desprende diferentes gases y calor.
Un sistema cerrado: es cuando no existe un intercambio de masa con el medio circundante, slo se puede dar un
intercambio de energa; un reloj de cuerda, no introducimos ni sacamos materia de l. Solo precisa un aporte de energa
que emplea para medir el tiempo.
Un sistema aislado: es cuando no existe el intercambio ni de masa y energa con los alrededores; Cmo encontrarlo si
no podemos interactuar con l? Sin embargo un termo lleno de comida caliente es una aproximacin, ya que el envase no
permite el intercambio de materia e intenta impedir que la energa (calor) salga de l. El universo es un sistema aislado, ya
que la variacin de energa es cero
PROCESO DE COMBUSTION
La combustin es el conjunto de procesos fsico-qumicos por los cuales se libera controladamente parte de la energa interna del combustible.
Una parte de esa energa se va a a manifestar en forma de calor y es la que a nosotros nos interesa.
La reaccin de un elemento qumico con el oxgeno sabemos que se llama oxidacin. La combustin no es ms que una reaccin de oxidacin,
en la que normalmente se va a liberar una gran cantidad de calor.
Los combustibles tienen en su composicin unos elementos principales, combustibles (C, H, S) y otros no combustibles, como el V, Ni, Na, Si,
El comburente ms habitual usado en la combustin es el aire (21% O, 73% N 2 (inerte)).
Se llama calor de combustin a la disminucin de entalpa de un cuerpo en C/N de presin y a una temperatura definida. Ser entonces el calor
que se libera cuando el combustible arde en una llama o cuando los componentes principales reaccionan con el oxgeno. En la combustin,
cada uno de los componentes combustibles del combustible va a sufrir la reaccin de oxidacin correspondiente.
Reaccin de combustin
Se trata de una reaccin de oxidacin con la particularidad de que se realiza muy rpidamente, es exotrmica. Esta reaccin se produce entre
los elementos combustibles de un combustible y el oxgeno del comburente. Para que un combustible sufra la combustin, es necesario que
alcance su temperatura de ignicin. Se define el punto de ignicin de un combustible como la temperatura a la cual, una vez iniciada la llama,
esta ya no se extingue. Es esta temperatura de 20 a 60C ms alta que la temperatura de inflamacin.
En una reaccin de oxidaccin tendremos Primer Miembro
Combustible: Toda sustancia capaz de arder
Comburente: Sustancia que aporta el oxgeno para que el combustible sufra oxidacin
Los combustibles industriales suelen estar constitudos por mezclas de pocos elementos, ya que esto simplifica en gran medida el proceso. Los
componentes de un combustible se pueden clasificar en: Combustibles
Inertes. Estos hay que eliminarlos y por lo tanto resultan perjudiciales
Fases de la reaccin de combustin
Se pueden distinguir tres fases en la reaccin de combustin:
Fase de prerreaccin (formacin de radicales). Los compuestos hidrocarbonados se descomponen dando lugar a la formacin de radicales, que
son unos compuestos intermedios inestables y muy activos, para que de este modo el carbono y el hidrgeno puedan reaccionar con el
oxgeno.
Fase de Oxidacin: En esta fase se produce la combinacin entre los elementos y el oxgeno. Es una fase muy exotrmica y es cuando tiene
lugar la propagacin de la llama.
Das könnte Ihnen auch gefallen
- Si No Existieran Las TICDokument2 SeitenSi No Existieran Las TICVeronica Anahi ZepedaNoch keine Bewertungen
- CuestionarioDokument1 SeiteCuestionarioVeronica Anahi ZepedaNoch keine Bewertungen
- Espectroscopia Infrarroja PDFDokument35 SeitenEspectroscopia Infrarroja PDFferlogarNoch keine Bewertungen
- Diagrama de Flujo Algo Simplificado de Una Planta de Energía NuclearDokument6 SeitenDiagrama de Flujo Algo Simplificado de Una Planta de Energía NuclearKendy Hernandez100% (1)
- Revista de Simulacion y Laboratorio V3 N9 3Dokument7 SeitenRevista de Simulacion y Laboratorio V3 N9 3Veronica Anahi ZepedaNoch keine Bewertungen
- Articulo 1 PDFDokument15 SeitenArticulo 1 PDFVeronica Anahi ZepedaNoch keine Bewertungen
- 3e008 Estudio de Clasificacion Del Rio Atoyac PDFDokument7 Seiten3e008 Estudio de Clasificacion Del Rio Atoyac PDFVeronica Anahi ZepedaNoch keine Bewertungen
- PlomoDokument16 SeitenPlomoVeronica Anahi ZepedaNoch keine Bewertungen
- Paper de Cromo 6Dokument16 SeitenPaper de Cromo 6eduardohashiroNoch keine Bewertungen
- Fundamentos de Transferencia de Momento, Calor y Masa 5ta Edicion James WeltyDokument802 SeitenFundamentos de Transferencia de Momento, Calor y Masa 5ta Edicion James WeltyBertha Elizabeth Cervantes Pérez93% (102)
- TP0150 Grasas Aceites MetodoSoxhletDokument8 SeitenTP0150 Grasas Aceites MetodoSoxhletLizethe Rincon CarbonariaNoch keine Bewertungen
- Adsorcion de Cromo VIDokument3 SeitenAdsorcion de Cromo VIVeronica Anahi ZepedaNoch keine Bewertungen
- AtoyacDokument7 SeitenAtoyacVeronica Anahi ZepedaNoch keine Bewertungen
- Art Ambiental Cromo PDFDokument94 SeitenArt Ambiental Cromo PDFVeronica Anahi ZepedaNoch keine Bewertungen
- Absorcion de Cromo Con YucaDokument2 SeitenAbsorcion de Cromo Con YucaVeronica Anahi ZepedaNoch keine Bewertungen
- Adsorcion de Cromo VIDokument3 SeitenAdsorcion de Cromo VIVeronica Anahi ZepedaNoch keine Bewertungen
- 8388-Texto Del Artículo-11890-1-10-20130402Dokument56 Seiten8388-Texto Del Artículo-11890-1-10-20130402Veronica Anahi ZepedaNoch keine Bewertungen
- Redaccinartculocientfico 120902164729 Phpapp01Dokument14 SeitenRedaccinartculocientfico 120902164729 Phpapp01Roshelve Mendoza PimentelNoch keine Bewertungen
- Métodos iterativos para resolver ecuaciones de una variable: Método de Newton-Raphson, método de la bisección y método de la secanteDokument10 SeitenMétodos iterativos para resolver ecuaciones de una variable: Método de Newton-Raphson, método de la bisección y método de la secantekameiNoch keine Bewertungen
- 8388 11890 1 PBDokument14 Seiten8388 11890 1 PBDaniel Pulido RojasNoch keine Bewertungen
- Problema 1 Cheang-SimulaciónDokument11 SeitenProblema 1 Cheang-SimulaciónJoHn FLacco100% (2)
- Desventajas FlujoDokument3 SeitenDesventajas FlujoVeronica Anahi ZepedaNoch keine Bewertungen
- Propiedades Del AceroDokument2 SeitenPropiedades Del AceroVeronica Anahi ZepedaNoch keine Bewertungen
- 1083802048.transferencia Interfacial de MasaDokument34 Seiten1083802048.transferencia Interfacial de MasaEnrique SoriaNoch keine Bewertungen
- Evaporadores, Condesadores y TuberiasDokument42 SeitenEvaporadores, Condesadores y TuberiasGustavo Rafael Hernandez SandovalNoch keine Bewertungen
- FTM Clase 21 Transporte de Masa 4Dokument22 SeitenFTM Clase 21 Transporte de Masa 4Jonathan Alexis Quiroga MolinaNoch keine Bewertungen
- El Tutorial de PythonDokument116 SeitenEl Tutorial de PythonCarlos HernandezNoch keine Bewertungen
- Tutorial Python 3Dokument111 SeitenTutorial Python 3Jose Antonio Gonzalez TrianaNoch keine Bewertungen
- CUESTIONARIODokument2 SeitenCUESTIONARIOVeronica Anahi ZepedaNoch keine Bewertungen
- 33 NanodiamantesDokument7 Seiten33 NanodiamantespanchopanzaNoch keine Bewertungen
- Introducción a los procesos de separación por destilaciónDokument4 SeitenIntroducción a los procesos de separación por destilaciónXanath PotNoch keine Bewertungen
- Semana 4 Quimica-1Dokument2 SeitenSemana 4 Quimica-1Paola Londoño OliveraNoch keine Bewertungen
- Cristalización Con Carbón Activado y en Par de DisolventesDokument9 SeitenCristalización Con Carbón Activado y en Par de DisolventesTopse Pop de CerezzaNoch keine Bewertungen
- Movimiento Circular (Versión 1.0)Dokument29 SeitenMovimiento Circular (Versión 1.0)Narmin0% (1)
- Planta de Tratamiento de Aguas ResidualesDokument26 SeitenPlanta de Tratamiento de Aguas ResidualesHayde MauricioNoch keine Bewertungen
- Minerales 2Dokument41 SeitenMinerales 2Alan moránNoch keine Bewertungen
- InformeDokument8 SeitenInformejessica elizabeth l.cNoch keine Bewertungen
- Análisis de LubricantesDokument62 SeitenAnálisis de LubricantesRepositorio Mantenimiento100% (5)
- Lab de BiogasDokument10 SeitenLab de BiogasANGELA LNoch keine Bewertungen
- Apunte Unidad 5.4. Produccion Sosa CloroDokument9 SeitenApunte Unidad 5.4. Produccion Sosa CloroMonserrat LópezNoch keine Bewertungen
- Medicion de La GravedadDokument6 SeitenMedicion de La Gravedadjairo3584Noch keine Bewertungen
- Cap 5 Transform Primaria de Refinacion RDP1Q8Dokument28 SeitenCap 5 Transform Primaria de Refinacion RDP1Q8NatalyNoch keine Bewertungen
- Alcanos Normales FDokument4 SeitenAlcanos Normales FBruno JacoboNoch keine Bewertungen
- SDokument37 SeitenSivanchukNoch keine Bewertungen
- Tema 6 Flujo CompresibleDokument26 SeitenTema 6 Flujo Compresiblepedro aguilarNoch keine Bewertungen
- Cálculo de áreas y volúmenes de reservorios petrolerosDokument15 SeitenCálculo de áreas y volúmenes de reservorios petrolerosYohana SaucedoNoch keine Bewertungen
- Esmaltes CeramicosDokument0 SeitenEsmaltes CeramicosEdward Napanga Zenteno100% (1)
- Filtracion de AireDokument1 SeiteFiltracion de AireMarcel ParedesNoch keine Bewertungen
- Junker FIME UNACDokument9 SeitenJunker FIME UNACEdwin L. MedinaNoch keine Bewertungen
- HEURÍSTICAS PARA INTERCAMBIADORES DE CALORDokument2 SeitenHEURÍSTICAS PARA INTERCAMBIADORES DE CALORRosalia Pacheco CastroNoch keine Bewertungen
- Separaciones físicas en química generalDokument6 SeitenSeparaciones físicas en química generalDAYANNA KASSANDRA VALVERDE RODRIGUEZNoch keine Bewertungen
- Resumen EnergiaDokument3 SeitenResumen EnergiaAlan RothNoch keine Bewertungen
- U N A M: Niversidad Acional Utónoma DE ÉxicoDokument8 SeitenU N A M: Niversidad Acional Utónoma DE ÉxicoErick TrejoNoch keine Bewertungen
- Materia de TermoquímicaDokument6 SeitenMateria de TermoquímicahugoNoch keine Bewertungen
- Origen y Evolución de La Protección RadiológicaDokument7 SeitenOrigen y Evolución de La Protección Radiológicasamuebeard50% (2)
- Ejemplos de Curvas de Nivel IsotermicasDokument3 SeitenEjemplos de Curvas de Nivel IsotermicasJuan David'sNoch keine Bewertungen
- Equipos de La FormalinaDokument13 SeitenEquipos de La FormalinaAndrei Sheldon Raul Garibay ValadezNoch keine Bewertungen
- Los Volcanes y Sus AmenazasDokument7 SeitenLos Volcanes y Sus AmenazasJohannan Rojas33% (3)
- Espuma ViscoelásticaDokument3 SeitenEspuma ViscoelásticaMarco HipolitoNoch keine Bewertungen
- S06.s1Laboratorio 01amplificador de Simetria ComplementariaDokument20 SeitenS06.s1Laboratorio 01amplificador de Simetria ComplementariaDIEGO ESTEFANO PICHIHUA CARRERANoch keine Bewertungen