Beruflich Dokumente
Kultur Dokumente
Potenciómetro
Hochgeladen von
Erick Santos Paez0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
100 Ansichten9 Seitenpresentación power point sobre el uso del potenciómetro
Copyright
© © All Rights Reserved
Verfügbare Formate
PPTX, PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenpresentación power point sobre el uso del potenciómetro
Copyright:
© All Rights Reserved
Verfügbare Formate
Als PPTX, PDF, TXT herunterladen oder online auf Scribd lesen
0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
100 Ansichten9 SeitenPotenciómetro
Hochgeladen von
Erick Santos Paezpresentación power point sobre el uso del potenciómetro
Copyright:
© All Rights Reserved
Verfügbare Formate
Als PPTX, PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 9
Fundamento del pHmetro
• La medición de pH se fundamente en el potencial eléctrico que existe
entre dos electrodos, uno que contenga un electrodo de referencia y
el de medición, sumergidos en una solución que contenga iones
hidronio.
Potencial de asimetría y la calibración
• El potencial de asimetría es un pequeño potencial a través de la
membrana que está presente incluso cuando las soluciones a ambos
lados de ésta son idénticas.
• Cambia lentamente con el tiempo, en especial si se permite que se
reseque la membrana, y se desconoce. Por esta razón, un electrodo
de vidrio para pH se debe calibrar día a día.
Calibración de pH
• Buffer: solución amortiguadora que tiende a mantener el pH constante
cuando se le agrega ácido o alguna base.
• La precisión de las mediciones de pH está regida por la exactitud con la que
se conoce la actividad del ion hidrógeno del amortiguador estándar.
• Solución pH 10, pH 7,0 y pH 4,0
• Se recomienda la calibración con Sol. pH 4,0 para medir muestras ácidas.
• Use Sol. pH 10,0 si las siguientes muestras son alcalinas.
• Si las mediciones de pH se hacen a una temperatura distinta de la
temperatura a la que se hace la estandarización, siendo iguales los demás
factores, el potencial de unión líquida cambiará con la temperatura.
Métodos de medición potenciometrica
• Potenciometría directa, se utiliza principalmente para calcular el pH
de solución acuosa, consiste en hacer una sola medición de potencial
de la celda.
• En la titulación potenciométrica , el ión se puede titular y el potencial
se mide en función del volumen del titulante, es decir, detecta el
punto de equivalencia de una titulación.
• El único requisito es que la reacción incluya un aumento o
disminución de un ión sensible el electrodo.
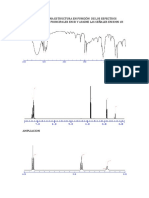
Punto de equivalencia
• Para determinar el punto de equivalencia, podemos utilizar el
potenciómetro, el cual nos permite generar la curva de titulación
potenciométrica de la reacción cuya gráfica resulta de la medición del
pH del sistema contra el volumen de ácido o de base agregados en la
titulación
Ácido fuerte y base fuerte
• El anión del ácido sufre una hidrólisis, por lo que el pH al que ocurre
la neutralización es mayor que 7, ya que todos los iones han sido
neutralizado.
Base fuerte y ácido débil
• El catión de la base sufre una hidrólisis produciéndose iones hidrónio,
por lo que el pH es menor que 7
Fuentes
• http://wwwpotenciometroyphmetro-nicte-cafer.blogspot.com/
• http://ciencia-basica-experimental.net/potenciometria.htm
Das könnte Ihnen auch gefallen
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadVon EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadNoch keine Bewertungen
- Potenciometría y determinación de pHDokument17 SeitenPotenciometría y determinación de pHyeralin elizet crispin jorgeNoch keine Bewertungen
- Componentes Del PotenciometroDokument11 SeitenComponentes Del PotenciometroFabi Almazan MdzaNoch keine Bewertungen
- Componentes Del PotenciometroDokument11 SeitenComponentes Del PotenciometrokjdsvbonervksNoch keine Bewertungen
- PH y Mediciones PotenciometricasDokument21 SeitenPH y Mediciones PotenciometricasAlex91IQ0% (1)
- Potenciometría de neutralizaciónDokument9 SeitenPotenciometría de neutralizaciónJavier GamesrodriguezNoch keine Bewertungen
- Reporte Analisis Practica 1Dokument23 SeitenReporte Analisis Practica 1Darío GarcíaNoch keine Bewertungen
- Determinación constante equilibrio ácido débil USACDokument29 SeitenDeterminación constante equilibrio ácido débil USACCristina MendezNoch keine Bewertungen
- JHFGGHJJKDokument6 SeitenJHFGGHJJKNataly Quevedo100% (1)
- Titulaciones Potenciométricas de NeutralizaciónDokument5 SeitenTitulaciones Potenciométricas de NeutralizaciónRoyer B Damian HuamaniNoch keine Bewertungen
- Laboratorio #9Dokument10 SeitenLaboratorio #9Edward Maidana100% (1)
- Informe #4 Análisis PotenciometricoDokument4 SeitenInforme #4 Análisis PotenciometricoValee MartiinezNoch keine Bewertungen
- Método electrométrico para medir pHDokument8 SeitenMétodo electrométrico para medir pHOperaciones L y LNoch keine Bewertungen
- Protocolo PHDokument3 SeitenProtocolo PHOscar Fernando Contento RubioNoch keine Bewertungen
- Proyecto-Potenciometria QMC 1400Dokument8 SeitenProyecto-Potenciometria QMC 1400Erlan Condori Viricochea100% (1)
- Titulación potenciométrica de ácido débil con base fuerteDokument2 SeitenTitulación potenciométrica de ácido débil con base fuertePedro JesúsNoch keine Bewertungen
- Técnicas PotenciométricasDokument3 SeitenTécnicas PotenciométricasOzkar Gomez MercadoNoch keine Bewertungen
- Informe Potenciometria!Dokument11 SeitenInforme Potenciometria!darly246Noch keine Bewertungen
- ValoracionDokument12 SeitenValoracionComunidad Campesina CangalliNoch keine Bewertungen
- Reporte #3 - Determinación Potenciométrica Del PHDokument7 SeitenReporte #3 - Determinación Potenciométrica Del PHAlberto Palomares MuñozNoch keine Bewertungen
- Informe Final de LectroquimicaDokument19 SeitenInforme Final de LectroquimicaEnrique Fernando Llaza TomayaNoch keine Bewertungen
- Manual de ElectrodosDokument32 SeitenManual de ElectrodosfrancosubaruNoch keine Bewertungen
- Practica Titulacion de HCL y NaohDokument17 SeitenPractica Titulacion de HCL y NaohOscar MedinaNoch keine Bewertungen
- Medicion de PHDokument40 SeitenMedicion de PHpeyo84Noch keine Bewertungen
- Informe12 Determinacion Potenciometrica Del PHDokument9 SeitenInforme12 Determinacion Potenciometrica Del PHJeslin Alvino FabianNoch keine Bewertungen
- Practica 1 FQ 2Dokument9 SeitenPractica 1 FQ 2A-Yair Bando VázquezNoch keine Bewertungen
- Informe Analisis de VinosDokument8 SeitenInforme Analisis de VinosOctavio Garcia SotoNoch keine Bewertungen
- Tipos de Métodos de Análisis CuantitativoDokument27 SeitenTipos de Métodos de Análisis CuantitativoLaü Xï Giraldo0% (1)
- Titulación potenciométrica: determinación de concentraciónDokument5 SeitenTitulación potenciométrica: determinación de concentraciónAlvi-pba SantiagoNoch keine Bewertungen
- 2 PotenciometríaDokument29 Seiten2 PotenciometríaCesar Sarmiento PerezNoch keine Bewertungen
- Principios TeoricosDokument6 SeitenPrincipios TeoricosYerson GuerraNoch keine Bewertungen
- Analizadores ElectroquímicosDokument6 SeitenAnalizadores ElectroquímicosLuis Siller AlmazanNoch keine Bewertungen
- Parámetros agua potenciometríaDokument40 SeitenParámetros agua potenciometríaLUZ CAROLINA LOBO RAMÍREZNoch keine Bewertungen
- 06 ElectroquimicaDokument47 Seiten06 ElectroquimicaVlady CafuNoch keine Bewertungen
- Guia Laboratorio Unab - Quim420 - 202020 PDFDokument17 SeitenGuia Laboratorio Unab - Quim420 - 202020 PDFNatalia LigüeñoNoch keine Bewertungen
- Determinación pH azúcarDokument18 SeitenDeterminación pH azúcarShany Qory Guevara ChapilliquenNoch keine Bewertungen
- P HmetriaDokument7 SeitenP Hmetriajoel corsaNoch keine Bewertungen
- Reporte de Lab 6 Analisis InstrumentalDokument9 SeitenReporte de Lab 6 Analisis InstrumentalYukary ValdiviaNoch keine Bewertungen
- NTC 3651 Medicion Del PHDokument14 SeitenNTC 3651 Medicion Del PHarodassanchez100% (1)
- UD7 - Ácidos y BasesDokument33 SeitenUD7 - Ácidos y BasesInés Hernando PérezNoch keine Bewertungen
- Titulación AcidoDokument8 SeitenTitulación AcidoLuciana Benavente ManriqueNoch keine Bewertungen
- Ácidos y BasesDokument6 SeitenÁcidos y BasesJimena MartinezNoch keine Bewertungen
- Curva de TitulacionDokument7 SeitenCurva de TitulacionStefanyQuisbertDiazNoch keine Bewertungen
- Análisis PotenciometricoDokument6 SeitenAnálisis PotenciometricoMarianne Lugo BermanNoch keine Bewertungen
- PH MetroDokument5 SeitenPH MetroEder Da Cruz RibeiroNoch keine Bewertungen
- Determinacion Potenciometrica Del Ácido Acético en Muestras de VinagreDokument22 SeitenDeterminacion Potenciometrica Del Ácido Acético en Muestras de VinagreYelsen Yonathan Canchari Vargas67% (3)
- Tema 3 V Ácido BaseDokument21 SeitenTema 3 V Ácido BaseHajar El OuahabiNoch keine Bewertungen
- Espc UVDokument8 SeitenEspc UVpaul gonzalez verdeNoch keine Bewertungen
- Determinación de acidez en vino tintoDokument12 SeitenDeterminación de acidez en vino tintoGeraldine Llatas OrtizNoch keine Bewertungen
- Tema 3 - Introd A La Volumetria 27-08-2012Dokument56 SeitenTema 3 - Introd A La Volumetria 27-08-2012josemaria0205940% (1)
- Valoracion Poteniometrica Con Acido FosforicoDokument18 SeitenValoracion Poteniometrica Con Acido FosforicoCinthya Knowles Gonzalez Rios100% (1)
- Titulaciones potenciométricas: determinación de concentracionesDokument4 SeitenTitulaciones potenciométricas: determinación de concentracioneseburbano12Noch keine Bewertungen
- Informe 6 Analisis Quimico Volumetria de NeutralizacionDokument14 SeitenInforme 6 Analisis Quimico Volumetria de NeutralizacionMARCO ANTONIO BOJORQUEZ PAUCARNoch keine Bewertungen
- Exposicion FinalDokument30 SeitenExposicion FinalVero SandovalNoch keine Bewertungen
- Práctica 7Dokument13 SeitenPráctica 7Milagros Alejandra Silva ChávezNoch keine Bewertungen
- Informacion DiapositivasDokument3 SeitenInformacion DiapositivasJEAN CARLOS TORRES POVEDANoch keine Bewertungen
- PH-METRO PresentacionDokument19 SeitenPH-METRO PresentacionGabriela De PaivaNoch keine Bewertungen
- Curso de Analizadores PCDokument62 SeitenCurso de Analizadores PCPROMO95Noch keine Bewertungen
- Monografía PotenciometroDokument7 SeitenMonografía PotenciometroAndrés RomeroNoch keine Bewertungen
- Maiz Transgenico InfografiaDokument1 SeiteMaiz Transgenico InfografiaErick Santos Paez75% (4)
- Tsu MatematicasDokument1 SeiteTsu MatematicasBere RodriguezNoch keine Bewertungen
- Hdez, JMiguel - El Racionalismo Cartesiano y La Conquista de La Subjetividad PDFDokument20 SeitenHdez, JMiguel - El Racionalismo Cartesiano y La Conquista de La Subjetividad PDFEusebio Castro ANoch keine Bewertungen
- Pruebas de Sangre - Valores Normales - Recursos - Manual MSDDokument24 SeitenPruebas de Sangre - Valores Normales - Recursos - Manual MSDErick Santos PaezNoch keine Bewertungen
- Método de Ritchie - Práctica 6 - Erick SantosDokument2 SeitenMétodo de Ritchie - Práctica 6 - Erick SantosErick Santos PaezNoch keine Bewertungen
- Las Politicas de Salud Del Banco MundialDokument16 SeitenLas Politicas de Salud Del Banco MundialErick Santos PaezNoch keine Bewertungen
- Kumis CodexDokument11 SeitenKumis CodexAndrea DiazNoch keine Bewertungen
- Mapa Curricular de Nutrición Aplicada Por La UNADMDokument1 SeiteMapa Curricular de Nutrición Aplicada Por La UNADMErick Santos Paez100% (2)
- Clase Global de Pensamiento PrehispánicoDokument8 SeitenClase Global de Pensamiento PrehispánicoErick Santos PaezNoch keine Bewertungen
- Blastocystis HominisDokument15 SeitenBlastocystis HominisErick Santos Paez100% (1)
- Socialismo, Calculo Economico y Funcion Empresarial de Jesus Huerta de SotoDokument449 SeitenSocialismo, Calculo Economico y Funcion Empresarial de Jesus Huerta de SotoJosé Carlos García100% (2)
- MARTÍNEZ BARRERA Santo Tomás y La Teoría de La Justicia PDFDokument9 SeitenMARTÍNEZ BARRERA Santo Tomás y La Teoría de La Justicia PDFYamila JuriNoch keine Bewertungen
- Genocidio CulturalDokument49 SeitenGenocidio CulturalErick Santos PaezNoch keine Bewertungen
- Mapa Mental - Sistema CardiovascularDokument2 SeitenMapa Mental - Sistema CardiovascularErick Santos PaezNoch keine Bewertungen
- 7 17 1 PBDokument9 Seiten7 17 1 PBivanNoch keine Bewertungen
- Mecanismos de Daño InmunológicoDokument6 SeitenMecanismos de Daño InmunológicoAletheia1708Noch keine Bewertungen
- 32505Dokument9 Seiten32505Ivan Roy Fernandez BautistaNoch keine Bewertungen
- Una Aproximación A La Definición de CulturaDokument4 SeitenUna Aproximación A La Definición de CulturaErick Santos PaezNoch keine Bewertungen
- Azucar InvertidaDokument3 SeitenAzucar InvertidaErick Santos Paez100% (1)
- Práctica de Actividad Enzimática Por VolumenDokument10 SeitenPráctica de Actividad Enzimática Por VolumenErick Santos PaezNoch keine Bewertungen
- Historia de La TeologíaDokument5 SeitenHistoria de La TeologíaErick Santos PaezNoch keine Bewertungen
- EL EJERCICIO DE LA TEOLOGÍA.-resumendocxDokument2 SeitenEL EJERCICIO DE LA TEOLOGÍA.-resumendocxErick Santos PaezNoch keine Bewertungen
- Cálculo de Riesgo Toxicológico Al Usar Enjuage Bucal Con FluorurosDokument2 SeitenCálculo de Riesgo Toxicológico Al Usar Enjuage Bucal Con FluorurosErick Santos PaezNoch keine Bewertungen
- GluconeogénesisDokument13 SeitenGluconeogénesisErick Santos PaezNoch keine Bewertungen
- Bernardette - Etica o Filosofía Moral - TradicionDokument89 SeitenBernardette - Etica o Filosofía Moral - TradicionErick Santos PaezNoch keine Bewertungen
- CronologíaDokument1 SeiteCronologíaErick Santos PaezNoch keine Bewertungen
- Resumen Carbapenemicos - ErickSantosDokument2 SeitenResumen Carbapenemicos - ErickSantosErick Santos PaezNoch keine Bewertungen
- Ejercicio de IR Y RMN - HDokument1 SeiteEjercicio de IR Y RMN - HErick Santos PaezNoch keine Bewertungen
- La Musica para San AgustinDokument1 SeiteLa Musica para San AgustinErick Santos PaezNoch keine Bewertungen
- Esquema de AdvientoDokument9 SeitenEsquema de AdvientoErick Santos PaezNoch keine Bewertungen
- Informe Lab Oratorio Practica FinalDokument7 SeitenInforme Lab Oratorio Practica FinalDario TasconNoch keine Bewertungen
- Examen de PHDokument3 SeitenExamen de PHAp LpNoch keine Bewertungen
- Equilibrio ácido base y soluciones amortiguadorasDokument137 SeitenEquilibrio ácido base y soluciones amortiguadorasSHARON OSSA CABALLERONoch keine Bewertungen
- Cálculos de pH y preparación de tamponesDokument6 SeitenCálculos de pH y preparación de tamponesLINDSAY LISBETH MENDOZA MENDOZANoch keine Bewertungen
- Nom 177 y FeumDokument21 SeitenNom 177 y FeumadmtzmontanoNoch keine Bewertungen
- Guía de Laboratorio No 3Dokument6 SeitenGuía de Laboratorio No 3Salome LopezNoch keine Bewertungen
- Definición y Medición Del PHDokument8 SeitenDefinición y Medición Del PHNahúm EscobarNoch keine Bewertungen
- Validación espectrofotométrica COHBDokument63 SeitenValidación espectrofotométrica COHBJosué Quishpe CoelloNoch keine Bewertungen
- Trastornos Ácido BaseDokument4 SeitenTrastornos Ácido BaseCatalina MontecinoNoch keine Bewertungen
- Inserto GPTDokument1 SeiteInserto GPTJonathan CristaldoNoch keine Bewertungen
- Preguntas FisicoquimicaDokument20 SeitenPreguntas FisicoquimicaJuliian Gutiierez0% (1)
- Guia de Bioquimica GeneralDokument123 SeitenGuia de Bioquimica GeneralRonal Vásquez BautistaNoch keine Bewertungen
- 3er Soluciones Amortiguadoras - Grupo 4Dokument15 Seiten3er Soluciones Amortiguadoras - Grupo 4Alex LennyNoch keine Bewertungen
- Protocolo para El Aislamiento y Purificación de Catalasa A Partir de Tejido Hepático de PolloDokument3 SeitenProtocolo para El Aislamiento y Purificación de Catalasa A Partir de Tejido Hepático de PolloMaximo Rosales100% (1)
- Informe Solubilidad de Sales Inorgánicas HidrometalurgiaDokument20 SeitenInforme Solubilidad de Sales Inorgánicas HidrometalurgiaYenni Nayid Santamaría0% (1)
- Aspectos Relativos Al PH y Soluciones ReguladorasDokument16 SeitenAspectos Relativos Al PH y Soluciones ReguladorasCatalina SánchezNoch keine Bewertungen
- Practica N11Dokument9 SeitenPractica N11Dani TapiaNoch keine Bewertungen
- Activdad 3 PRUEBAS DE LAB PROTEINASDokument32 SeitenActivdad 3 PRUEBAS DE LAB PROTEINASmariana mendezNoch keine Bewertungen
- Soluciones AmortiguadoresDokument11 SeitenSoluciones Amortiguadoresapi-3720364100% (4)
- Norma Oficial Mexicana reactivo CoombsDokument6 SeitenNorma Oficial Mexicana reactivo CoombsCésar Cedillo RodríguezNoch keine Bewertungen
- Informe3 BufferdeAcetatosDokument13 SeitenInforme3 BufferdeAcetatosJorge Castrejon BeltranNoch keine Bewertungen
- Wuolah Free Tecnicas Fundamentales en BiologiaDokument84 SeitenWuolah Free Tecnicas Fundamentales en Biologiajuditsgonzi12Noch keine Bewertungen
- Informe N°01 de Quimica Cuantitativa y CualitativaDokument21 SeitenInforme N°01 de Quimica Cuantitativa y CualitativaALIDA QUISPE CRUZNoch keine Bewertungen
- Bioquímica y homeostasis en sistemas biológicosDokument26 SeitenBioquímica y homeostasis en sistemas biológicosVale Ignacia Farias ReyesNoch keine Bewertungen
- CAPÍTULO 2 Análisis Físico Del Agu1Dokument12 SeitenCAPÍTULO 2 Análisis Físico Del Agu1Vidkan HerreraNoch keine Bewertungen
- Informe N5Dokument26 SeitenInforme N5Rossicela Vicente DueñasNoch keine Bewertungen
- PRACTICA 1. CAPACIDAD AMORTIGUADORA DE SOLUCIONES BUFFER Y VALORACIÓN ÁCIDO BASE DE UN AMINOÁCIDODokument11 SeitenPRACTICA 1. CAPACIDAD AMORTIGUADORA DE SOLUCIONES BUFFER Y VALORACIÓN ÁCIDO BASE DE UN AMINOÁCIDOFranci GuerrónNoch keine Bewertungen
- Equilibrio Acido Base Biotecnologia BioquimicaDokument14 SeitenEquilibrio Acido Base Biotecnologia BioquimicaJenni StefiNoch keine Bewertungen
- Procedimiento General de Una ElectroforesisDokument8 SeitenProcedimiento General de Una ElectroforesisYanina MadeleiiNoch keine Bewertungen