Beruflich Dokumente
Kultur Dokumente
Disoluciones Ionicas
Hochgeladen von
flpdejuanOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Disoluciones Ionicas
Hochgeladen von
flpdejuanCopyright:
Verfügbare Formate
EQUILIBRIO DE SISTEMAS
ELECTROQUMICOS
Equilibrio de sistemas electroqumicos
A+B (lquido)
A (slido)
( ) ( )
0
=
A solido A disolucion
( )
*
ln = +
A
A liquido
RT a
( ) ( )
0 *
ln =
A
A solido A liquido
RT a
fusion f f
A A A
G H T S A = A A
ln
f
f f
A
A A A
f
H
G H T RT a
T
A
A = A =
Equilibrio de sistemas electroqumicos
ln
A
A = A =
f
f f
A
A A A
f
H
G H T RT a
T
1 1
ln
| |
A
=
|
\ .
f
A
A
f
A
H
a
R T T
ln c A
=
c
f
A A
a H
T RT
Esta ecuacin expresa como varia el
lmite de solubilidad de un soluto
o el punto de fusin de la disolucin en
funcin de la composicin.
Equilibrio de sistemas electroqumicos
En general, las disoluciones no se comportan como disoluciones ideales,
solo en el caso en que la fraccin molar del disolvente tienda a uno,
disolucin diluida ideal, su comportamiento se puede asemejar al de una
disolucin ideal
En el caso de disoluciones no ideales el potencial qumico es:
0
ln
i i i
RT a = +
Actividad=concentracin efectiva
Equilibrio de sistemas electroqumicos
Valores de la actividad
a = P/P
0
en el caso de gases ideales , siendo P
0
= 1bar
a = P
i
en el caso de gases ideales en una mezcla
a = 1 en el caso de slidos o lquidos puros, ya que por definicin
i
=
i
0
a =
i
en el caso de disoluciones ideales
a =
i
i
en el caso de disoluciones reales;
el coeficiente de actividad, i es una medida de la discrepancia
del comportamiento de la sustancia i respecto a la idealidad.
Antecedentes
Equilibrio de sistemas electroqumicos
Faraday: electrolito + campo elctrico = iones
Pero no es necesario en realidad la presencia de un campo elctrico para
que un electrolito se disocie Propiedades coligativas. Def.
electrolito = medio dotado de conductividad inica o sustancia que
cuando se disuelve o funde originan un medio conductor.
Arrhenius: Teora de la disociacin electroltica
La disociacin de molculas en iones no es completa grado de
disociacin.
Modelo que permite obtener una medida
cuantitativa de las interacciones ion-ion.
Deficiencias de la Teora de Arrhenius
Equilibrio de sistemas electroqumicos
No considera las interacciones ion-disolvente.
No tiene en cuenta las interacciones ion-ion.
Teora de Debye-Hckel
Para calcular A
I-I
Tomamos un ion de referencia y
suponemos que es el nico que
est cargado. Si +
ri
es el potencial
elctrico en la superficie de este ion, el trabajo necesario para cargarle de 0
a un valor Z
i
e
0
ser:
Teora de Debye-Hckel (1923)
Equilibrio de sistemas electroqumicos
Modelo estructural para disoluciones diluidas de electrolitos verdaderos
Estado inicial
Sin interacciones
ion-ion
Trabajo de la interaccin
ion-ion . AG
I-I
Estado final
Con interacciones
ion-ion
Para una especie nica:
A
I-I
Teora de Debye-Hckel (1923)
Equilibrio de sistemas electroqumicos
W
ion
es la energa propia del ion y W
nube
es la energa
debida a las interacciones entre el ion de referencia y los
dems iones. Con W
nube
podemos calcular A
I-I
:
A
I-I
= N
A
W
nube
Objetivo
Calcular +
nube
que es el potencial
electrosttico producido por el resto de
los iones de la disolucin en la
superficie del ion (esfera de radio r
i
)
Teora de Debye-Hckel (1923)
Equilibrio de sistemas electroqumicos
1 aproximacin:
2 aproximacin:
3 aproximacin:
+
+
+
+
+
-
-
-
-
Ion de referencia
Molculas de agua
Otros iones
+
Ion de referencia
Densidad de carga
neta debido a los
dems iones
Dielctrico continuo en
lugar de molculas de agua
+ +
Ion de referencia
Disolucin electroltica
-
Estas molculas de disolvente proporcionan un
medio de constante dielctrica c
Los iones que le rodean dan
origen a un exceso de
densidad de carga
r
r
Modelo de Debye-Hckel
Teora de Debye-Hckel (1923)
Equilibrio de sistemas electroqumicos
Coeficientes de actividad e interacciones ion-ion
Para disoluciones ideales
Donde _
i
es la concentracin de soluto expresada en fraccin molar y
i
0
el potencial qumico en
estado estndar cuando _
i
=1
Para poder utilizar la ec.de disoluciones ideales para disoluciones no ideales,
se introdujo un factor de correccin que modifica la concentracin ya que es
la concentracin efectiva (_
i
i
), y no la analtica (_
i
) la que determina el
cambio de potencial qumico
i
= coeficiente de actividad
a
i
= actividad
Para disoluciones ideales
Teora de Debye-Hckel (1923)
Equilibrio de sistemas electroqumicos
Coeficientes de actividad e interacciones ion-ion
El coeficiente de actividad es una medida del cambio de potencial
qumico que nace de las interacciones ion-ion
Segn la teora de D-H
i-I =
=
Igualando ambas
ecuaciones
Teora de Debye-Hckel (1923)
Equilibrio de sistemas electroqumicos
especie inica
Terico D-H
electrolito
experimental
El coeficiente de actividad inico medio as como el potencial qumico de
la sal son accesibles experimentalmente.
Vamos a poner
(exp)
en funcin de los coeficientes de actividad inicos
y sustituir
M
+
y
A
-
utilizando la teora de D-H:
Teora de Debye-Hckel (1923)
Equilibrio de sistemas electroqumicos
Coeficientes de actividad e interacciones ion-ion
Debido a la electroneutralidad de la disolucin
=
Sustituyendo el valor de _ dado por la
Previamente vamos a poner _ en funcin de
la concentracin molar C
j
sustituyendo el
valor de n
j
0
Teora de Debye-Hckel (1923)
Equilibrio de sistemas electroqumicos
Coeficientes de actividad e interacciones ion-ion
El trmino cuantifica la carga de la disolucin y se denomina
fuerza inica I
I =1/2
Poniendo en funcin de la fuerza inica I:
= B I
1/2
Teniendo en cuenta la expresin de en el coeficiente de actividad
B I
1/2
Para obtener una expresin ms compacta se puede definir una nueva
constante A
B ln
= A (Z
+
Z
-
) I
1/2
= - A Z
+
|Z-|I
1/2
Teora de Debye-Hckel (1923)
Equilibrio de sistemas electroqumicos
Coeficientes de actividad e interacciones ion-ion
Para electrolitos 1:1 Z
+
=|Z-|= 1 = c
ln
= -A c
1/2
Ahora se puede calcular el valor del
coeficiente de actividad inico medio (terico)
para un electrolito MA y compararlo con su
valor experimental para ver la bonanza de la
teora de Debye-Hckel.
Teora de Debye-Hckel (1923)
Equilibrio de sistemas electroqumicos
Logros y limitaciones de la teora de Debye-Hckel
La ecuacin terica aproximada indica que el logaritmo del coeficiente de actividad
inico medio debe decrecer linealmente en funcin de la raz cuadrada de la fuerza
inica o en el caso de los electrolitos 1:1 raz cuadrada de la concentracin.
La pendiente no depende del electrolito ( NaCl, NaBr, KCl, CsF) sino nicamente
de las cargas que posean los iones Z
+
Z
-.
La pendiente aumenta con la carga.
A dilucin infinita, cuando las fuerzas interinicas son despreciables, I 0;
log
0;
1 la disolucin del electrolito se comporta como una disolucin ideal
(no existen interacciones ion-ion ).
Si se toman los valores experimentales de
a concentraciones extremadamente
bajas de electrolito y se representa su logaritmo en funcin I
se observa que:
1. Son lineales.
2. Se agrupan de acuerdo con el tipo de valencia del electrolito Z
+
Z
-.
3. Las pendientes calculadas por D-H tiene un acuerdo excelente con las
experimentales, con un error del 0,5%.
Equilibrio de sistemas electroqumicos
Sin embargo, si se examina la curva experimental a
concentraciones ms altas que a dilucin extrema, no es
una recta sino una curva . Adems estas curvas dependen
no solo de la valencia sino del tipo de electrolito. Por tanto
la ley de Debye-Hckel es la tangente a la curva para
c<10
-3
M para electrolitos 1:1 en disoluciones acuosas y se
llama ley limite de Debye-Hckel.
Teora de Debye-Hckel (1923)
Equilibrio de sistemas electroqumicos
Das könnte Ihnen auch gefallen
- Examenes Quimica BasicaDokument266 SeitenExamenes Quimica BasicaPao Colls100% (15)
- Manual SCR Ross-HillDokument101 SeitenManual SCR Ross-HillIvan Villarreal LopezNoch keine Bewertungen
- Intentar Es ConseguirDokument157 SeitenIntentar Es ConseguirIsabel Navarro Bricio100% (1)
- Cinética enzimática problemas bioquímicaDokument7 SeitenCinética enzimática problemas bioquímicaVictor Aguirre A75% (4)
- PROBLEMAS ENZIMÁTICOSDokument5 SeitenPROBLEMAS ENZIMÁTICOSJulio Cesar Castañeda Mancipe80% (5)
- Teoria de Orificios y VertederosDokument31 SeitenTeoria de Orificios y VertederosEnzoLiquitay89% (9)
- Guía de Ciencias Naturales sobre circuitos eléctricos y evaluación formativaDokument3 SeitenGuía de Ciencias Naturales sobre circuitos eléctricos y evaluación formativaPascal BlasetNoch keine Bewertungen
- Resumen Estadística FarmaciaDokument17 SeitenResumen Estadística FarmaciaflpdejuanNoch keine Bewertungen
- Grado Protocolos Prácticas NybDokument23 SeitenGrado Protocolos Prácticas NybflpdejuanNoch keine Bewertungen
- Est Ad Is Tic ADokument1 SeiteEst Ad Is Tic APeqee CaliigariNoch keine Bewertungen
- Informe Clinico 2011Dokument4 SeitenInforme Clinico 2011flpdejuanNoch keine Bewertungen
- Tema 13. MicrobiologíaDokument5 SeitenTema 13. MicrobiologíaflpdejuanNoch keine Bewertungen
- Tema 1. Derecho Procesal Civil. Uc3mDokument6 SeitenTema 1. Derecho Procesal Civil. Uc3mnvm58Noch keine Bewertungen
- Tema 1. Qu Mica NuclearDokument21 SeitenTema 1. Qu Mica NuclearflpdejuanNoch keine Bewertungen
- Estudio y Rep - Fun-ExponencialDokument1 SeiteEstudio y Rep - Fun-ExponencialflpdejuanNoch keine Bewertungen
- Problemas AaDokument2 SeitenProblemas AaflpdejuanNoch keine Bewertungen
- Enzimología ResueltosDokument10 SeitenEnzimología ResueltosflpdejuanNoch keine Bewertungen
- Problemas AaDokument2 SeitenProblemas AaflpdejuanNoch keine Bewertungen
- Tecnologia FarmaceuticaDokument30 SeitenTecnologia Farmaceuticaiqramirez67% (3)
- Formulacion SolucionDokument2 SeitenFormulacion SolucionflpdejuanNoch keine Bewertungen
- Tecnología Farmacéutica GeneralDokument213 SeitenTecnología Farmacéutica GeneralflpdejuanNoch keine Bewertungen
- Bases Biosinteticas Del MetabolismoDokument10 SeitenBases Biosinteticas Del MetabolismoflpdejuanNoch keine Bewertungen
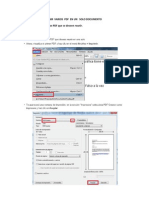
- Unir Varios PDF en Un Solo DocumentoDokument2 SeitenUnir Varios PDF en Un Solo DocumentoflpdejuanNoch keine Bewertungen
- Tema 2 - Naturaleza Del Material Geneì TicoDokument6 SeitenTema 2 - Naturaleza Del Material Geneì TicoflpdejuanNoch keine Bewertungen
- Laboratorio 1 Circuitos 2 Anthony RodríguezDokument16 SeitenLaboratorio 1 Circuitos 2 Anthony RodríguezignacioNoch keine Bewertungen
- Formulario Hidráulica IDokument22 SeitenFormulario Hidráulica IjeanNoch keine Bewertungen
- Termodinámica del aire húmedo: conceptos básicosDokument16 SeitenTermodinámica del aire húmedo: conceptos básicosInsaurralde PedroNoch keine Bewertungen
- TEMA CLASE 04 Configuraciones ElectronicasDokument11 SeitenTEMA CLASE 04 Configuraciones ElectronicasDan MouzNoch keine Bewertungen
- Tiro vertical y caída libre - 7 problemasDokument2 SeitenTiro vertical y caída libre - 7 problemasDavid GuamanNoch keine Bewertungen
- Ejercicios Primer ParcialDokument8 SeitenEjercicios Primer ParcialLotuz ProtusNoch keine Bewertungen
- Prueba de CapacitoresDokument3 SeitenPrueba de CapacitoresRoni DominguezNoch keine Bewertungen
- 15 Catalogo Cursos Formacion MetalDokument192 Seiten15 Catalogo Cursos Formacion MetalHolger Rafael Jaramillo FigueroaNoch keine Bewertungen
- AmperimetroDokument14 SeitenAmperimetroAlex Sierra WittinghanNoch keine Bewertungen
- Teoria Del Big Ban y OtrosDokument24 SeitenTeoria Del Big Ban y OtrosjuanflorocNoch keine Bewertungen
- Laboratorio Calculo de ResistenciasDokument8 SeitenLaboratorio Calculo de Resistenciasjuan esteban puyo cubillosNoch keine Bewertungen
- Coordinacion de Fusibles 1Dokument24 SeitenCoordinacion de Fusibles 1jorge_israellNoch keine Bewertungen
- Laboratorio CondensadorDokument13 SeitenLaboratorio CondensadorJeffersson MosqueraNoch keine Bewertungen
- Informe Geofisico Bagua CompletoDokument33 SeitenInforme Geofisico Bagua CompletoEdgar NietoNoch keine Bewertungen
- Robótica Fase 3Dokument3 SeitenRobótica Fase 3Héctor CruzNoch keine Bewertungen
- El método de las deformacionesDokument15 SeitenEl método de las deformacionesFacu CettourNoch keine Bewertungen
- Tema 1 - Mezclas No ReactivasDokument2 SeitenTema 1 - Mezclas No ReactivasJavier MedinaNoch keine Bewertungen
- Trabajo N°4-Sist. Aterramiento-ActualizadoDokument18 SeitenTrabajo N°4-Sist. Aterramiento-ActualizadoEva Isabel Pulido Smith100% (1)
- NCH 4 ELEC 99Dokument7 SeitenNCH 4 ELEC 99Gabriel ToledoNoch keine Bewertungen
- Clase TP 4.1 (Perdidas de Carga)Dokument37 SeitenClase TP 4.1 (Perdidas de Carga)Walter SdrNoch keine Bewertungen
- 1era Practica Calificada - Termodinámica General - 2020 IIDokument1 Seite1era Practica Calificada - Termodinámica General - 2020 IIMary Liz Astoquillca SantoyoNoch keine Bewertungen
- Fisica 4 AÑODokument21 SeitenFisica 4 AÑONahuel EcheniqeNoch keine Bewertungen
- Cálculo de La Carga InstaladaDokument6 SeitenCálculo de La Carga InstaladaFrank Chavez MoralesNoch keine Bewertungen
- Cuaderno de Ejercicios Nº1: Física MenciónDokument12 SeitenCuaderno de Ejercicios Nº1: Física MencióntuxonNoch keine Bewertungen
- QUÍMICA 8AVO BÁSICO Guía de Ejercicios Leyes de Los GasesDokument2 SeitenQUÍMICA 8AVO BÁSICO Guía de Ejercicios Leyes de Los GasesJaime Barrera0% (1)