Beruflich Dokumente
Kultur Dokumente
Benzol 2 GK 2017
Hochgeladen von
ElifOriginaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Benzol 2 GK 2017
Hochgeladen von
ElifCopyright:
Verfügbare Formate
Benzol (Teil 2)
Inzwischen hast du herausgefunden, dass Benzol die Summenformel C6H6 hat und über mehrere
Doppel- und / oder Dreifachbindungen verfügen muss. Auch ringförmige Strukturen sind denkbar.
Im Jahre 1866 schlug A. KEKULÉ für das Benzol eine Struktur vor, bei der die sechs
Kohlenstoffatome einen Ring bilden und jeweils abwechselnd mit Einfach- und Doppelbindungen
untereinander sowie jeweils noch mit einem Wasserstoffatom verbunden sind.
Die Tatsache, dass Benzol mit Brom nicht über den AE-Mechanismus reagiert,
konnte zunächst jedoch nicht gedeutet werden.
Dazu kamen noch einige andere unerwartete Befunde, die aber schließlich zum Verständnis der genauen
Bindungsverhältnisse und zur Entdeckung einer neuen Stoffklasse (der Aromaten) führte.
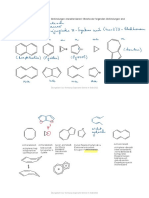
4. Wenn ein Benzolmolekül mit zwei Molekülen Brom reagiert, dann entsteht
Bromwasserstoff und Dibrombenzol. Von diesem Stoff sind vier Isomere zu erwarten.
Tatsächlich gibt es von Dibrombenzol aber nur drei Isomere:
Jeweils ein 1,2- (ortho), ein 1,3- (meta) und ein 1,4- (para) Dibrombenzol.
D. h. Benzol verhält sich offensichtlich nicht so, wie man es (aufgrund der Doppelbindungen) erwarten sollte.
Das (und vieles andere mehr!) kann man mithilfe eines neuen Atom- bzw. Bindungsmodells erklären:
Das Orbitalmodell (S. 42 – 52) Für den GK muss es genügen, wenn die Grundlagen (Welle-Teilchen-
Dualismus des Elektrons, Orbitale (Energien, Form, Bezeichnung, Besetzung) kurz (Video, Buch)
angesprochen werden. Für die Bindungsverhältnisse im Kohlenstoff und anderer Elemente der
2. Periode sind sowieso Hybridorbitale relevant, welche sich „Mischen“ von Atomorbitalen ergeben.
5. Exkurs: Lage mehrerer Doppelbindungen zueinander – Hybridisierung der C-Atome
a) Zeichne die Strukturformeln folgender Diene: 1,2-Pentadien, 1,3-Pentadien und 1,4-Pentadien
und gebe darunter jeweils die Hybridisierung der C-Atome an.
Sind sp2-hybridisierte C-Atome durch dazwischen liegende sp 3-hybridisierte C-Atome getrennt, dann handelt es
sich um so genannte isolierte Doppelbindungen, die jede für sich so wie „normale“ Doppelbindungen reagieren.
Ist ein C-Atom an zwei Doppelbindungen beteiligt, dann spricht man von einer kumulierten Doppelbindung.
Chemisch am interessantesten sind die konjugierten Doppelbindungen, bei denen mehrere sp2-hybridisierte
C-Atome ohne Unterbrechung miteinander verbunden sind. Hier ist Mesomerie möglich!
b) Ordne die Bezeichnungen der Doppelbindungen den Pentadienen (s. a)
und den Cyclohexadi- bzw. trienen (s. AB Hydrierungsenthalpien, 2. Spalte) zu.
6. Wahrscheinlich ist dir bereits aufgefallen, dass die Strukturformel des Hexatriens
der von KEKULÉ postulierten Formel von Benzol entspricht.
Da sich aber wie bereits gesagt konjugierte Doppelbindungen etwas andres verhalten
- insbesondere diese drei im Benzolring - stellt man sie auch anders dar, nämlich so:
a) Verdeutliche dir die Bindungswinkel im Benzol
und die Lage der einfach besetzten p-Orbitale
zueinander mit Hilfe einer Skizze.
b) Fülle die Tabelle auf dem Arbeitsblatt
„Hydrierungsenthalpie“ aus und formuliere, inwiefern
der für Benzol ermittelte Wert überraschend ist.
In dem nebenstehenden Graphen sind die
Hydrierungsenthalpien von Cyclohexen und
dem (hypothetischen) Cyclohexatrien dargestellt.
c) Verdeutliche dir diese Darstellungsweise und trage
den tatsächlich gemessenen Wert für Benzol
sowie dessen Mesomerieenergie ein.
d) Stelle den Zusammenhang mit der unerwartet
geringen Reaktivität von Benzol mit Brom her.
Das könnte Ihnen auch gefallen
- Orbital Hybrid Is I e RungDokument68 SeitenOrbital Hybrid Is I e RungDalw WhatNoch keine Bewertungen
- Chemi CH E B ErichteDokument4 SeitenChemi CH E B ErichteyetruperkaNoch keine Bewertungen
- RedoxreaktionenDokument15 SeitenRedoxreaktionenOdranoel RellekNoch keine Bewertungen
- AC-II_WS-1314_FröbaDokument1 SeiteAC-II_WS-1314_FröbaflorcimusaNoch keine Bewertungen
- Anorganische Chemie II - Fragenkatalog - Teil IDokument10 SeitenAnorganische Chemie II - Fragenkatalog - Teil INicolas Lew MyschkinNoch keine Bewertungen
- Chemische - BindungenDokument28 SeitenChemische - BindungenRafael R.Noch keine Bewertungen
- Lewis AufgabeDokument3 SeitenLewis AufgabeManuela CalderónNoch keine Bewertungen
- Organische Chemie Teil1 KorrigiertDokument30 SeitenOrganische Chemie Teil1 Korrigiertimad haddiouiNoch keine Bewertungen
- Ac3 - WS18 19Dokument3 SeitenAc3 - WS18 19Origamist KryaNoch keine Bewertungen
- Gemischte AufgabenDokument1 SeiteGemischte AufgabenchemtrailsoverNoch keine Bewertungen
- Gemischte Aufgaben Mit LÃ Sung Gr.1Dokument3 SeitenGemischte Aufgaben Mit LÃ Sung Gr.1chemtrailsoverNoch keine Bewertungen
- 3.2 Molekülgeometrie PDFDokument10 Seiten3.2 Molekülgeometrie PDFAeroteam Minecraft ServerNoch keine Bewertungen
- Alte Chemie Klausuren Uni HamburgDokument20 SeitenAlte Chemie Klausuren Uni HamburgpanakosNoch keine Bewertungen
- Chemie Basics DDokument63 SeitenChemie Basics DFranke SchifflerNoch keine Bewertungen
- Chemie Basics eDokument74 SeitenChemie Basics eFranke SchifflerNoch keine Bewertungen
- ChemistryDokument2 SeitenChemistrymisheetabaggaNoch keine Bewertungen
- 11 - KA2 - Übungen Zur Klassenarbeit - VerbDokument3 Seiten11 - KA2 - Übungen Zur Klassenarbeit - Verbbendix.pfeiferNoch keine Bewertungen
- 9 4 4 3 Übung Mesomerie Molekülionen ABDokument2 Seiten9 4 4 3 Übung Mesomerie Molekülionen ABanneNoch keine Bewertungen
- AtombindungDokument29 SeitenAtombindungalphaprimeNoch keine Bewertungen
- Carbon Nano Tubes - GrundlagenDokument15 SeitenCarbon Nano Tubes - GrundlagenSebastian Michalski100% (1)
- POGIL-Eigenschaften Von Wasser AntwortenDokument18 SeitenPOGIL-Eigenschaften Von Wasser AntwortenScribdTranslationsNoch keine Bewertungen
- TC Vortrag 04 Waschen-Bleichen-Faerben 03 Anlagen 2 ChemieDokument96 SeitenTC Vortrag 04 Waschen-Bleichen-Faerben 03 Anlagen 2 ChemieAWRCATS WriterNoch keine Bewertungen
- 5 Theorie Der Chemischen BindungDokument11 Seiten5 Theorie Der Chemischen BindungPaola Vanessa PouvensNoch keine Bewertungen
- Chemie Reader E PhaseDokument15 SeitenChemie Reader E PhaseStephan Rojas LampeNoch keine Bewertungen
- Bandstrukturen Haas Rosker09Dokument16 SeitenBandstrukturen Haas Rosker09Arthur KronskiNoch keine Bewertungen
- 02 - Einführung - Orbitale - Räumlicher Bau Von Atomen - Räumliche Struktur Von WasserDokument4 Seiten02 - Einführung - Orbitale - Räumlicher Bau Von Atomen - Räumliche Struktur Von WasserjufewilNoch keine Bewertungen
- Chemie Der ÜbergangsmetalleDokument77 SeitenChemie Der ÜbergangsmetalleFranz HeroldNoch keine Bewertungen
- Kater Toni im Fieber der Atommodelle Teil 2: Eine historische Zeitreise vom Altertum bis zur heutigen ZeitVon EverandKater Toni im Fieber der Atommodelle Teil 2: Eine historische Zeitreise vom Altertum bis zur heutigen ZeitNoch keine Bewertungen
- Chemie Die ElektronenpaarbindungDokument2 SeitenChemie Die ElektronenpaarbindungBella MaravigosaNoch keine Bewertungen
- Chemie Basics BDokument178 SeitenChemie Basics BFranke SchifflerNoch keine Bewertungen
- Is the Electron System a Misinterpretation Bohrs?: Atomic StructureVon EverandIs the Electron System a Misinterpretation Bohrs?: Atomic StructureNoch keine Bewertungen
- Chemische Bindung Für Studis II Metall - Und AtombindungDokument9 SeitenChemische Bindung Für Studis II Metall - Und AtombindungMehrab RakhtarNoch keine Bewertungen
- 4713 Chapter 08exDokument22 Seiten4713 Chapter 08exchinensisNoch keine Bewertungen
- Wiederholung Chemische Bindung Klasse 10Dokument7 SeitenWiederholung Chemische Bindung Klasse 10Juliana AlterioNoch keine Bewertungen
- OG G8 Abituraufgaben Chemie Aromatische KohlenwasserstoffeDokument11 SeitenOG G8 Abituraufgaben Chemie Aromatische KohlenwasserstoffeEdgar DickNoch keine Bewertungen
- M Org 1Dokument42 SeitenM Org 1Zuzi LiliumNoch keine Bewertungen
- He ItlerDokument16 SeitenHe ItlerAndrea SchuhmannNoch keine Bewertungen
- ChemischeStarkeBindungDokument6 SeitenChemischeStarkeBindungHorstNoch keine Bewertungen
- Aufgabe 1Dokument6 SeitenAufgabe 1Sıla ÇiçekNoch keine Bewertungen
- Chemie LernzettelDokument30 SeitenChemie LernzettelMerlin Spielmann100% (1)
- 12/1 Chemie GKDokument48 Seiten12/1 Chemie GKjames.fox.pkg100% (3)
- Bohr - Der Bau Der Atome Und Die PhysikalischenDokument67 SeitenBohr - Der Bau Der Atome Und Die Physikalischencelso_adNoch keine Bewertungen
- Klingenberg 1965Dokument1 SeiteKlingenberg 1965CrazyopediaNoch keine Bewertungen
- BW 2017 Theorie Losung2Dokument19 SeitenBW 2017 Theorie Losung2Quốc NguyễnNoch keine Bewertungen
- E D Chimie Organica 2023 Var Simulare LGEDokument2 SeitenE D Chimie Organica 2023 Var Simulare LGEMirela ElenaNoch keine Bewertungen
- Chemisehes Zentralblatt.: A. Allgemeine Und Płiysikalische ChemieDokument224 SeitenChemisehes Zentralblatt.: A. Allgemeine Und Płiysikalische ChemieKris MNoch keine Bewertungen
- Die Akkumulatoren: ihre Theorie, Herstellung, Behandlung und VerwendungVon EverandDie Akkumulatoren: ihre Theorie, Herstellung, Behandlung und VerwendungNoch keine Bewertungen
- C Zum Stand Der ElementarteilchenphysikDokument11 SeitenC Zum Stand Der Elementarteilchenphysikkanadio@hotmailNoch keine Bewertungen
- Krasserstoff - CH - 08 - SkriptDokument10 SeitenKrasserstoff - CH - 08 - SkriptGreezyNoch keine Bewertungen
- Neue Guaianolide Aus Cacosmia Rugosa Bohlmann 1980Dokument4 SeitenNeue Guaianolide Aus Cacosmia Rugosa Bohlmann 1980neljaespi01Noch keine Bewertungen
- Grundwissen ChemieDokument11 SeitenGrundwissen Chemieasdfgh6Noch keine Bewertungen
- FHB Klausur WiSe20-21 Nur Zum Persönlichen GebrauchDokument19 SeitenFHB Klausur WiSe20-21 Nur Zum Persönlichen Gebrauchgodiyi4854Noch keine Bewertungen
- Die Goldbrakteaten Der Völkerwanderungszeit. 2.2: Ikonographischer Katalog (IK 2, Tafeln) / Hrsg. Von Karl Hauck in Verbindung Mit Herbert Lange Und Lutz Von PadbergDokument182 SeitenDie Goldbrakteaten Der Völkerwanderungszeit. 2.2: Ikonographischer Katalog (IK 2, Tafeln) / Hrsg. Von Karl Hauck in Verbindung Mit Herbert Lange Und Lutz Von PadbergDigital Library Numis (DLN)Noch keine Bewertungen
- Ü Ac 6Dokument1 SeiteÜ Ac 6api-3708542Noch keine Bewertungen
- 1618951130502-Corona Aufg CH 7a 19230421Dokument2 Seiten1618951130502-Corona Aufg CH 7a 19230421haha boboNoch keine Bewertungen
- Organische Chemie Uniskript 2Dokument17 SeitenOrganische Chemie Uniskript 2UDGARDNoch keine Bewertungen
- AC2 2 CB Klausur 2011 - 1 Mit LösungshinweisenDokument6 SeitenAC2 2 CB Klausur 2011 - 1 Mit LösungshinweisenNfomen Steve YvanNoch keine Bewertungen
- IXS EnterpriseDokument2 SeitenIXS EnterprisePeter Herzog von Kempenich-JonalikNoch keine Bewertungen
- Drischke - Skript QMIIDokument166 SeitenDrischke - Skript QMIITimKellerNoch keine Bewertungen
- FESS ThesisDokument305 SeitenFESS ThesisHarish KumarNoch keine Bewertungen
- Ziegler PDDokument53 SeitenZiegler PDMoisa DragosNoch keine Bewertungen
- Din en 14399-4Dokument21 SeitenDin en 14399-4Szanto AttilaNoch keine Bewertungen