Beruflich Dokumente
Kultur Dokumente
V Katalyse
Hochgeladen von
GetLucky80 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
12 Ansichten1 SeiteOriginaltitel
V_Katalyse copia
Copyright
© © All Rights Reserved
Verfügbare Formate
PDF, TXT oder online auf Scribd lesen
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
© All Rights Reserved
Verfügbare Formate
Als PDF, TXT herunterladen oder online auf Scribd lesen
0 Bewertungen0% fanden dieses Dokument nützlich (0 Abstimmungen)
12 Ansichten1 SeiteV Katalyse
Hochgeladen von
GetLucky8Copyright:
© All Rights Reserved
Verfügbare Formate
Als PDF, TXT herunterladen oder online auf Scribd lesen
Sie sind auf Seite 1von 1
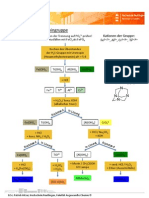
Ch 11, Lang katalytischer Zerfall von Wasserstoffperoxid
Wasserstoffperoxid (H2O2) zerfällt bei Raumtemperatur sehr langsam in Wasser und Sauerstoff:
2 H2O2 (aq) 2 H2O (l) + O2 (g)
Es gibt verschiedene Katalysatoren, die diese Reaktion beschleunigen.
Versuch 1: Katalysator Fe3+-Ionen
Material: Reagenzglasständer, Pipette, 2 Reagenzgläser
Chemikalien: 8 mL Eisenchlorid-Lösung (enthält Fe3+-Ionen), 4 mL Wasserstoffperoxid-Lösung
Durchführung:
Beobachtung:
Auswertung:
a) Wie kann man nachweisen, dass tatsächlich Sauerstoff entsteht?
b) Fe3+-Ionen sind in Lösung orange. Woran erkennt man, dass sie bei dieser Reaktion nicht
verbraucht werden?
Versuch 2: Katalysator Braunstein-Pulver (MnO2)
Material: Reagenzglasständer, Reagenzglas mit Braunstein, Pipette
Chemikalien: ca. 1 mL Wasserstoffperoxid-Lösung
Durchführung:
Beobachtung:
Auswertung:
Wodurch unterscheiden sich die beiden Katalysatoren?
Das könnte Ihnen auch gefallen
- Biologie Experiment Katalase EnzymeDokument3 SeitenBiologie Experiment Katalase EnzymeTobias BalzerNoch keine Bewertungen
- Lehramt 1bDokument79 SeitenLehramt 1bJonas SchlagintweitNoch keine Bewertungen
- FragenausarbeitungDokument30 SeitenFragenausarbeitungTrummelbummel FriedlichNoch keine Bewertungen
- Uebungsaufgaben Allgemeine Chemie - KrausDokument15 SeitenUebungsaufgaben Allgemeine Chemie - KrausNafasNoch keine Bewertungen
- Percobaan 7Dokument5 SeitenPercobaan 7Rani OktavianyNoch keine Bewertungen
- Subiecte Chimie Anorganică Bac 2022Dokument2 SeitenSubiecte Chimie Anorganică Bac 2022Otilia Serescu0% (1)
- Protokoll Untersuchung AbflussreinigerDokument3 SeitenProtokoll Untersuchung AbflussreinigerDarkdeomonNoch keine Bewertungen
- Chemical Properties of MetalsDokument7 SeitenChemical Properties of MetalsDAKSH GREAD DPSN-STDNoch keine Bewertungen
- Chemie Zusammenfassung Pharma KfuDokument40 SeitenChemie Zusammenfassung Pharma KfuDora RadmanovićNoch keine Bewertungen
- Praktikum KationDokument8 SeitenPraktikum KationReskiNoch keine Bewertungen
- ACHIIIDokument59 SeitenACHIIIGiacinto BarabassiNoch keine Bewertungen
- Seminar 0209Dokument201 SeitenSeminar 0209dominiktreo680Noch keine Bewertungen
- Stöchiometrie AufgabenDokument5 SeitenStöchiometrie AufgabenDaveNoch keine Bewertungen
- Einführung in Die Allgemeine Und Anorganische Chemie 3Dokument7 SeitenEinführung in Die Allgemeine Und Anorganische Chemie 3David AhouaNoch keine Bewertungen
- E D Chimie Anorganica 2024 Var Simulare LGEDokument2 SeitenE D Chimie Anorganica 2024 Var Simulare LGEMarin FlorinaNoch keine Bewertungen
- 2013 06 12 - Chemie Fuer Physiker - PraktikumDokument7 Seiten2013 06 12 - Chemie Fuer Physiker - PraktikumJulia DieterNoch keine Bewertungen
- Urotropingruppe TrennschemaDokument4 SeitenUrotropingruppe TrennschemaKerstin FreyNoch keine Bewertungen
- Artikel HasjaDokument19 SeitenArtikel HasjaWini NafisyahNoch keine Bewertungen
- Aufgaben Und Lösungen Des Auswahlverfahrens Und Der Chemie-OlympiadeDokument164 SeitenAufgaben Und Lösungen Des Auswahlverfahrens Und Der Chemie-OlympiadeQuoc AnhNoch keine Bewertungen
- U Êbungszettel2 UNT.059UBDokument2 SeitenU Êbungszettel2 UNT.059UBLukas M.Noch keine Bewertungen
- Fachsemester 2, Anorganische Chemie 1Dokument102 SeitenFachsemester 2, Anorganische Chemie 1fur den kriegNoch keine Bewertungen
- Chemie Protokoll LeChatelier (Schmidt)Dokument6 SeitenChemie Protokoll LeChatelier (Schmidt)Peter SchmidtNoch keine Bewertungen
- Chemie LernzettelDokument3 SeitenChemie LernzettelCreatainment DesignerNoch keine Bewertungen
- AT1-2016 ZusammenfassungDokument33 SeitenAT1-2016 ZusammenfassungAdrian Schießmich TodNoch keine Bewertungen
- Uebungsblatt 2-2020 - Loesungen-FreigeschaltetDokument9 SeitenUebungsblatt 2-2020 - Loesungen-FreigeschaltetFerryNoch keine Bewertungen
- 1 Chemie Ist Wie Wirtschaft: Chemie - Die Stimmt!" 2017/2018 Aufgabenblatt 2. Runde - Klasse 9Dokument5 Seiten1 Chemie Ist Wie Wirtschaft: Chemie - Die Stimmt!" 2017/2018 Aufgabenblatt 2. Runde - Klasse 9Quốc NguyễnNoch keine Bewertungen
- Stöch Thermo GrundlagenDokument2 SeitenStöch Thermo GrundlagenРенат ФайзрахмановNoch keine Bewertungen
- 2009 E Chimie Anorganica I Niv I Si II in Limba GermanaDokument4 Seiten2009 E Chimie Anorganica I Niv I Si II in Limba GermanadpNoch keine Bewertungen
- V7 489 PDFDokument3 SeitenV7 489 PDFTIMON GAMINGNoch keine Bewertungen
- Protokolle!Dokument18 SeitenProtokolle!Arbitro InternacionalNoch keine Bewertungen
- Veresterung Von Zitronensäure Mit Unterschiedlichen AlkoholenDokument9 SeitenVeresterung Von Zitronensäure Mit Unterschiedlichen AlkoholenJames BongNoch keine Bewertungen
- 3.1.A.Das Chemische Gleichgewicht PDFDokument9 Seiten3.1.A.Das Chemische Gleichgewicht PDFAisyah MusaNoch keine Bewertungen
- Dokument4 PDFDokument4 SeitenDokument4 PDFSarmad Abbas SyedNoch keine Bewertungen
- Seminar 10Dokument40 SeitenSeminar 10api-3697516100% (1)
- Kata PengantarDokument10 SeitenKata PengantarArdiva HumairaNoch keine Bewertungen
- EntwasserungProtokoll FINAL 5Dokument34 SeitenEntwasserungProtokoll FINAL 5bertrand NgansopNoch keine Bewertungen
- Chemische ZaubertricksDokument9 SeitenChemische ZaubertricksvolkersfuenfNoch keine Bewertungen
- ElementeDokument30 SeitenElementeDora RadmanovićNoch keine Bewertungen
- AB NachweisreaktionenDokument1 SeiteAB NachweisreaktionenayschabersNoch keine Bewertungen
- AnionennachweiseDokument35 SeitenAnionennachweiseanitram yoNoch keine Bewertungen
- Alte Chemie Klausuren Uni HamburgDokument20 SeitenAlte Chemie Klausuren Uni HamburgpanakosNoch keine Bewertungen
- FarbfilterDokument2 SeitenFarbfilterEmilia NietoNoch keine Bewertungen
- AB - Reaktionsgleichungen - Quali LösungDokument2 SeitenAB - Reaktionsgleichungen - Quali Lösungfirobo5722Noch keine Bewertungen
- Korrosion: Experimentalvortrag Vom 18.01.2007Dokument23 SeitenKorrosion: Experimentalvortrag Vom 18.01.2007Luca AndraeNoch keine Bewertungen
- ChemieDokument21 SeitenChemieaustroschrottyNoch keine Bewertungen
- Protokoll P9 Marvin Lütkenhaus Zweite Abgabe PDFDokument2 SeitenProtokoll P9 Marvin Lütkenhaus Zweite Abgabe PDFMarvin LütkenhausNoch keine Bewertungen
- 1 Einführung-Phys Geök Agw 2022Dokument15 Seiten1 Einführung-Phys Geök Agw 2022alexanderNoch keine Bewertungen
- Übungen Zum StöchiometrieDokument2 SeitenÜbungen Zum StöchiometrieДилшода ИсмоиловаNoch keine Bewertungen
- Guia Esteq 1°BDokument3 SeitenGuia Esteq 1°BPaola Casanova moragaNoch keine Bewertungen
- Prà Si CH - Wichtige S + BDokument9 SeitenPrà Si CH - Wichtige S + BOrangen BabaNoch keine Bewertungen
- Korrosion: SchulversuchspraktikumDokument15 SeitenKorrosion: SchulversuchspraktikumasdfasddfNoch keine Bewertungen
- ChemiefragenzweiDokument4 SeitenChemiefragenzweiAleks SohanNoch keine Bewertungen
- Ariane Brausam DissertationDokument223 SeitenAriane Brausam DissertationCypher CryptoNoch keine Bewertungen
- 2Cu+O 2 Fe+3Cuo Fe +3 CuDokument1 Seite2Cu+O 2 Fe+3Cuo Fe +3 CuYallah Habibbi Ich verbrenne deine NikesNoch keine Bewertungen
- TitrationDokument8 SeitenTitrationvtvuckovicNoch keine Bewertungen
- Coek - Info - Anodic Polarization of Platinum in Sodium ChlorideDokument10 SeitenCoek - Info - Anodic Polarization of Platinum in Sodium ChlorideEdgar HornusNoch keine Bewertungen
- Violetta Referat Schwefelsaeure KorrDokument2 SeitenVioletta Referat Schwefelsaeure KorrAa BbNoch keine Bewertungen
- BK01 - Nebenfach Chemie - Klausurfragen 13.07.07Dokument10 SeitenBK01 - Nebenfach Chemie - Klausurfragen 13.07.07script-bertNoch keine Bewertungen
- Gesetz B5 HEAT-GI S2021 LaborberichtDokument7 SeitenGesetz B5 HEAT-GI S2021 LaborberichtScribdTranslationsNoch keine Bewertungen