Beruflich Dokumente
Kultur Dokumente
Bin Dung
Hochgeladen von
api-3697516Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Bin Dung
Hochgeladen von
api-3697516Copyright:
Verfügbare Formate
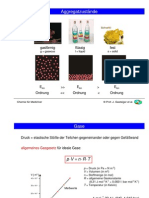
Grundtypen der chemischen Bindung
metallische Bindung
Atombindung
Wismut Ionenbindung
A B
Schwefel
gemeinsames
Elektronenpaar
Flußspat
Chemie für Mediziner © Prof. J. Gasteiger et al.
Oktettregel
Eine Valenzschale mit Edelgaskonfiguration (s2p6) ist energetisch besonders günstig
Li - e- Li+
He
1s2 1s2 2s 1s2
Ne - e- + + e-
Na Na F F-
2s2 2p6 2s2 2p6 3s 2s2 2p6 2s2 2p5 2s2 2p6
Ar - e- + + e-
K K Cl Cl-
3s2 3p6 3s2 3p6 4s 3s2 3p6 3s2 3p5 3s2 3p6
2 e- 2 e-
Mg2+ O2-
- +
Mg O
2s2 2p6 3s2 2s2 2p6 2s2 2p4 2s2 2p6
Chemie für Mediziner © Prof. J. Gasteiger et al.
Metallbindung
Metalle bestehen aus kleinen Kristallen. In diesen sind die Atomrümpfe periodisch
angeordnet, die Aussenelektronen sind frei beweglich. Sie bilden ein „Elektronengas“.
HPN Motorradtechnik
Seibersdorf
Chemie für Mediziner © Prof. J. Gasteiger et al.
Metallbindung
frei bewegliche Elektronen zwischen Atomrümpfen ⇒ „Elektronengas“
Metalle, Übergangsmetalle, Halbmetalle
Legierungen: Mischungen verschiedener Metalle (Schmelzen und Abkühlen)
Chemie für Mediziner © Prof. J. Gasteiger et al.
Ionenbindung
Kationen: Anionen:
• Abgabe von Elektronen • Aufnahme von Elektronen
Na Na Cl Cl
-e +e
1s2 2s2 2p6 3s 1s2 2s2 2p6 1s2 2s2 2p6 3s2 3p5 1s2 2s2 2p6 3s2 3p6
Ionisierungsenergie Elektronenaffinität
Ionengitter
Na+
heteropolare Bindung
Cl-
Chemie für Mediziner © Prof. J. Gasteiger et al.
Atom- und Ionenradien
Li Li+ F F-
Na Na+ Cl Cl-
+
K K+ + + Br Br-
- + --
+ +
Elektronenabgabe: - + - Elektronenaufnahme:
+ -- + +
Abnahme des Radius + - + Zunahme des Radius
- + -
Ionengitter
Chemie für Mediziner © Prof. J. Gasteiger et al.
Atombindung
auch: kovalente Bindung, homöo-polare Bindung
Zwei Atome haben mindestens ein gemeinsames Elektronenpaar.
Anzahl der Bindungen ist abhängig von der Anzahl der Valenzelektronen des Atoms.
Valenzelektronen ohne Bindung: freie Elektronenpaare
Bindungslänge: mittlerer Abstand zwischen den Atomkernen
Bindungsenergie: Energie, die bei Bildung der Bindung entsteht
Beispielmoleküle: H H H H
H Cl H Cl
O O
H H H H
Chemie für Mediziner © Prof. J. Gasteiger et al.
Atombindung
Wasserstoffgas
H + H H H H-H H2
1s 1s bindendes Elektronenpaar
Bindungslänge
74 pm
Fluorwasserstoffgas
H + F H F H-F HF
1s 2s2 2p5 bindendes
freies Elektronenpaar
Fluorgas
F + F F F F-F F2
Chemie für Mediziner © Prof. J. Gasteiger et al.
Bindigkeit
Wasser
-
H + O + H HOH H-O-H
- H2O
Sauerstoff ist zweibindig
Ammoniak
-
H + N + H HNH H-N-H NH3
-
H H
H Stickstoff ist dreibindig
H Methan
H H
- -
H + C + H HCH H-C-H CH4
H H
H
Kohlenstoff ist vierbindig
Chemie für Mediziner © Prof. J. Gasteiger et al.
Hybridorbitale (sp3)
Kohlenstoff C:
Grundzustand angeregter Zustand hybridisierter Zustand
2p2 2p3
Energie
(2sp3)4
2s2 2s
1s2 1s2 1s2
Methan: CH4 sp3-Hybridorbitale ⇒ Tetraeder
Chemie für Mediziner © Prof. J. Gasteiger et al.
Hybridorbitale (sp3)
s + px + py + pz 4 sp3-Orbitale
H
a = 109,5° H
C a
H H C
H
H H H
Abstoßung von 4 Orbitalen
ein Minimum ⇒Tetraeder
Chemie für Mediziner © Prof. J. Gasteiger et al.
C–C - Einfachbindung
C + C C C
Ethan C2H6:
H H H H
H
C C C C
H H H
H H H H σ-Bindung
freie Drehbarkeit
Chemie für Mediziner © Prof. J. Gasteiger et al.
Hybridorbitale (sp2)
Kohlenstoff C:
Grundzustand angeregter Zustand hybridisierter Zustand
2p2 2p3 pz
Energie
(2sp2)3
2s2 2s
1s2 1s2 1s2
sp2-Hybridorbitale + pz-
Orbital
Chemie für Mediziner © Prof. J. Gasteiger et al.
C=C - Mehrfachbindung
Ethen
C2H4:
H H H
H
C C C C
H H H H
Überlappung
keine freie Drehbarkeit
σ- und π-Bindung
Chemie für Mediziner © Prof. J. Gasteiger et al.
- und -Bindungen
σ-Bindungen:
• höchste Elektronendichte zwischen den beiden Atomen
• Rotation um Bindungsachse
π-Bindungen:
• auf der Bindungsachse keine Elektronendichte, sondern darüber und darunter
• Überlappung verhindert Drehbarkeit um Bindungsachse
Chemie für Mediziner © Prof. J. Gasteiger et al.
Mehrfachbindungen
Einfachbindung Zweifachbindung
H3C − CH3 H2C = CH2
σ-Bindungen σ- und π-Bindungen
3 2
sp -Hybridisierung sp -Hybridisierung
Chemie für Mediziner © Prof. J. Gasteiger et al.
sp3-Hybridisierung
NH3 und H2O haben ein Dipolmoment
CH4 NH3 H2O
H
C N O
a H b H H
g
H H H H H
a=109,5° b=107° g=105°
4 bindende 1 freies, 2 freie,
Elektronenpaare 3 bindende 2 bindende
Elektronenpaare Elektronenpaare
Chemie für Mediziner © Prof. J. Gasteiger et al.
Elektronegativität
Fähigkeit eines gebundenen Atoms, die an einer chemischen Bindung beteiligten
Elektronen anzuziehen (0 ≤ EN ≤ 4)
nimmt zu
nimmt ab
Chemie für Mediziner © Prof. J. Gasteiger et al.
polarisierte Atombindung
Atome ziehen aufgrund ihrer Elektronegativität (EN) Elektronen unterschiedlich stark an
⇒ polarisierte Atombindung ⇒ Dipolmoment
d+ d-
H-F
EN: 2.1 4.0
Dipolmoment
fliessender Übergang:
Na+ Cl-
d+ d-
H-Cl Cl-Cl
Ionenbindung polarisierte Atombindung
Atombindung
Chemie für Mediziner © Prof. J. Gasteiger et al.
Das könnte Ihnen auch gefallen
- Trocknung Von LösungsmittelnDokument31 SeitenTrocknung Von Lösungsmittelnmercator30104484100% (1)
- Oc EinfuehrungDokument6 SeitenOc Einfuehrungapi-3697516Noch keine Bewertungen
- KohlenhydrateDokument27 SeitenKohlenhydrateapi-3697516100% (1)
- CarbonylverbindungenDokument46 SeitenCarbonylverbindungenapi-3697516100% (1)
- HeterocyclenDokument19 SeitenHeterocyclenapi-3697516Noch keine Bewertungen
- KohlenwasserstoffeDokument38 SeitenKohlenwasserstoffeapi-3697516100% (1)
- StereochemieDokument24 SeitenStereochemieapi-3697516100% (1)
- FKT GruppenDokument33 SeitenFKT Gruppenapi-3697516100% (1)
- AminosaeurenDokument34 SeitenAminosaeurenapi-3697516100% (1)
- Fragen Zur Mineralogie2Dokument1 SeiteFragen Zur Mineralogie2api-3697516Noch keine Bewertungen
- ZF MaterieDokument9 SeitenZF Materieapi-3697516Noch keine Bewertungen
- Fragen Zur Mineralogie 4Dokument2 SeitenFragen Zur Mineralogie 4api-3697516Noch keine Bewertungen
- Fragen Zur Mineralogie1Dokument1 SeiteFragen Zur Mineralogie1api-3697516Noch keine Bewertungen
- Fragen Zur Mineralogie 3Dokument1 SeiteFragen Zur Mineralogie 3api-3697516Noch keine Bewertungen
- SaeurenDokument23 SeitenSaeurenapi-3697516100% (1)
- AtombauDokument13 SeitenAtombauapi-3697516Noch keine Bewertungen
- SalzloesungenDokument11 SeitenSalzloesungenapi-3697516Noch keine Bewertungen
- ReaktionenDokument12 SeitenReaktionenapi-3697516100% (2)
- KomplexeDokument16 SeitenKomplexeapi-3697516Noch keine Bewertungen
- Geo Ue 11Dokument2 SeitenGeo Ue 11api-3697516Noch keine Bewertungen
- KinetikDokument27 SeitenKinetikapi-3697516100% (1)
- Geo Ue 12Dokument1 SeiteGeo Ue 12api-3697516Noch keine Bewertungen
- Het GleichgewDokument28 SeitenHet Gleichgewapi-3697516Noch keine Bewertungen
- Geo Ue 08Dokument2 SeitenGeo Ue 08api-3697516Noch keine Bewertungen
- Geo Ue 06Dokument1 SeiteGeo Ue 06api-3697516Noch keine Bewertungen
- Geo Ue 05Dokument1 SeiteGeo Ue 05api-3697516Noch keine Bewertungen
- Geo Ue 07Dokument1 SeiteGeo Ue 07api-3697516Noch keine Bewertungen
- Geo Ue 09Dokument1 SeiteGeo Ue 09api-3697516Noch keine Bewertungen
- Geo Ue 04Dokument1 SeiteGeo Ue 04api-3697516Noch keine Bewertungen
- Pricelist DMS ResselerDokument10 SeitenPricelist DMS ResselerFiqiDaynulIqbalNoch keine Bewertungen
- Anorganische Bindemittel: Baustoffkunde 2 - Grundlagen Der Betontechnologie Prof. Dr.-Ing Thomas MatscheiDokument54 SeitenAnorganische Bindemittel: Baustoffkunde 2 - Grundlagen Der Betontechnologie Prof. Dr.-Ing Thomas MatscheiNguyen VinhNoch keine Bewertungen
- 39ED539E-5BFF-4546-AF13-D64F81193A86 (1)Dokument2 Seiten39ED539E-5BFF-4546-AF13-D64F81193A86 (1)John WongNoch keine Bewertungen