Beruflich Dokumente
Kultur Dokumente
Polarimetrie
Hochgeladen von
Sabine KrollertCopyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Polarimetrie
Hochgeladen von
Sabine KrollertCopyright:
Verfügbare Formate
1/4 2.2.
7 Optische Drehung
9.5/2.02.07.00 Die spezifische Drehung ist eine Stoffkonstante
und ist der Wert, der unter definierten Bedingun-
Methoden der
2.2.7 gen erhalten wird. Im SI-System ist die spezifische
Physik
Drehung [αm]Tλ definiert als der Drehwinkel, ange-
Optische Drehung geben in Radiant (rad), einer Lösung von 1 kg
Substanz in 1 m3 Lösung, gemessen bei einer
Schichtdicke von 1 m bei der Temperatur T und
Die Polarimetrie als Verfahren zur Bestimmung
der Wellenlänge λ.
der optischen Drehung gehört zu den chiroptischen
Verfahren, die auf der Wechselwirkung zwischen Das Arzneibuch verwendet die sog. konventionelle
polarisierter elektromagnetischer Strahlung und Definition, die die spezifische Drehung [α] 20
D bei
chiralen Substanzen beruhen und zur Charakteri- einer Temperatur von 20 °C und der Wellenlänge
sierung der Stereochemie von Verbindungen die- 589,3 nm (D-Linie des Natriumlichts) bestimmt.
nen. Die Polarimetrie ist die Messung der Drehung Diese ergibt sich nach:
der Ebene von linear polarisiertem Licht. In der α
Regel werden Lösungen vermessen, das Phäno- D =
[α] 20 (Gl. 1)
c×l
men wird aber auch z. B. bei Kristallen beobachtet.
Siehe auch Lit.1). α = Drehwinkel gemessen in Grad (°) bei 20 °C
bei 289,3 nm
Allgemeine Grundlagen c = Konzentration der Substanz von 1 g/ml
l = Schichtdicke der Küvette 1,00 dm
Die Fähigkeit von Substanzen, die Polarisations-
ebene von eingestrahltem linear polarisiertem Einheit ist (°) ∙ ml ∙ dm–1 ∙ g–1. Da diese Einheit
Licht zu drehen, wird als optische Aktivität be- unhandlich ist, gibt das Arzneibuch nur den Zah-
zeichnet. Wird die Ebene des auf den Betrachter lenwert ohne Einheit für die spezifische Drehung
zukommenden Lichtstrahls im Uhrzeigersinn ge- an. Die in der Literatur häufig anzutreffende An-
dreht, spricht man von rechtsdrehend und verwen- gabe mit der Einheit Grad (°) ist falsch.
det in der Nomenklatur das Präfix (+), während bei Da sich nur wenige Substanzen in Konzentratio-
Drehung entgegen dem Uhrzeigersinn von links- nen von 1 g/ml lösen, wird üblicherweise die Kon-
drehend gesprochen und das Präfix (–) verwendet zentration auf Volumina von 100 oder 1000 ml be-
wird. zogen. Wird die Konzentration in g pro 1000 ml
Optische Aktivität wird bei chiralen Verbindungen angegeben, muss mit dem Faktor 1000 multipli-
beobachtet, d. h. bei Verbindungen mit stereogenen ziert werden:
Elementen wie Chiralitätszentren, Chiralitäts- 1000 ⋅ α
achsen oder Chiralitätsebenen. Enantiomere dre- D =
[α] 20 (Gl. 2)
c⋅l
hen die Ebene des polarisierten Lichts um den
gleichen Betrag entweder nach links oder nach Bei einer Konzentration in g pro 100 ml muss in
rechts. Diastereomere weisen unterschiedliche Gleichung 2 der Faktor 100 statt 1000 eingesetzt
Drehwerte und Drehrichtungen auf. Optisch inak- werden. Für die Angabe der spezifischen Drehung
tive Substanzen führen wie Racemate zu keiner ist immer das Lösungsmittel mitanzugeben, da die
Drehung der Polarisationsebene des Lichts. spezifische Drehung vom verwendeten Lösungs-
Die optische Drehung ist der Winkel α in Grad (°), mittel abhängt.
um den die Schwingungsebene linear polarisierten Die spezifische Drehung unverdünnter Flüssigkei-
Lichts beim Durchgang durch die Lösung einer ten ergibt sich nach:
Substanz gedreht wird. Der Wert ist abhängig von α α
der Wellenlänge des linear polarisierten Lichts, der D =
[α] 20 = (Gl. 3)
ρ20 ⋅ l d 20
20 ⋅ l
Temperatur, der Schichtdicke der durchstrahlten
Probe und im Falle von Lösungen von der Konzen- α = Drehwinkel gemessen in Grad (°)
tration sowie dem Lösungsmittel (genau genommen ρ20 = Dichte der Flüssigkeit in g ∙ cm3
dem Brechungsindex des Lösungsmittels) und bei d 20
20
= relative Dichte der Flüssigkeit
wässrigen Lösungen auch dem pH-Wert. l = Schichtdicke der Küvette (1,00 dm)
Kommentar zur Ph. Eur. 9.5 62. Lfg. 2019
2.2.7 Optische Drehung 2/4
Die Messung kann auch bei anderen Wellenlängen Helligkeit auf Teilflächen des Sichtbereichs ermit-
oder Temperaturen sowie Küvettenmaßen erfol- telt. Da das menschliche Auge maximale Dunkel-
gen. Abweichende Temperatur und Wellenlänge heit nur schwer einschätzen kann, arbeitet man mit
werden bei der spezifischen Drehung entsprechend der sog. Halbschattenmethode, bei der der Sichtbe-
25
angegeben, z. B. [α] 580 für die Messung bei 25 °C reich im Okular in Bereiche unterteilt ist, die auf
und der Wellenlänge von 580 nm. gleiche Helligkeit eingestellt werden. Dabei wird
ein zusätzliches Element in den Strahlengang ein-
gebracht, das die Ebene des im Polarisator erzeug-
Apparatur ten Lichts um einen bestimmten Winkel dreht, so-
dass dieser bei paralleler Stellung von Polarisator
Die Messung der optischen Drehung erfolgt im
und Analysator dunkler oder heller erscheint.
Prinzip mit zwei Polarisatoren, wobei der erste zur
Beim Halbschattenpolarimeter nach Laurent, das
Erzeugung des linear polarisierten Lichts und der
Grundlage vieler kommerzieller Geräte ist, wird
zweite als Analysator dient. Polarisiertes Licht
eine dünne Quarzplatte (Laurent-Platte, λ/2-Quarz-
kann aus polychromatischem Licht mit Hilfe von
platte) meist in der Mitte des Strahlengangs zwi-
Prismen, die aus optisch anisotropen Medien auf-
schen Polarisator und Probenküvette platziert, so-
gebaut sind, z. B. dem Nicolschen Prisma oder
dass im mittleren Bereich des Sichtfensters die Po-
dem Glan-Thomson-Prisma, sowie mit Polarisa-
larisationsebene des Lichts um einen zusätzlichen
tionsfiltern oder Polarisationsfolien erhalten wer-
Winkel verdreht ist und eine Dreiteilung mit heller
den. Als Lichtquelle dient eine Natriumdampflam-
oder dunkler Mitte beobachtet wird (Abb. 1).
pe, in kommerziellen Geräten häufig auch eine
Dreht man den Analysator so, dass der hellere Teil
LED-Leuchte unter Verwendung eines Filters zur
des Sichtbereichs dunkler wird, hellt sich der zu-
Erzeugung des monochromatischen Lichts von
vor dunklere Teil auf; bei Drehung des Analysators
589 nm. Meist liegen Polarisator und Analysator in
um 360 ° erscheinen dann die Bereiche des Sicht-
gekreuzter Stellung (um 90 °), in diesem Fall ge-
felds in zwei Stellungen gleich hell und in zwei
langt kein Licht zum Betrachter. Bringt man eine
Stellungen gleich dunkel. Die dunklere Halbschat-
optisch aktive Substanz zwischen den Polarisato-
tenstellung wird vom menschlichen Auge am bes-
ren ein, so fällt Licht durch den gekreuzten Analy-
ten wahrgenommen und daher zum Nullabgleich
sator, sodass dieser um einen anderen Winkel als
herangezogen. Wird eine optisch aktive Substanz
90 ° bzw. 270 ° gedreht werden muss, um den ein-
in die Probenküvette eingebracht, so hellen sich
fallenden Lichtstrahl auszublenden. Die Differenz
Bereiche des Sichtfelds in Abhängigkeit des
des Winkels zur ursprünglichen gekreuzten Stel-
Drehwinkels auf, die durch eine erneute Drehung
lung des Analysators entspricht der optischen Dre-
des Analysators kompensiert werden. Die Diffe-
hung der Probe. Alternativ kann auch mit parallel
renz der Winkel des Analysators zum Nullabgleich
ausgerichtetem Polarisator und Analysator gear-
entspricht der optischen Drehung der Probe. Die
beitet und die maximale Helligkeit zur Auswer-
Ablesegenauigkeit von Halbschattenpolarimetern
tung herangezogen werden.
liegt bei 0,1 bis 0,05 °.
Bei den einfachen, manuellen Halbschattenpola-
rimetern wird die optische Drehung mit Hilfe der
62. Lfg. 2019 Kommentar zur Ph. Eur. 9.5
3/4 2.2.7 Optische Drehung
Grafik
Methoden der
Physik
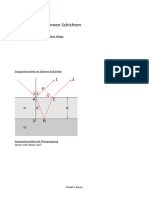
Abb. 1: Schematischer Aufbau und Funktionsweise eines Halbschattenpolarimeters nach Laurent; bei paralleler
Stellung des Analysators A zum Polarisator P bzw. zum Bereich des Laurent-Plättchens Q erscheint der jeweils
andere Sichtfeldbereich dunkler. Nur wenn der Winkel des Analysators zur Schwingungsebene des Lichts von
Polarisator und Laurent-Plättchen gleich ist, erscheinen alle Sichtfeldbereiche gleich dunkel. Zur Auswertung
wird meist die Stellung des Analysators genutzt, bei der beide Strahlen maximal gesperrt werden und das Sicht-
feld somit maximal dunkel erscheint (untere Reihe ganz rechts).
Bei lichtelektrischen, automatischen Polarimetern quelle, welche die erforderliche Wellenlänge von
werden ein Polarisator und ein gekreuzter Analy- 589 nm oder eine andere in der Monographie vor-
sator eingesetzt. Die Helligkeit des Lichtstrahls geschriebene Wellenlänge liefert. Bei polychroma-
nach Durchgang durch die Probe wird mit Hilfe tischen Lichtquellen kann Licht der erforderlichen
einer Fotozelle gemessen und ein Elektromotor Wellenlänge mit Hilfe von Prismen oder Filtern er-
dreht den Analysator, bis wieder maximale Dun- zeugt werden. Obwohl die Wellenläge der Natrium-
kelheit erreicht ist. Die Anzeige des Drehwinkels linie 589,3 nm beträgt, schreibt das Arzneibuch
erfolgt in der Regel digital. Moderne Polarimeter 589 nm vor, da Licht dieser Wellenlänge bei Gerä-
verwenden einen zwischen Probenküvette und ten erhalten wird, die keine Natriumdampflampe
(fixiertem) Analysator platzierten Faraday-Modu- verwenden, was in kommerziellen Geräte meist
lator, um die durch eine optisch aktive Substanz der Fall ist. In der Regel wird mit einer 1,00-dm-
verursachte Drehung der Polarisationsebene des Küvette gearbeitet. Das Detektionssystem muss
Lichts zu kompensieren. Der Modulator besteht eine Ablesegenauigkeit von mindestens 0,01 ° zu-
aus einem von einer Magnetspule umgebenen lassen (sofern in der Monographie nichts anderes
Glasstab. Beim Anlegen einer Spannung wird die vorbeschrieben ist). Diese wird in der Regel nur
Ebene des durch den Stab geleiteten Lichtstrahls von lichtelektrischen Polarimetern erreicht. Das
in Abhängigkeit von der Höhe und Polarität der zur Temperierung verwendete System muss eine
Spannung gedreht. Die Regulation wird über die Ablesegenauigkeit der Temperatur von 0,1 °C er-
Lichtintensität gesteuert, die auf eine Fotozelle lauben und die Küvette auf ± 0,5 °C der anforder-
fällt, sodass die mechanische Steuerung des Ana- ten Temperatur (meist 20 °C) temperieren. Das
lysators nicht erforderlich ist. In modernen Gerä- Element kann im Gerät verbaut sein (z. B. ein
ten mit Faraday-Modulator kann eine Messunsi- Peltier-Element) oder die Temperierung kann mit
cherheit von ≤ 0,001° erreicht werden. Hilfe eines Umlaufkryostaten erfolgen.
Das Arzneibuch fordert zur Messung der optischen
Drehung Polarimeter mit einer geeigneten Licht-
Kommentar zur Ph. Eur. 9.5 62. Lfg. 2019
2.2.7 Optische Drehung 4/4
Leistungsfähigkeit der vorgeschrieben ist. Bei der Messung von reinen
Flüssigkeiten wird der Nullpunkt gegen die leere
Apparatur
Küvette bestimmt. Anschließend wird die Probe in
Die Kontrolle der Skala des Polarimeters kann mit die Küvette gefüllt und der Drehwinkel gemessen.
dünnen, achsensenkrecht und planparallel geschlif- Die Berechnung der spezifischen Drehung erfolgt
fenen (zertifizierten) Quarzplättchen erfolgen. Die für Lösungen bzw. reine Flüssigkeiten nach Glei-
optische Drehung dieser Plättchen wird durch de- chung (2) bzw. (3). Das Arzneibuch macht keine
ren Dicke bestimmt. Andere zertifizierte Referenz- Aussage über die Anzahl der Wiederholungsmes-
materialien wie Saccharose-Lösungen sind zuläs- sungen, nach allgemeinen analytischen Regeln
sig. Saccharose-Lösungen eignen sich auch zur sollten aber 5 bis 6 Messungen durchgeführt wer-
Prüfung des linearen Bereichs des Geräts, der für den. Zeigen Stoffe Mutarotation, d. h. ändert sich
quantitative polarimetrische Bestimmungen unab- die optische Drehung mit der Zeit bis zur Einstel-
dingbar ist. Derartige Messungen können z. B. zur lung eines Gleichgewichts (z. B. bei Glucose),
Gehaltsbestimmung von stereoisomerenreinen Ver- muss die Einstellung des Gleichgewichts bis zum
bindungen herangezogen werden (dies wird im Ablesen des Messwerts abgewartet werden.
Arzneibuch nicht eingesetzt) oder zur Bestimmung Optische Drehung und spezifische Drehung wer-
der Enantiomerenzusammensetzung einer nichtra- den im Arzneibuch zur Identifizierung und bei
cemischen Mischung. Siehe Tab. 1 zur Korrelation Reinheitsprüfungen von Arznei- und Hilfsstoffen
zwischen Konzentration, Temperatur und Dreh- sowie bei einigen Peptiden und ätherischen Ölen
winkel von Saccharose-Lösungen. herangezogen.
Tab. 1: Drehwinkel von Saccharose-Lösungen Die spezifische Drehung wird häufig für stereo-
(Schichtdicke 2,00 dm) isomerenreine Substanzen vorgeschrieben, z. B.
bei der
Konzen-
– Prüfung auf Identität als stoffspezifische Größe
tration Drehwinkel α
(g/100 ml) und ggf. zur Unterscheidung von racemischer
15,0 °C 20,0 °C 25,0 °C 30,0 °C
Substanz
– Prüfung auf Reinheit zur Begrenzung des ande-
10,0 13,35 13,34 13,33 13,31
ren Enantiomers. Bei geringer spezifischer Dre-
20,0 26,67 26,64 26,61 26,58 hung ist die Aussagekraft der Prüfung begrenzt,
30,0 39,94 39,90 39,86 39,82 da erst ein relativ hoher Anteil des anderen
40,0 53,18 53,12 53,06 53,01 Enantiomers zur Abweichung vom erlaubten
50,0 66,37 66,30 66,23 66,16 Grenzwert führt.
Die optische Drehung wird bestimmt bei der
– Prüfung auf Identität racemischer Verbindungen,
Verfahren
wenn auch ein reines Enantiomer des Arznei-
Die Messungen erfolgen, falls in der Monographie stoffs gehandelt wird. Hierbei wird im Prinzip
nicht anders vorgeschrieben, bei 589 nm und einer auf die Abwesenheit einer optischen Drehung
Temperatur von 20 ± 0,5 °C. Zunächst wird der geprüft.
Nullpunkt des Geräts bestimmt. Dazu wird die – Prüfung auf Reinheit racemischer Verbindungen
Küvette mit dem Lösungsmittel gefüllt, in dem zum Ausschluss oder zur Begrenzung eines
auch die Probe gelöst ist. Die Bestimmung erfolgt Enantiomerenüberschusses.
selbstverständlich mit geschlossener Probenkam- G. Scriba
mer und bei der gleichen Messwellenlänge und
Temperatur wie für die Bestimmung der Substanz
Literatur
1) Rücker/Neugebauer/Willems.
62. Lfg. 2019 Kommentar zur Ph. Eur. 9.5
9.3/1807
1/11 Zubereitungen zur Anwendung in der Mundhöhle
Zubereitungen zur Anwendung
in der Mundhöhle
Praeparationes buccales
Darreichungsformen
Allgemeine Angaben Die einzelnen Bereiche der Mundhöhle charakteri-
sieren erhebliche Unterschiede hinsichtlich des
Zubereitungen zur Anwendung in der Mundhöhle Resorptionsvermögens. Dieses ist abhängig von
haben in den vergangenen Jahren an Bedeutung der Dicke und Keratinisierung der Schleimhaut
gewonnen, wenn auch die meisten Arzneimittel und dem Grad ihrer Durchblutung. Die sublingua-
nach wie vor peroral verabreicht werden. Sie wer- le Region hat die größte Durchlässigkeit für Arz-
den zur lokalen Therapie von Erkrankungen der neistoffe, eine etwas geringere hat die buccale. Der
Mundhöhle oder des Rachenraums eingesetzt; au- Gaumen ist am wenigsten durchlässig.
ßerdem eignet sich der Mund-Rachen-Raum – ins- Die Applikation von Wirkstoffen in der Mundhöh-
besondere bei buccaler oder sublingualer Applika- le kann in drei Kategorien1, 2), durch die Aufnah-
tion – zur Erzielung einer systemischen Wirkung men von Schmelzfilmen in vier Kategorien unter-
ohne Beeinflussung durch Magen-Darm-Trakt und teilt werden:
First-pass-Effekt in der Leber. – Lokale Applikation: Der Wirkstoff soll in der
Mundhöhle oder im Rachenraum freigesetzt
Die in dieser Monographie beschriebenen Schmelz-
werden, er kann seine Wirkung lokal in der
filme gehören zu den orodispersiblen Arzneifor-
Mundhöhle und im Rachenraum entfalten, oder
men. Einer der wichtigsten Anwendungsvorteile
er wird in der Mundhöhle resorbiert.
dieser Darreichungsformen ist, dass sie in der
– Sublinguale Applikation: Der Wirkstoff gelangt
Mundhöhle innerhalb von Sekunden zerfallen, also
über die Schleimhaut des Zungenuntergrundes
nicht als Ganzes geschluckt werden müssen und
zur Resorption und entfaltet eine systemische
ohne Wasser eingenommen werden können. Damit
Wirkung. Die relativ permeable und gut durch-
sind sie eine ideale Arzneiform insbesondere für
blutete Schleimhaut unter der Zunge ist ein
unterwegs, für Kinder, Ältere und Patienten mit
günstiger Applikationsort für Arzneistoffe, die
Schluckbeschwerden.
schnell resorbierbar sind und rasch wirken sol-
Zur Anatomie und Physiologie der Mundhöhle len. Für Applikationssysteme mit verlängerter
siehe Lit.1–3). Die die Mundhöhle auskleidende Wirkstofffreisetzung ist die sublinguale Appli-
Schleimhaut besteht aus mehreren unterschiedlich kation nicht geeignet, da durch den ständigen
aufgebauten Gewebeschichten (mehrschichtiges, Speichelfluss keine immobile Mucusschicht zur
unverhorntes Plattenepithel). Die oberste Schicht Fixierung einer Arzneiform vorhanden ist.
ist eine aus mehreren Zelllagen bestehende, etwa – Buccale Applikation: Durch transmukosale Re-
0,2 bis 0,6 mm dicke Deckschicht. Die Zellen ih- sorption aus der Backentasche soll eine systemi-
rer untersten Zelllage (Basalschicht) befinden sich sche Wirkung erzielt werden. Die buccale
ständig in Teilung. Sie wandern zur Oberfläche Schleimhaut ist zwar weniger durchlässig als die
und verändern sich dabei. Nach ein bis zwei Wo- sublinguale, sie ist aber von einer relativ immobi-
chen sind die Epithelzellen an der Oberfläche ab- len Mucusschicht bedeckt und der Speichelfluss
geschilfert und werden von Zellen aus der Basal- ist in dieser Region geringer. Das macht die buc-
schicht ersetzt. Auf diese Weise erneuert sich die cale Applikation für Arzneiformen, die ein Haften
Schleimhaut kontinuierlich. Unter der Basalzell- am Freigabeort erfordern, geeigneter.
schicht folgt die Lamina propria aus relativ locke- – Als alternative perorale Darreichungsform,
rem Bindegewebe mit Blutgefäßen, Nerven und durch die die Einnahme und das Schlucken von
Zellen des Immunsystems; außerdem sind hier die großen Darreichungsformen wie Tabletten oder
Endstücke der Speicheldrüsen lokalisiert. Kapseln vermieden werden kann.
Kommentar zur Ph. Eur. 9.3 62. Lfg. 2019
Zubereitungen zur Anwendung in der Mundhöhle 2/11
Für viele Zubereitungen, die im Mund angewendet Herstellung
werden, gilt jedoch, dass bestimmte Anteile des
Wirkstoffs verschluckt und über den Magen- Die Hilfsstoffe bei der Herstellung von Zuberei-
Darm-Trakt resorbiert werden. tungen zur Anwendung in der Mundhöhle entspre-
chen weitgehend denen, die für die Formulierung
der jeweiligen Arzneiform benötigt werden. Bei
ihrer Wahl ist jedoch zu berücksichtigen, dass sie
Definition auf der Schleimhaut lokal verträglich sein und ei-
In der Mundhöhle werden flüssige, halbfeste und nen akzeptablen Geschmack aufweisen müssen.
feste Arzneiformen angewendet. Die Ph. Eur. führt Auch bei der Anwendung in der Mundhöhle sind
Gurgellösungen, Mundwässer, Lösungen zur An- mikrobiologisch anfällige Zubereitungen zu kon-
wendung am Zahnfleisch, Lösungen und Suspen- servieren. Konservierungsstoffe5) sollen in gelöster
sionen zur Anwendung in der Mundhöhle, halbfes- Form vorliegen. Für Oralia wichtige Konservie-
te Zubereitungen zur Anwendung in der Mundhöh- rungsstoffe (typische Konzentrationen in Klam-
le, Tropfen zur Anwendung in der Mundhöhle, mern) sind Sorbinsäure (0,1 %) oder Kaliumsorbat
Sprays zur Anwendung in der Mundhöhle, Sublin- (0,14 %), Benzoesäure (0,1 %) oder Natriumben-
gualsprays, Lutschtabletten und Lutschpastillen, zoat (0,15 %), Methyl- und Propyl-4-hydroxy-
gepresste Lutschtabletten, Sublingualtabletten und benzoat (0,1 %) oder deren Natriumsalze (0,12 %)
Buccaltabletten, Kapseln zur Anwendung in der und eventuell Alkohole (etwa 20 %). Bei der Aus-
Mundhöhle, mucoadhäsive Zubereitungen und wahl eines Konservierungsstoffes sind der pH-Wert
Schmelzfilme auf. der Zubereitung und die Wirksamkeit des Konser-
vierungsmittels aufeinander abzustimmen5, 6).
Die Unterteilung des Arzneibuchs ist nicht immer
einleuchtend und entspricht auch nicht der Eintei- Prüfungen
lung anderer Monographien. So fragt man sich
beispielsweise, warum Gurgellösungen und Mund- Die international harmonisierte Prüfung 2.9.40
wässer getrennt behandelt werden oder warum Lö- (Ph. Eur.) ist seit der Ph. Eur. 5.4 gültig. Sie ersetzt
sungen, Emulsionen und Suspensionen nicht als die Prüfungen 2.9.5 und 2.9.6 (beide Ph. Eur.), die
flüssige orale Arzneiformen mit ihren unterschied- nur noch in begründeten und zugelassenen Fällen
lichen Möglichkeiten zur Dosierung und Appli- anstelle der Prüfung 2.9.40 durchgeführt werden
kation (Tropfen, Sprays, Applikatoren) zusam- dürfen (siehe auch die zugehörigen Kommentare).
mengefasst werden. Denn eine Flüssigkeit kann Die Ph. Eur. führt die Prüfung auf Wirkstoff-
zwar als „Tropfen“ bezeichnet werden, aber in freisetzung nicht allgemein auf. Sie wird seit der
Form einer Lösung, Emulsion oder Suspension Ph. Eur. 9.3 für „Gepresste Lutschtabletten“, „Sub-
vorliegen. Auch Lösungen und Gele zur Anwen- lingual- und Buccaltabletten“, „Mucoadhäsive Zu-
dung am Zahnfleisch könnten zusammengefasst bereitungen“ und „Schmelzfilme“ gefordert. Diese
werden. Prüfung spielt bei der Entwicklung und Qualitäts-
Insbesondere bei den Arzneiformen zum raschen kontrolle von festen und halbfesten Zubereitungen
Zerfall in der Mundhöhle haben die Arzneibücher zur Anwendung in der Mundhöhle eine wesent-
mit der rasanten Entwicklung neuer Formen nicht liche Rolle. Da sie sich in ihrer Zusammensetzung,
Schritt gehalten, sodass nicht nur in der Nomen- Herstellung und in ihren Eigenschaften stark un-
klatur [z. B. fast disssolving drug formulations terscheiden, sind verschiedenartige Testsysteme
(FDDF), rapidly dissolving dosage forms (RDDF), erforderlich. Lit.7–9) sowie die Literaturangaben zu
Schmelztablette, orally disintegrating tablets den Prüfungen bei den mucoadhäsiven Zuberei-
(ODTs)] Verwirrung entstanden ist4), man vermisst tungen und Schmelzfilmen zeigen den Stand der
in der vorliegenden Monographie auch die Auf- Diskussion und potentielle Prüfmethoden zu Zer-
nahme orodispersibler Tabletten wie beispielswei- fall und Wirkstofffreisetzung auf.
se Zofran Zydis®, Tavor expidet® oder Imodium
akut lingual®, die in der Monographie Tabletten Beschriftung
(Ph. Eur.) als „Schmelztabletten“ bzw. „Lyophili- Zugesetzte Konservierungsmittel müssen angege-
sate“ aufgeführt sind. ben werden. Konservierungsmittel werden nur für
62. Lfg. 2019 Kommentar zur Ph. Eur. 9.3
3/11 Zubereitungen zur Anwendung in der Mundhöhle
mikrobiell anfällige Zubereitungen benötigt. Wer- den Produkte mit hauptsächlich therapeutischen,
den sie eingesetzt, müssen neben der Kompatibili- daneben auch kosmetischen Funktionen bezeich-
tät mit allen weiteren Bestandteilen auch die pH- net. Sie dienen vorwiegend der Prophylaxe von
Optima sowie der Geschmack der verwendeten Zahn- und Zahnfleischerkrankungen wie Karies,
Substanzen beachtet werden. Gingivitis und Parodontitis und der Beseitigung
Darreichungsformen
oder Überdeckung von Mundgeruch. Darüber hin-
aus werden sie auch zur Therapie von Erkrankun-
Gurgellösungen gen der Mundschleimhaut eingesetzt, beispiels-
weise bei Mukositis (Stomatitis) nach Chemothe-
Gurgellösungen wirken in der Regel an anderen rapie und Bestrahlung13).
Zielorten als Mundwässer, teilen jedoch mit diesen
viele Gemeinsamkeiten; einige Handelspräparate Im DAC werden unter „Mundspülungen“ mehrere
sind daher auch als Gurgel- und Mundwässer de- Mukositis-Zubereitungen beschrieben und disku-
klariert. Gurgellösungen dienen zur Prophylaxe tiert12).
oder Behandlung von Entzündungen des Rachen- Neuere Mundwässer und Mundspüllösungen ent-
raums während Mundwässer bei ihrer Anwendung halten als antiseptische Wirkstoffe gegen Plaque-
in Kontakt mit der Mundschleimhaut und den Bakterien z. B. Cetylpyridiniumchlorid, Chlor-
Zahnoberflächen treten. hexidin, Hexetidine, als Wirkstoffe gegen Zahn-
steinbildung spezielle Zinkverbindungen und als
Wirkstoffe zur Remineralisierung des Zahnes Flu-
Mundwässer oride und Fluorid-abspaltende Verbindungen10, 11).
Der Begriff „Mundwässer“10, 11) wird meist für Darüber hinaus können Harze, Adstringenzien
Produkte verwendet, die im Rahmen der Mundhy- (z. B. Aluminiumlactat oder Zinksalze) sowie
giene sowohl kosmetische als auch therapeutische Zahnfleisch und Mundschleimhaut pflegende Sub-
Funktionen erfüllen. Aromatisierte Mundwässer stanzen (α-Bisabolol, Vitamin A, Salbei u. a.) ent-
waren in der Vergangenheit lediglich zur Erfri- halten sein11).
schung des Mund- und Rachenraums und zur Ver- Die heute verwendeten Mundwässer10, 11) sind ge-
besserung des Mundgeruchs konzipiert; heute wer- brauchsfertige, wässrige, oft eingefärbte, meist
den auch Formulierungen angeboten, die Teilauf- auch Ethanol- und/oder 2-Propanol-haltige Lösun-
gaben der Zahnpflege übernehmen. gen. Zusätzlich zu den Wirkstoffen enthalten sie
Mundwässer im engeren Sinne sind konzentrierte Hilfsstoffe, die für die Formulierung und den Er-
Ethanol-, 2-Propanol- und/oder 1,2-Propandiol- halt der Wirkstoffaktivität im Vehikel erforderlich
haltige Lösungen, die in der Regel vor der Anwen- sind. Feuchthaltemittel (z. B. Glycerol, Sorbitol,
dung mit Wasser verdünnt werden. Mundwässer in Xylitol) verhindern ein Austrocknen der Mund-
ihrer einfachsten Form enthalten hauptsächlich spüllösungen, besonders am Flaschenverschluss
ätherische Öle und Aromastoffe zur Erfrischung während der Lagerung, und geben ihnen „Körper“.
des Mund- und Rachenraums und zur Bekämpfung Schaummittel oder Tenside werden bis ca. 1 %
von Mundgeruch. Aromaöle werden in Konzentra- zur Solubilisierung der Aroma- und Wirkstoffe
tionen bis ca. 5 % in Mundwasserkonzentraten und verwendet. Da die Tenside in der Mundhöhle auch
bis zu 0,5 % in gebrauchsfertigen Mundwässern verschluckt werden können, müssen sie schleim-
eingesetzt. Für die häufig verwendeten Pfeffer- hautverträglich, toxikologisch unbedenklich und
minzöle aus Mentha piperita oder M. arvensis ist geschmacksneutral sein. Toxikologisch und kli-
der hohe Mentholgehalt typisch, der eine kühlende nisch geprüft und als unbedenklich eingestuft ist
Frische vermittelt11). Gebrauchsfertige Lösungen das in Zahnpflegemitteln weltweit verwendete
werden ebenfalls gelegentlich Mundwässer ge- Natriumlaurylsulfat. Daneben werden nichtioni-
nannt, aber meist zur Differenzierung als Mund- sche Tenside wie Polysorbate [z. B. Polyoxy-
spüllösungen bezeichnet. ethylen(20)sorbitanmonolaurat], Polyethylengly-
Die Ph. Eur. macht allerdings von dieser Unter- col-Derivate von hydriertem Rizinusöl (z. B. PEG-
scheidung keinen Gebrauch. Das NRF spricht von 40 Hydrogenated Castor Oil) oder Poly(oxypro-
Mundspülungen12). Als Mundspüllösungen10) wer- pylen)-poly(oxyethylen)-Blockpolymere (Pluro-
Kommentar zur Ph. Eur. 9.3 62. Lfg. 2019
Zubereitungen zur Anwendung in der Mundhöhle 4/11
nics®) eingesetzt. Der Zusatz von Konservierungs- Eugenol, Vitamin A und Pflanzenextrakte aus
mitteln und antimikrobiell wirksamen Stoffen sollte Aloe, Arnika, Calendula, Hamamelis, Myrrhe,
zum Schutz des Verbrauchers auf ein Minimum be- Rosmarin und Salbei. Gerbstoffe in den Pflanzen-
schränkt werden. Am häufigsten werden die Ester extrakten oder auch adstringierende Stoffe wie
der p-Hydroxybenzoesäure, Sorbinsäure oder Ben- Aluminiumlactat sind ebenfalls an der entzün-
zoesäure und ihre Salze eingesetzt. Ein gebräuchli- dungshemmenden Wirkung beteiligt11).
ches Süßungsmittel für Zahn- und Mundpflegemit-
tel ist das Natriumsalz des Saccharins, es ist im Ge-
gensatz zu Zucker nicht kariogen. Zum Färben von Lösungen und Suspensionen
Mundspüllösungen kommen nur wasserlösliche or- zur Anwendung in der Mund-
ganische Farbstoffe wie Patentblau V, Chinolingelb
und Cochenillerot zum Einsatz10). höhle
Den oralen Wirkstofflösungen oder Suspensionen
wird eine Reihe von Hilfsstoffen zugesetzt, welche
Lösungen zur Anwendung am die Löslichkeit, den Geschmack und die Applika-
Zahnfleisch tion verbessern sowie die Haltbarkeit gewährleis-
ten.
Die Mundhöhle ist natürlicherweise von Mikroor-
ganismen bevölkert. Bakterien können sich aber an Die meist wasserhaltigen, flüssigen, oralen Arznei-
Oberflächen von Zähnen anheften, wodurch der formen sind anfällig für mikrobielle Kontamina-
Plaquebildung Vorschub geleistet wird. Plaque ist tion. Um die Präparate während Lagerung und Ver-
die Hauptursache von Zahnfleischreizungen und brauch vor dem Verderb zu schützen, müssen sie
Entzündungen. Plaque-Bakterien geben neben konserviert werden. Dabei können einzelne Aro-
Säuren, die den Zahnschmelz angreifen und Karies mastoffe mit antibakteriellen Eigenschaften unter-
verursachen, auch Stoffwechselprodukte ab, die in stützend wirken6). Einschlussverbindungen mit
den Zahnfleischsaum eindringen und zu Irritatio- Cyclodextrinen zur Löslichkeitsverbesserung, Ge-
nen führen. Diese äußern sich in Schwellungen, schmacksüberdeckung und Stabilisierung sind be-
Rötungen bis hin zu Blutungen des Zahnfleisches schrieben.
und schließlich im enzymatischen Abbau des Bin- Gewisse Bedeutung hat auch die Solubilisierung
degewebes zwischen Zähnen und Zahnfleisch. Ei- mittels Tensiden.
ne ungezielte Behandlung der gesamten Mundhöh- Liegt der optimale Wirkungsbereich einer Sub-
le mit Antibiotika würde das „Biotop Mundhöhle“ stanz in einem bestimmten pH-Bereich, bei Nysta-
negativ beeinflussen, da neben pathogenen Kei- tin-Suspensionen beispielsweise bei pH 4 bis 6,
men auch die physiologische Mundflora zerstört sollte dieser, wenn mit Stabilität und Verträglich-
werden könnte. Mit Applikatoren können Lösun- keit vereinbar, durch Pufferung eingestellt werden.
gen oder halbfeste Zubereitungen gezielt auf Lokal anzuwendende Nystatin- oder Amphoteri-
begrenzte Bereiche des Zahnfleisches appliziert cin-B-haltige Suspensionen spielen bei der Be-
werden, wodurch lokal eine höhere Wirkstoffkon- handlung von Mundsoor (z. B. Nystatin Lederle®,
zentration, insbesondere in Zahnfleischtaschen, Ampho-Moronal®) eine Rolle. Die betroffenen
erreicht werden kann. Untersuchungen zur Sen- Partien sollten dabei möglichst lange mit dem
kung der Postextraktions-Bakteriämie zeigten, Wirkstoff in Berührung kommen. Neben Suspensi-
dass Mundspülungen die subgingivale Plaque nur onen sind Lutschtabletten geeignet, die im Mund
unzureichend erreichen, während dies bei geziel- zergehen und so lange auf die befallenen Stellen
tem Aufsprühen möglich war14). Durch den Einsatz einwirken können3).
von Gelen und Pasten kann die Haftfähigkeit der
Zubereitung und dadurch ihre Verweil- und Ein-
wirkungsdauer erhöht werden. Ergänzend zu der Halbfeste Zubereitungen zur
sorgfältigen Reinigung als bestem Zahnfleisch-
schutz können entzündungshemmende Stoffe ein- Anwendung in der Mundhöhle
gesetzt werden. Es sind dies u. a. Wirkstoffe der Halbfeste Zubereitungen werden hauptsächlich in
Kamille wie Bisabolol und Chamazulen, außerdem Form von hydrophilen Gelen und Pasten als Pro-
62. Lfg. 2019 Kommentar zur Ph. Eur. 9.3
9.5/1338
1/4 Lavendelöl
Lavendelöl
Lavandulae aetheroleum
Pflanzliche
Drogen
Allgemeine Angaben um durch rasche und schonende Destillation zu ei-
ner guten Qualität zu kommen.
In der Ph. Eur. 9.5 wurden die Identitätsprüfun-
Heutzutage werden im Wesentlichen zwei Qualitä-
gen A (DC) und B (GC) sowie die Reinheitsprü-
ten gehandelt, Lavendelöl 40/42 (Mont Blanc, bas
fung „Chromatographisches Profil“ modifiziert.
titrage) und das teurere Lavendelöl 50/52 (Bareme,
Die Ph. Eur. beschreibt auch Lavendelblüten und haut titrage); die Zahlen bezeichnen den Esterge-
Speiköl (Lavandula latifolia); siehe auch die zu- halt.
gehörigen Kommentare.
Produktionsstätten liegen in Südfrankreich, auch
in Norditalien, auf der Iberischen Halbinsel, dem
Definition Balkan und in Osteuropa. Echte Lavendelöle sind
teuer und werden häufig verfälscht1), vorzugsweise
Stammpflanze: Siehe den Kommentar zu Laven- mit dem wesentlich billigeren Lavandinöl (aus
delblüten (Ph. Eur.). L. x intermedia Emeric ex Loisel., siehe unter „In-
haltsstoffe“ und den Kommentar zu Lavendelblü-
Gewinnung: Zur Gewinnung des Öls werden die ten, Ph. Eur.) oder mit acetyliertem Lavandinöl.
Blüten und die oberen Stängelteile zur Blütezeit Auch werden andere natürliche Öle mit hohem Li-
geerntet, möglichst bei Sonnenschein, um trockene nalylacetat- oder Linaloolgehalt zugemischt (z. B.
Ware zu erhalten. Das Pflanzenmaterial wird un- das Japanische Shiuöl und Petitgrainöl) oder auch
mittelbar danach einer Wasserdampfdestillation synthetisches oder semisynthetisches Linalool und
mit separat erzeugtem Wasserdampf unterworfen, Linalylacetat.
Grafik
Kommentar zur Ph. Eur. 9.5 62. Lfg. 2019
Lavendelöl 2/4
Andere Drogennamen: Lavender oil (engl.); Prüfung auf Identität
Essence de lavande, Huile essentielle de lavande
(franz.); Lavanda essenza (ital.); Aceite esencial de A. Die DC, wie sie hier zur Untersuchung des La-
lavanda (span.) vendelöls eingesetzt wird, ist eine für ätheri-
sche Öle routinemäßig angewandte und gut
Inhaltsstoffe2, 3): Da Lavendelöl von verschiede- geeignete Adsorptionschromatographie an Kie-
nen Varietäten von Lavandula angustifolia gewon- selgel. Dafür kann sowohl eine konventionelle
nen wird, variiert seine Zusammensetzung inner- Kieselgelschicht (Korngröße 5 bis 40 μm) als
halb breiter Grenzen. Hauptbestandteil ist jedoch auch eine Hochleistungs-DC-Platte (HPTLC,
stets Linalylacetat (1; 30 bis 50 %), und zwar im Korngröße 2 bis 10 μm) verwendet werden. Als
natürlichen Öl das R-(−)-Enantiomer in hoher Referenzsubstanzen dienen Linalylacetat (1),
Enantiomerenreinheit (> 98 %)1, 4, 5); je höher der Linalool (2) und 1,8-Cineol (7). Entwickelt
Gehalt an Linalylacetat, desto wertvoller ist das wird mit dem für ätherische Öle üblichen
Öl. In bedeutender Menge enthält Lavendelöl auch Fließmittel Ethylacetat + Toluol (95 + 5). Die
Linalool [2; hauptsächlich (R)-(−)-Linalool], des- DC-Platte wird mit dem Universal-Reagenz
sen Anteil im Öl zwischen 20 und 45 % liegt. Die Anisaldehyd-Reagenz besprüht und anschlie-
Angaben zum Konzentrationsverhältnis von Lina- ßend erhitzt, womit eine farbliche Differenzie-
lylacetat und Linalool in der Literatur variieren rung der getrennten Substanzen erreicht wird
stark. Es wird durch die Art der Destillation beein- (Bildung von u. a. Triphenylmethanfarbstof-
flusst, da sich Linalylacetat während der Destilla- fen). Der Farbton ist jedoch nicht gut reprodu-
tion in Abhängigkeit von den Destillationsbedin- zierbar, sodass die Farbangaben im Arzneibuch
gungen und vom pH-Wert des Destillationswassers nur als Anhaltspunkte zu verstehen sind. Lina-
zu Linalool hydrolysiert oder durch Umlagerung lylacetat, Linalool und 1,8-Cineol können im
weitere Terpene entstehen, z. B. Geraniol, Nerol DC der Untersuchungslösung namentlich zu-
und α-Terpineol und deren Acetate6) oder auch geordnet werden; Abbildungen siehe Lit.7–9).
Monoterpen-Kohlenwasserstoffe (u. a. Limonen, Im Prinzip stellt die DC auch eine Reinheits-
Myrcen und Ocimen). prüfung dar, weil sich die Mengenverhältnisse
an Linalylacetat und Linalool im Chroma-
Weitere Bestandteile des Lavendelöls sind (Z)-β-
togramm gut abschätzen lassen und man über
Ocimen (3; ca. 3 bis 7 %), Terpinen-4-ol (4; 3 bis
die Zone des 1,8-Cineols (7), die nur sehr
5 %), β-Caryophyllen (5; 3 bis 5 %), Lavandulyl-
schwach ausgeprägt sein darf, auf Verwechs-
acetat (6; 2 bis 3 %) und 1,8-Cineol (7; 1 bis 2,5 %).
lungen/Verfälschungen mit Lavandinöl oder
In Konzentrationen um 1 % sind Limonen, Geraniol,
Speiköl aufmerksam werden kann (siehe unter
Lavandulol und α-Pinen enthalten. Erwähnenswert
„Inhaltsstoffe“).
ist noch Camphen (0,1 bis 0,5 %). Daneben kommen
B. Besser noch als die DC eignet sich die GC für
weitere Terpene in Spuren vor. An nicht-terpenoiden
die Identitätsprüfung. Dafür wird das Gas-
Inhaltsstoffen sind 3-Octanon (bis zu 5 %) und
chromatogramm der Reinheitsprüfung „Chro-
1-Octen-3-ol (0,5 bis 1 %) zu nennen.
matographisches Profil“ ausgewertet. Aus-
Lavandinöl (aus L. x intermedia) unterscheidet nahmsweise müssen bei der Identitätsprüfung
sich nur wenig vom Lavendelöl, enthält ähnliche des Lavendelöls auch die prozentuellen Gehal-
Konzentrationen an Linalylacetat (30 bis 50 %) te der wichtigsten Komponenten ausgewertet
und Linalool (25 bis 40 %), jedoch höhere Kon- werden. Diesbezüglich wird gefordert, dass die
zentrationen an Campher (5 bis 10 %) und 1,8- im „Chromatographischen Profil“ vorgegeben
Cineol (3 bis 8 %). Gehaltsgrenzen von 10 Ölkomponenten auch
Speiköl, aus den Blüten des Großen Speiks (auch bei der Identitätsprüfung eingehalten werden.
Spiklavendel oder Gewürzlavendel; Lavandula la- Damit können Verwechslungen mit Lavandinöl
tifolia Medik.) gewonnen, enthält als Hauptkom- und Speiklavendelöl erkannt werden (siehe un-
ponente Linalool (30 bis 50 %), kaum Linalylace- ter „Inhaltsstoffe“). Bei den zu betrachtenden
tat und wesentlich höhere Konzentrationen an 1,8- Ölkomponenten handelt es sich um Limonen,
Cineol (15 bis 40 %) und Campher (5 bis 25 %) 1,8-Cineol, 3-Octanon, Campher, Linalool Li-
(siehe den Kommentar zu Speiköl, Ph. Eur.). nalylacetat, Terpinen-4-ol, Lavandulylacetat,
62. Lfg. 2019 Kommentar zur Ph. Eur. 9.5
3/4 Lavendelöl
Lavandulol und α-Terpineol (steigende Reten- wichtige Rolle spielt (siehe unter „Inhaltsstoffe“),
tionszeit). Bei anderen ätherischen Ölen wer- wäre es sinnvoll, zusätzlich zu prüfen, ob sich dem
den im Rahmen der Identitätsprüfung keine Cineol-Peak nicht auch ein β-Phellandren-Peak
Pflanzliche
Drogen
quantitativen Forderungen gestellt, sondern nur überlagert, was häufig vorkommt; β-Phellandren
die Identifizierung der charakteristischen Peaks ist in fast allen ätherischen Ölen enthalten.
vorgenommen. Der große Vorteil der GC ist, dass sie auch eine
simultane quantitative Bestimmung aller Ölkom-
Prüfung auf Reinheit ponenten erlaubt. Sie erfolgt durch Peakflächen-
ermittlung und Normalisierung der Peakflächen
Optische Drehung: Obwohl Linalylacetat (1) und (100-%-Methode). Die Peak-Identifizierung wird
Linalool (2) im Lavendelöl jeweils in hoher Kon- durch das mitgelieferte Chromatogramm des Refe-
zentration und in hoher Enantiomerenreinheit vor- renzöls (Lavendelöl HRS) vorgenommen.
kommen [(R)-Linalylacetat > 98 %; (R)-(−)-Lina-
Die Auswahl der quantitativ zu bestimmenden Öl-
lool > 94 %4, 5)], ist der Drehwert des Öls mit
komponenten ist sinnvoll; die meisten sind im Öl
−12,5 bis − 7 ° eher niedrig. Dies hängt damit zu-
mit über 1 % enthalten. Die Zuordnung von La-
sammen, dass das optische Drehvermögen der bei-
vandulylacetat und Lavandulol (mindestens 0,2 %
den Enantiomere gering ist im Vergleich etwa zu
bzw. 0,1 %) ist etwas problematisch, da es sich um
dem anderer Terpene, z. B. den Enantiomeren von
sehr kleine Peaks handelt, an deren Stelle im
Carvon und Limonen. Damit kommt dieser Prü-
Chromatogramm auch andere Spurenkomponenten
fung auch keine sehr große Bedeutung für die Er-
des Öls einen Peak erzeugen könnten. Dies müsste
kennung von Verschnitten zu. Etwaige Zumi-
eigentlich mittels Massenspektrometrie (GC/MS-
schungen von racemischen Gemischen oder von
Kopplung) jeweils zuverlässig abgeklärt werden.
reinen (S)-(+)-Enantiomeren von Linalylacetat
Die beiden Substanzen sind aber für das Echte La-
oder Linalool wirken sich deshalb nur gering auf
vendelöl charakteristisch und wurden deshalb mit
den Drehwert des Öls aus.
aufgenommen.
Säurezahl: Die Bestimmung der Säurezahl wird Chirale Reinheit: Diese Reinheitsprüfung für Li-
in den Arzneibüchern nur bei wenigen ätherischen nalylacetat (1) und Linalool (2) ist eine Qualitäts-
Ölen gefordert. Sie muss normalerweise unter 1,0 prüfung, bei der die enantioselektive GC eigesetzt
liegen. Bei esterhaltigen Ölen (also auch bei La- wird; sie ist bei Lavendelöl besonders wichtig, da
vendelöl) könnten durch unsachgemäße Behand- es als teures Öl häufig verfälscht wird (siehe unter
lung die Ester hydrolysieren und die dabei frei „Gewinnung“). Untersuchungen an Labor-destil-
werdende Säure die Säurezahl des Öls erhöhen, lierten Ölen und Handelsölen mit multidimensio-
was der Ölqualität abträglich wäre. Früher war für naler GC haben gezeigt, dass an der Enantiome-
Lavendelöl ein höherer Wert von höchstens 2,0 renreinheit von Linalylacetat und Linalool mögli-
zugelassen, mittlerweile wurde er wie bei den an- che Verfälschungen erkannt werden können1, 11).
deren ätherischen Ölen auf höchstens 1,0 abge- Ein Beurteilungsschema auf Basis der Enantiome-
senkt. Dies entspricht, umgerechnet auf Essigsäu- renreinheit wird wie folgt vorgeschlagen11):
re, einem Säuregehalt von 0,1 %10).
– authentisch: (R)-(−)-Linalylacetat (−LA)
Chromatographisches Profil: Eine Kapillarsäule > 98 %, (R)-(−)-Linalool (−L) > 94 %
von 60 m Länge erfüllt alle Anforderungen an die – verdächtig: – LA 98 bis 95 % und − L 94 bis 85 %
Trennung kritischer Komponentenpaare. Dies sind – verfälschst: – LA < 95 % und −L < 85 %
im Lavendelöl Linalool (2) und Linalylacetat (1) Gemessen an diesen Vorgaben ist die Anforderung
sowie α-Terpineol und Lavandulol sowie Terpinen- des Arzneibuchs in Bezug auf die chirale Reinheit
4-ol und Lavandulylacetat. Letztere dienen zur des Linalylacetats sehr hoch, in Bezug auf Lina-
Überprüfung des Trennsystems, sie müssen mit lool etwas geringer. Die stationäre Phase für diese
einer Auflösung von 1,4 fast bis zur Basislinie ge- Prüfung ist nicht genau vorgegeben, gefordert wird
trennt sein (Basislinientrennung 1,5). Da bei der nur eine modifizierte β-Cyclodextrin-Phase. Sie
Abgrenzung von Lavendelöl gegenüber dem billi- muss in jedem Fall die Enantiomere des Linalyl-
geren Lavandinöl der Gehalt an 1,8-Cineol (7) eine acetats und des Linalools – beide werden in der
Kommentar zur Ph. Eur. 9.5 62. Lfg. 2019
Lavendelöl 4/4
Referenzlösung als Isomerengemisch eingesetzt – nung „BGB-174“ vertrieben wird, oder die modi-
trennen können und eine Abtrennung von Borneol fizierte β-Cyclodextrin-Phase der Lit.11).
möglich machen, weswegen der Referenzlösung E. Stahl-Biskup
auch Borneol zugesetzt wird. So kommt z. B. die
Säule aus Lit.1) in Betracht, die unter der Bezeich-
Pharmakologische Indikationen: Das HMPC (Ausschuss der EMA)
hat Lavendelöl für das Anwendungsgebiet „zur
Eigenschaften
Linderung leichter Stress- und Erschöpfungssym-
Pharmakodynamik2, 12, 13): Das ätherische Öl be- ptome sowie als Schlafhilfe“ als traditionelles
sitzt antimikrobielle Eigenschaften, die v. a. auf pflanzliches Arzneimittel eingestuft14).
den Gehalt an Linalool zurückzuführen sind. So
Verwendung: Lavendelöl wird innerlich (1 bis
konnte im Diffusionstest eine Hemmwirkung ge-
4 Tropfen auf Zucker oder in Honig) aufgrund sei-
gen zahlreiche Mikroorganismen, z. B. Escherichia
ner beruhigenden und entblähenden Eigenschaften
coli, Candida albicans und Staphylococcus au-
als mildes Sedativum bei Unruhezuständen, Ein-
reus, nachgewiesen werden, dagegen nicht gegen
schlafstörungen und funktionellen Oberbauchbe-
Pseudomonas aeruginosa. Lavendelöl wirkt kon-
schwerden eingesetzt. Auch ist es Bestandteil zahl-
servierend; im Vergleich mit Thymol-haltigen
reicher Badezusätze und Einreibungen. So wirkt es
Ölen erwies es sich als schwächer antimikrobiell
als mildes Antiseptikum und Stimulans bei Wun-
wirksam.
den, Sonnenbrand und Muskelschmerzen. Laven-
Antikonvulsive, spasmolytische und neurodepres- delöl ist zudem eine wichtige Duftkomponente in
sive Wirkungen wurden in zahlreichen tierexperi- der Aromatherapie sowie bei der Parfüm- und Sei-
mentellen Untersuchungen nach intraperitonealer fenherstellung. In der pharmazeutischen Techno-
Applikation gezeigt, zentral dämpfende Wirkun- logie dient es als Geruchskorrigens für Externa.
gen auch nach Inhalation des Öls. Diese Effekte Auch wird es als Insektenrepellent angewandt.
werden auf die Interaktion lipophiler Monoterpene
mit Biomembranen, Ionenkanälen, Transportern Nebenwirkungen und Kontraindikationen sind
und Rezeptoren zurückgeführt. Unter anderem nicht bekannt. Kombinationen mit anderen beruhi-
wird eine Blockade präsynaptischer spannungsab- gend oder karminativ wirksamen Drogen können
hängiger Calciumkanäle, ähnlich der Wirkung von sinnvoll sein.
Pregabalin, postuliert. M. Neubeck/Mu
Literatur 7) Pachaly, Lavendelöl. 8) Wagner, S. 180. 9) E. Reich,
A. Schibli, HPTLC for the Analysis of Medicinal Plants,
1) M. Braun, G. Franz, Pharm. Ztg. 146, 2493–2499 S. 76–78, Thieme, Stuttgart 2007. 10) E. Stahl-Biskup,
(2001). 2) E. Stahl-Biskup, U. Wissinger-Gräfenhahn E. Wilhelm, Dtsch. Apoth. Ztg. 136, 3019–3032 (1996).
V. Schulz, Lavandula, in: Hager. 3) B. M. Lawrence, 11) P. Kreis et al., PZ Wiss. 6, 149–155 (1993).
Perfum. Flavor. 25 (4), 70–91 (2004). 4) V. Schubert, 12) Wichtl, 6. Aufl., S. 367–369. 13) B. Van Wyk,
A. Mosandl, Phytochem. Anal. 2, 171–174 (1991). C. Wink, M. Wink, Handbuch der Arzneipflanzen,
5) B. Weinreich, S. Nitz, Chem. Mikrobiol. Technol. Le- 3. Aufl., Wiss. Verlagsges., Stuttgart 2015. 14) Herbal
bensmitt. 14, 117–124 (1992). 6) Ph. Morin, Medicinal Product Committee: www.ema.europa.eu/ema
H. Richard, in: Progress in Flavour Research, Hrsg. S. J. (eingesehen 5/2019).
Adda, S. 563–576, Elsevier, Amsterdam 1984.
62. Lfg. 2019 Kommentar zur Ph. Eur. 9.5
9.0/1624
1/3 Crocus für homöopathische Zubereitungen
Crocus für homöopathische Zubereitungen
Croci sativi stigma ad praeparationes
Homöopathische
Zubereitungen
homoeopathicas
Definition Andere Drogennamen: Saffron (engl.); Safran
(franz.); Zafferano (ital.); Azafrán (span.)
Stammpflanze: Der Echte Krokus, Crocus sativus
(Iridaceae), ist ein stengelloser, steriler Kryptophyt Inhaltsstoffe1): Die gelbe Farbe des Safrans ist auf
(Geophyt) mit unterirdischen Achsenorganen; er die Crocine (A- bis E-Crocin; 2 bis 6) zurückzu-
vermehrt sich durch ausdauernde Sprossknollen. führen (ca. 2 %)2), die wasserlöslichen Mono- und
Die grundständigen Blätter sind lang-linealisch. Diglycosylester der Polyendicarbonsäure Crocetin
Die Blüte besteht aus sechs blassblauen Peri- (1). Dieses Carotinoid ohne die Zuckerkomponen-
gonblättern, die sich nach unten in eine lange ten ist wasserunlöslich. β-D-Glucose (Glc) und/
Kronröhre fortsetzen. Der Fruchtknoten sitzt sehr oder das Disaccharid β-D-Gentiobiose (Gen) sind
tief in der Blüte knapp oberhalb der Knolle. Er die Esterkomponenten. Ursprünglich hatte man
schiebt über das Perigon hinausreichend einen den gelben Farbstoff des Safrans als Crocin be-
ca. 10 cm langen Griffel, der am Ende gebogen ist zeichnet. Später stellte man fest, dass er chemisch
und in drei orangerote Narbenschenkel ausläuft. nicht einheitlich ist3), die daraufhin isolierten Ester
Im Gegensatz zu den früh blühenden Zierpflanzen nannte man Crocine A bis E. Den Hauptanteil
der Gattung Crocus ist C. sativus ein Herbstblüher. macht der Digentianosylester aus (2; A-Crocin).
Die Verbreitung reicht vom Mittelmeergebiet bis Bezüglich der Konfiguration unterscheidet man
nach Indien. Crocine mit all-trans- und mit 13-cis-Konfigu-
ration2). Neben den Crocinen sind noch geringe
Droge1): Als Droge wird der Teil des Griffels be- Mengen „normaler“ Carotinoide wie α-, β-, γ-
nutzt, genau genommen die drei Narbenschenkel, Carotin, Lycopin und Zeaxanthin enthalten.
die durch ein kurzes Griffelstück zusammengehal- Die Droge enthält außerdem ca. 7 % fettes Öl und
ten werden. Geerntet wird die Droge im Septem- 0,4 bis 1,3 % flüchtige Komponenten mit der
ber und Oktober. Täglich werden morgens die sich Hauptkomponente Safranal (8). Dieses entsteht
öffnenden Blüten gepflückt und die Griffel ein- beim Trocknen aus dem bitter schmeckenden Ter-
schließlich der Narbenschenkel herausgetrennt. penglucosid Picrocrocin (7) durch Abspaltung von
Beim anschließenden Trocknen auf Haarsieben Glucose und Wasser1). In frischem Safran kann der
über glühender Holzkohle oder heißer Asche bildet Picrocrocingehalt bis 4 % ausmachen. Weitere
sich die typische orangerote bis braunrote Farbe flüchtige Komponenten sind Hydroxysafranal, 2-
und der charakteristische Geruch. Außer der arz- Phenylethanol, Naphthalin, Sesquiterpene und ver-
neilichen Verwendung ist die Droge ein wertvolles schiedene Isophorone (3,5,5-Trimethyl-2-cyclo-
Gewürz, das als „Safran“ weltweit gehandelt wird. hexenone).
Um 1 g Droge zu gewinnen, benötigt man 150 bis
160 Blüten. Hauptanbaugebiet des C. sativus ist
Südspanien, kleinere Mengen des Safrans werden Prüfung auf Identität
aus Kleinasien eingeführt.
C. Es ist nicht bekannt, welche Reaktion hier
Da Safran sehr wertvoll ist, muss immer mit einer stattfindet, vermutlich bilden sich die blauen
Verfälschung der Droge gerechnet werden, vor al- Mischoxide des Molybdäns.
lem, wenn sie pulverisiert gehandelt wird. Eine D. Die DC-Prüfung zielt auf die gelb gefärbten
ausführliche Beschreibung bekannter Verfälschun- Crocine (2 bis 6) und das Picrocrocin (7). Die
gen wird in Lit.1) beschrieben. Droge wird mit Methanol nach kurzem An-
Kommentar zur Ph. Eur. 9.0 62. Lfg. 2019
Crocus für homöopathische Zubereitungen 2/3
Grafik
lösen mit Wasser extrahiert, der Extrakt auf dern die Fluoreszenz jedoch nicht. Zuletzt wird
Kieselgel getrennt. Naphtholgelb (Martiusgelb, die DC mit Anisaldehyd-Reagenz, einem Uni-
nicht Naphtholgelb S!) und Sudanrot werden versalreagenz, besprüht. Nach dem Erhitzen
als Referenzsubstanzen aufgetragen; sie sind der DC-Platte erkennt man die ursprünglich
nicht in der Droge enthalten, sondern dienen gelben Zonen der Crocine als blaugrüne bis vi-
nur zur Lokalisation der Zonen auf der DC- olettblaue Zonen (Bildung von Triphenyl-
Platte. Da die Crocine leuchtend gelbe Zonen methanfarbstoffen; die Farben können variie-
bilden, wird die DC-Platte zunächst im Tages- ren). Die unter dem UV-Licht fluoreszenz-
licht ausgewertet. Unterhalb der Naphtholgelb- mindernde Zone des Picrocrocins färbt sich
Zone sind drei Crocine sehr deutlich zu erken- deutlich rot- bis rotviolett, wechselt jedoch
nen (RF 0,08; 0,25; 0,42). Die tabellarische Ab- nach einiger Zeit die Farbe nach blau. Safranal
bildung in der Ph. Eur. benennt nur die unterste lässt sich nur schwach blau anfärben. Weitere
und zugleich stärkste Zone als Crocin. Dabei blaue Zonen sind zu erkennen, vor allem nahe
handelt es sich um A-Crocin (2), das aufgrund der Front. Farbige Abbildungen finden sich in
der beiden Disaccharidreste das polarste Cro- Lit.5).
cin ist. Auch oberhalb der Naphtholgelb-Zone E. Es ist nicht bekannt, welche Substanzen mit
können noch zwei gelbe Crocine (RF 0,55; Diphenylboryloxyethylamin („Naturstoffre-
0,70) zu erkennen sein, die in der Abbildung agenz“) erfasst werden. Auf dem Filterpapier
der Ph. Eur. nicht eingezeichnet sind. Crocetin ist die Probe nicht immer eindeutig. Besprüht
(1), die freie Säure, liegt mit seiner gelben man eine mit der Methode C hergestellte DC-
Zone ungefähr auf der Höhe der Sudanrot- Platte mit Naturstoffreagenz, erhält man eine
Zone, ist aber kaum zu erkennen. fluoreszierende Zone ungefähr in der Mitte der
Danach wird die DC-Platte unter UV-Licht bei Platte (RF 0,45).
254 nm betrachtet. Damit lassen sich auf der
Höhe der Zonen von Naphtholgelb und Sudan- Andere Identitätsprüfungen: Die Crocine (2 bis
rot deutlich fluoreszenzmindernde Zonen er- 6), Crocetin, Picrocrocin und die cis-Crocine (Um-
kennen. Erstere (RF 0,53) wird in Lit.4) dem lagerungsprodukte der Crocine) lassen sich mittels
Picrocrocin (7) zugeordnet; die obere Zone HPLC nachweisen und quantitativ bestimmen; da-
dem Safranal (8; RF 0,88). Die gelben Zonen für kann entweder eine RP-18-Phase (2,5 μm) oder
der Crocine sind zwar zu erkennen, sie min- eine monolithische RP-18-Phase verwendet wer-
62. Lfg. 2019 Kommentar zur Ph. Eur. 9.0
3/3 Crocus für homöopathische Zubereitungen
den6). Eine GC-MS-Methode ermöglicht den im sichtbaren Bereich bei einer Wellenlänge von
Nachweis und die Quantifizierung der flüchtigen 440 nm vermessen. Wird der geforderte Grenzwert
Homöopathische
Zubereitungen
Komponenten6). nicht erreicht, könnten Narbenschenkel anderer
Crocus-Arten zugemischt sein, die kaum Farbstoffe
enthalten, z. B. die von C. albiflorum, C. speciosus
Prüfung auf Reinheit oder von C. variegatus. Makroskopisch und mi-
Färbevermögen: Mit Wasser werden die wasser- kroskopisch lässt sich dies nur schwer erkennen.
löslichen Crocine aus der Droge extrahiert und die
Farbintensität der Lösung spektralphotometrisch E. Stahl-Biskup
Literatur Acta 58, 1608–1620 (1975). 4) E. Stahl, W. Schild, in:
Pharmazeutische Biologie, Bd. 4 Drogenanalyse II,
1) A. Hensel, M. Rösing, Crocus, in: Hager. 2) P. A. Ta- S. 202, Gustav Fischer, Stuttgart 1981. 5) Wagner,
rantilis, M. Polissiou, M. Manfait, J. Chromatogr. A 664, S. 289. 6) M. Lechtenberg et al., Planta Med. 74, 764–
55–61 (1994). 3) H. Pfänder, F. Wittwer, Helv. Chim. 772 (2008).
Kommentar zur Ph. Eur. 9.0 62. Lfg. 2019
Crocus für homöopathische Zubereitungen 4/3
62. Lfg. 2019 Kommentar zur Ph. Eur. 9.0
9.5/0076
1/4 Codein-Monohydrat
Codein-Monohydrat
Codeinum monohydricum
Allgemeine Angaben reaktion der Gehaltsbestimmung durch eine poten-
tiometrische Endpunktbestimmung ersetzt.
Codein (1) ist ein Opiumalkaloid mit analgetischer
und antitussiver Wirkung. Die Substanz wird als CAS-Nr.: 6059–47–8
Hustenstiller bei Reizhusten und in Kombination
mit anderen Analgetika in der Schmerztherapie
76–57–3 (wasserfreie Substanz)
C
eingesetzt. PubChem-Nr.: CID 5284371 (wasserfrei)
Die Substanz ist auch in der USP und INTERN
beschrieben. DrugBank-Nr.: DB00318
Die Ph. Eur. führt auch das Hydrochlorid und Darstellung: Siehe den Kommentar zu Codein-
– ebenso wie die USP, JAP und INTERN – das phosphat-Hemihydrat (Ph. Eur.).
Codeinphosphat-Hemihydrat auf. Die USP be-
schreibt außerdem das Sulfat. Stabilität/Lagerung: Siehe den Kommentar zu
In der Ph. Eur. 9.5 wurde der Titel der Monographie Codeinphosphat-Hemihydrat (Ph. Eur.).
geändert, um den Hydratationsgrad anzugeben, so- Unverträglichkeiten: Bromid, Iodid
wie die HPLC-Methode der Prüfung auf verwandte
Substanzen durch ein UHPLC-Verfahren ersetzt, Synonyme: 3-Methylmorphin, Morphin-3-methyl-
das weitere, neu in die Transparenzliste aufgenom- ether
mene Verunreinigungen erfasst. Die Prüfung des
Trocknungsverlusts ist nun Teil der Identifikation Arzneibuchnamen: Codeine (USP), Codeine
der Substanz. Außerdem wurde die Farbindikator- Monohydrate (INTERN)
Grafik
Abb. 1: IR-Spektrum von Codein-Monohydrat in KBr (1,16 mg in 212 mg; Substanz ca. 15 h bei 105 °C getrocknet)
Kommentar zur Ph. Eur. 9.5 62. Lfg. 2019
Codein-Monohydrat 2/4
Eigenschaften (7, E), 14-Hydroxycodein (8, F), 14-Hydroxy-
codeinon (9, K) und das Codein-Dimer (10, C)
Codein-Monohydrat kristallisiert in orthorhombi- sind Oxidationsprodukte, Methylcodein (11, A),
schen Nadeln oder oktaedrischen Plättchen (aus das dimere 3-O-(Codein-2-yl)morphin (12, D) und
Wasser oder verdünntem Ethanol) und neigt zum das 7,7′-Oxybis(6-O-demethylthebain) (13, M)
Verwittern1). Nach Trocknen bei 80 °C schmilzt die sind Synthesenebenprodukte und Oripavin (14, L)
Substanz bei 154 bis 156 °C; sie sublimiert bei 140 ist ein Begleitalkaloid. Zusätzlich ist das aus einer
bis 145 °C unter einem Druck von 200 Pa. Eine Spaltung des Piperidinrings resultierende Codein-
gesättigte wässrige Lösung zeigt pH 9,8. methin (15) als mögliche Verunreinigung be-
1 g Substanz löst sich in 120 ml Wasser, 60 ml schrieben2).
Wasser bei 80 °C, 2 ml Ethanol, 18 ml Diethyl- Die Systemeignung wird anhand der Auflösung
ether oder 0,5 ml Chloroform. Codein ist leicht zwischen 14-Hydroxycodein (8, F) und Norcodein
löslich in Methanol, Amylalkohol (1-Pentanol) (5, H) sowie zwischen 3-O-(Codein-2-yl)morphin
und verdünnten Säuren, aber praktisch unlöslich in (12, D) und Methylcodein (11, A) überprüft. Me-
wässrigen Alkalihydroxiden. thylcodein (11, A) wird auf 1,0 % begrenzt, Nor-
codein (5, H) auf 0,25 %, das Codein-Dimer (10, C),
3-O-(Codein-2-yl)morphin (12, D) und 10-
Prüfung auf Identität
Hydroxycodein (7, E) auf jeweils 0,2 % und Mor-
Siehe auch den Kommentar zu Codeinphosphat- phin (2, B), Thebain (3, G), Codeinon (6, I) und
Hemihydrat (Ph. Eur.). 14-Hydroxycodein (8, F) auf jeweils 0,15 %. Wei-
A. Die USP gibt den Schmelzbereich 154 bis tere Substanzen dürfen einen Anteil von je 0,10 %
158 °C an (Ph. Eur.: 155 bis 159 °C), siehe auch nicht überschreiten, in der Summe sind maximal
unter „Eigenschaften“. 1,5 % Nebenprodukte zulässig.
B. Die Prüflösung wird unter Zusatz von Natron-
lauge hergestellt, um die gleichen Messbedin- Trocknungsverlust: Das Kristallwasser entspricht
gungen wie bei Codeinphosphat einzuhalten einem theoretischen Gehalt von 5,67 %. Da die
(vgl. Abb. 1 im Kommentar zu Codeinphos- Substanz bei Lagerung Wasser verlieren kann,
phat-Hemihydrat, Ph. Eur.). Die USP lässt wurde die untere Grenze auf 4,0 % festgelegt. Die
das UV-Spektrum in 0,05 M-Schwefelsäure USP gibt nur ein oberes Limit von 6,0 % an (4-
aufnehmen. stündige Trocknung bei 80 °C).
C. Vgl. Abb. 1.
Andere Identitätsprüfungen: Die USP identifi- Gehaltsbestimmung
ziert die Substanz anhand der Absorption bei Bei der Titration mit 0,1-M Perchlorsäure unter
284 nm gegen Codeinsulfat als Referenzsubstanz. potentiometrischer Endpunktanzeige wird der
Stickstoff protoniert.
Prüfung auf Reinheit Andere Bestimmungsmethoden: Siehe den
Siehe auch den Kommentar zu Codeinphosphat- Kommentar zu Codeinphosphat-Hemihydrat
Hemihydrat (Ph. Eur.). (Ph. Eur.). Die USP schreibt die Bestimmung in
wässriger Lösung vor. Codein wird in überschüs-
Verwandte Substanzen: Das Arzneibuch prüft siger 0,05 M-Schwefelsäure gelöst und der Über-
mit der UHPLC unter Gradientenelution auf Opi- schuss mit 0,1 M-Natronlauge gegen Methylrot
um-Begleitalkaloide, Oxidationsprodukte sowie zurücktitriert.
Nebenprodukte aus der Synthese. Die Begleitalka-
loide Morphin (2, B) und Thebain (3, G) werden
auch als Syntheseausgangsprodukte eingesetzt Metabolisierung
(siehe hierzu den Kommentar zu Morphinhydro-
chlorid, Ph. Eur.). Codein-N-oxid (4, J), Nor- Siehe den Kommentar zu Codeinphosphat-
codein (5, H), Codeinon (6, I), 10-Hydroxycodein Hemihydrat (Ph. Eur.).
62. Lfg. 2019 Kommentar zur Ph. Eur. 9.5
3/4 Codein-Monohydrat
Grafik
G. Scriba
Kommentar zur Ph. Eur. 9.5 62. Lfg. 2019
Codein-Monohydrat 4/4
Pharmakologische
Eigenschaften
Siehe den Kommentar zu Codeinphosphat-
Hemihydrat (Ph. Eur.).
Literatur
1) B. van Bockstael et al., Ann. Pharm. Franc. 49,
272–277 (1991). 2) N. R. Ayyangar, S. R. Bhide,
U. R. Kalkote, J. Chromatogr. 519, 250–255 (1990).
62. Lfg. 2019 Kommentar zur Ph. Eur. 9.5
9.5/2179
1/4 Pimobendan
Pimobendan für Tiere
Pimobendanum ad usum veterinarium
Allgemeine Angaben Die Dissoziationskonstanten betragen pKa1 = 4,9
und pKa2 = 11,45). In Analogie zu anderen Benz-
Pimobendan (6) ist ein für Hunde zugelassener imidazolderivaten beschreibt pKa1 vermutlich das
Arzneistoff zur Therapie der dilatativen Kardio- Dissoziationsgleichgewicht des protonierten Imid-
myopathie. Die Substanz wirkt durch Hemmung
der Phosphodiesterase III positiv inotrop und zu-
azol-Stickstoffs in Position 3 und pKa2 das Dissozia-
tionsgleichgewicht der Deprotonierung des Imid- P
sätzlich vasodilatierend. Derartige Substanzen azol-Stickstoffs in Position 1. Der n-Octanol/ Was-
werden auch als Inodilatatoren bezeichnet. ser-Verteilungskoeffizient bei pH 7,4 wurde mit
Pimobendan ist chiral, das linksdrehende Enan- log P = 2,39 bestimmt6). In Methanol liegen die UV-
tiomer (L-Isomer) ist pharmakologisch aktiver als Absorptionsmaxima bei 221, 267 und 328 nm (A11 cm %
5)
= etwa 1170 bis 1290) . (−)-Pimobendan schmilzt
das rechtsdrehende Enantiomer1, 2). Das Arznei-
buch beschreibt das Racemat. bei etwa 162 °C unter Zersetzung, der Drehwert be-
D = − 324,6 ° (c = 1; Methanol)
trägt [α] 25 4)
Aufgrund der ausschließlichen Anwendung am
Tier wurde mit der Ph. Eur. 9.5 der Titel der Mo- 1 g Pimobendan löst sich in etwa 5 ml Dimethyl-
nographie geändert und die Grenzwerte der ver- formamid, 400 ml Methanol, 700 ml Aceton und
wandten Substanzen angepasst. 4000 ml Chloroform5). Die Substanz ist praktisch
unlöslich in Wasser.
CAS-Nr.: 74150–27–9 (Racemat)
118428–37–8 [(−)-Pimobendan]
118428–27–9 [(+)-Pimobendan] Prüfung auf Identität
PubChem-Nr.: CID 4823 Vgl. Abb. 1.
Darstellung: 1 wird mit 4-Methoxybenzoesäu-
rechlorid (2) zum Benzamid 3 N-acyliert. Der
Prüfung auf Reinheit
Ringschluss zum 3,4-Dihydro-3(2H)-pyridazinon- Verwandte Substanzen: Das Arzneibuch prüft
Derivat 4 erfolgt durch Umsetzung mit Hydrazin. mit Gradienten-HPLC besonders auf das Synthe-
Katalytische Reduktion der Nitrogruppe von 4 er- senebenprodukt 5 (B) sowie die durch Hydrolyse
gibt das Amin 5 (Verunreinigung B), das beim Er- des Dihydropyrazinonrings resultierende Carbon-
hitzen in Eisessig zu Pimobendan (6) cyclisiert3). säure 7 (A). Die Systemeignung wird anhand der
Das pharmakologisch aktivere linksdrehende Auflösung zwischen den beiden Verunreinigungen
Enantiomer kann durch Racematspaltung mit (+)- überprüft. Die Nebenprodukte 5 (B) und 7 (A) so-
O,O-Dibenzoylweinsäure gewonnen werden4). wie jede weitere Verunreinigung werden auf je-
weils 0,20 % begrenzt, in der Summe dürfen Ne-
Synonyme: UD-CG 115 BS benprodukte 0,2 % nicht überschreiten.
Eigenschaften Gehaltsbestimmung
Pimobendan (6) ist ein weißes bis schwach gelbli- Bei der Titration im wasserfreien Milieu mit
ches Pulver. Die Substanz schmilzt unter Zerset- Perchlorsäure unter potentiometrischer Endpunkt-
zung bei 239 bis 244 °C. Pimobendanhydrochlorid anzeige wird vermutlich der Imidazol-Stickstoff in
schmilzt bei 311 bis 314 °C unter Zersetzung3). Position 3 protoniert.
Kommentar zur Ph. Eur. 9.5 62. Lfg. 2019
Pimobendan 2/4
Andere Bestimmungsmethoden: In pharmazeuti- hen Konzentrationen zusätzlich von CYP3A49).
schen Zubereitungen kann die Substanz photomet- Die Bestimmung von Pimobendan und des O-
risch oder chromatographisch bestimmt werden7, 8). Demethylmetaboliten in biologischem Material
kann mit der HPLC erfolgen10–12). Durch Verwen-
Metabolisierung dung chiraler stationärer Phasen ist auch eine
enantioselektive Bestimmung möglich13, 14).
Hauptmetabolit ist O-Demethyl-Pimobendan (8).
Die O-Demethylierung wird bei niedrigen Kon- G. Scriba
zentrationen von CYP1A2 katalysiert und bei ho-
Grafik
Grafik
62. Lfg. 2019 Kommentar zur Ph. Eur. 9.5
3/4 Pimobendan
Grafik
P
Abb. 1: IR-Spektrum von Pimobendan in KBr (0,875 mg in 200 mg)
Pharmakologische Synthese) vermittelt. Außerdem hemmt der Wirk-
stoff die Aktivität des Transkriptionsfaktors NF-κB
Eigenschaften15–17)
und damit die Produktion der Entzündungsmedia-
toren IL-1B, IL-6 und TNF-α.
Pharmakodynamik: Pimobendan ist ein positiv
inotrop und vasodilatierend wirkender Stoff. Wirk- Pharmakokinetik: 1 bis 4 h nach peroraler Verab-
mechanismus ist zum einen eine partielle Hem- reichung treten maximale Plasmaspiegel auf. Die
mung der Typ-III-Phosphodiesterase, daraus resul- Bioverfügbarkeit liegt bei 65 %. Pimobendan un-
tiert eine Erhöhung der intrazellulären cAMP- terliegt einem starken Leber-first-pass-Metabo-
Spiegel. Zum anderen wurde eine Erhöhung der lismus. Hierbei entsteht der aktive Metabolit O-
Calcium-Empfindlichkeit bei den kardialen Myofi- Demethyl-Pimobendan. Die Plasmaproteinbindung
lamenten durch Steigerung der Calciumaffinität an von Pimobendan wird mit 97 bis 99 % angegeben.
Troponin C festgestellt. Dies führt zu einer Ver- Auch die Gewebebindung von Pimobendan ist of-
besserung der Actin-Myosin-Interaktionen. Pimo- fenbar relativ stark, das Verteilungsvolumen be-
bendan bewirkt somit eine verbesserte Auswurf- trägt 2,6 l/kg Körpergewicht. Ebenso erreicht die
leistung des Herzens, ein erhöhtes Schlagvolumen Substanz in den Erythrozyten Konzentrationen, die
und einen reduzierten systemischen Gefäßwider- dem 6- bis 8fachen der korrespondierenden Plas-
stand. Innerhalb von 30 bis 60 min nach peroraler makonzentrationen entsprechen. 95 % der einge-
Gabe tritt ein Effekt auf, der bis zu 24 h anhält. nommenen Menge findet man in den Fäzes wieder,
Der Maximaleffekt wird zwischen 3 und 5 h nach überwiegend als Glucuronsäure- und Schwefelsäu-
der Einnahme beobachtet, unabhängig von den zu- rekonjugate von Pimobendan selbst und seinem
gehörigen Plasmakonzentrationen. Pimobendan aktiven Metaboliten. Die Eliminationshalbwerts-
liegt als Racemat vor, wobei die pharmakologische zeit beträgt 30 bis 60 min.
Wirkstärke des L-Isomers nahezu doppelt so hoch
ist wie die des D-Isomers. Der aktive Metabolit Indikationen: Unterstützende Behandlung mittel-
von Pimobendan, das O-Demethylderivat, besitzt schwerer bis schwerer Herzinsuffizienz bei Hun-
im Vergleich zur Muttersubstanz stärkere positiv den, Katzen und Vögeln
inotrope und etwa gleich starke vasodilatierende
Eigenschaften. Pimobendan ist zudem ein Im- Dosierung: 0,5 mg/kg peroral täglich, verteilt auf
munmodulator und wirkt entzündungshemmend. zwei Einzelgaben; bei Niereninsuffizienz ist keine
Die Wirkung wird teilweise durch die Hemmung Dosisreduktion erforderlich, jedoch möglicherwei-
von proinflammatorischen Cytokinen und einer se bei Leberinsuffizienz. Dies wird kontrovers dis-
Hemmung der Stickstoffmonoxid-Synthese (NO- kutiert.
Kommentar zur Ph. Eur. 9.5 62. Lfg. 2019
Pimobendan 4/4
Nebenwirkungen: Kopfschmerzen, Schwindel, Interaktionen: β-Adrenozeptorblocker wie Pro-
Depressionen, Erbrechen, Gewichtszunahme, pranolol und Calciumantagonisten wie Verapamil
Hautreaktionen oder ventrikuläre Arrhythmien und Diltiazem schwächen die positiv inotrope
Wirkung von Pimobendan ab.
Kontraindikationen: Überempfindlichkeit gegen
Pimobendan, Herzklappenstenose, hypertrophe Trächtigkeit und Laktation: Eine Applikation an
Kardiomyopathie, Aorten- und Pulmonalstenosen, tragende oder säugende Tiere sollte allenfalls nach
schwere Leberinsuffizienz strenger Nutzen-Risiko-Abwägung erfolgen.
Bei Angina pectoris, Diabetes mellitus, Herz-
rhythmusstörungen, chronisch obstruktiver Lun- Besondere Hinweise: Bei Langzeittherapie müs-
generkrankung, Leber- oder Nierenerkrankungen, sen Blutbild, Leber- und Nierenfunktionen, Blut-
Herzinfarkt sowie innerhalb von 3 Monaten nach druck, Herzfrequenz und EKG regelmäßig über-
einer Operation am Herzen ist besondere Vorsicht wacht werden.
geboten. M. Neubeck/Mu
Literatur Chaudhary, S. P. Gandhi, Indo Am. J. Pharm. Res. 6,
5863–5871 (2016). 9) S.-I. Kyriya et al., Drug Metab.
1) R. Jonas et al., Bioorg. Med. Chem. Lett. 4, 2585– Dispos. 28, 73-78 (2000). 10) P. D. Verdouw et al., Eur.
2588 (1994). 2) R. J. Solaro, K. Fujino, N. Sperelakis, J. Pharmacol. 126, 21–30 (1986). 11) S. Kuriya et al.,
J. Cardiovasc. Pharmacol. 14, S7–S12 (1989). J. Chromatogr. B Biomed. Sci. Appl. 744, 189–193
3) V. Austel et al. (Thomae), DE 2837161 (1980); C. A. (2000). 12) E. T. Bell et al., J. Vet. Pharmacol. Ther. 39
93, 114525 (1980). 4) V. Austel et al. (Thomae), DE 54–61 (2016). 13) K. M. Chu et al., J. Chromatogr.
3728244 (1989); C. A. 111, 97263 (1989). 5) Informa- Sci, 30, 171–176 (1992). 14) M. Asakura et al., J.
tion der Fa. Boehringer-Ingelheim. 6) K. Belsner, Chromatogr. 614, 135–141 (1993). 15) Martindale.
M. Pfeifer, B. Wilffert, J. Chromatogr. 629, 123–134 16) Drugdex®. 17) CliniPharm-Wirkstoffdaten unter:
(1993). 7) T. D. Dobariya, P. J. Multani, Int. J. Chem- www.vetpharm.unizh.ch, Stichwort „Pimobendan“.
tech Res. 5, 2154–2164 (2013). 8) S. S. Chitlange, M. P.
62. Lfg. 2019 Kommentar zur Ph. Eur. 9.5
Das könnte Ihnen auch gefallen
- Radon-Transformation: Aufdecken verborgener Muster in visuellen DatenVon EverandRadon-Transformation: Aufdecken verborgener Muster in visuellen DatenNoch keine Bewertungen
- 3 OptikDokument50 Seiten3 Optikmarciuc1Noch keine Bewertungen
- Grundlagen Der OptikDokument32 SeitenGrundlagen Der OptikAiglecity OukassouNoch keine Bewertungen
- 3physik V ODokument43 Seiten3physik V OAicha ElNoch keine Bewertungen
- 8 - Reflexion Und BrechungDokument9 Seiten8 - Reflexion Und BrechungOtto LinNoch keine Bewertungen
- A - Optik I 003 Inkllsg-2Dokument11 SeitenA - Optik I 003 Inkllsg-2Nen JakabosNoch keine Bewertungen
- Bending Light Remote Lab 1Dokument6 SeitenBending Light Remote Lab 1ScribdTranslationsNoch keine Bewertungen
- Versuch 3.3 - Polarisation Und DoppelbrechungDokument14 SeitenVersuch 3.3 - Polarisation Und DoppelbrechungDimitri KinNoch keine Bewertungen
- Zusammenfassung Physik Optik 2Dokument8 SeitenZusammenfassung Physik Optik 2nargesabozeidNoch keine Bewertungen
- 2.2. StreuungsregimeDokument3 Seiten2.2. StreuungsregimeChristian IriarteNoch keine Bewertungen
- Optische Messungen Am IsolatorkristallDokument23 SeitenOptische Messungen Am IsolatorkristallJonathan WildeNoch keine Bewertungen
- Lichtgeschwindigkeit Messen ImpulsmethodeDokument1 SeiteLichtgeschwindigkeit Messen Impulsmethodebeeblebrox9999Noch keine Bewertungen
- HolographieDokument30 SeitenHolographieseotutNoch keine Bewertungen
- Messung Des Geschwindigkeitsfeldes Vor Und Hinter Einem Modell-Propeller (Stationär Und Instationär) Mit Einem LaserDokument91 SeitenMessung Des Geschwindigkeitsfeldes Vor Und Hinter Einem Modell-Propeller (Stationär Und Instationär) Mit Einem LaserPic ColoNoch keine Bewertungen
- Protokoll BandenspektrumDokument15 SeitenProtokoll BandenspektrumDanielNoch keine Bewertungen
- 501 Photolumineszens An HalbleiterheterostrukturenDokument29 Seiten501 Photolumineszens An HalbleiterheterostrukturenNik EspenNoch keine Bewertungen
- Manual Dos Filtros ZeissDokument39 SeitenManual Dos Filtros ZeissJohnny JavierNoch keine Bewertungen
- Gentz Jan-Malte W Seminararbeit WWWDokument20 SeitenGentz Jan-Malte W Seminararbeit WWWsalmusahmed08Noch keine Bewertungen
- Datasheet CC39S-SN39600Dokument2 SeitenDatasheet CC39S-SN39600Alan CamposNoch keine Bewertungen
- 02 - Skript - Bnap - F3 - KSWE - 23 - 24 - Optik 1Dokument13 Seiten02 - Skript - Bnap - F3 - KSWE - 23 - 24 - Optik 1federica.togniniNoch keine Bewertungen
- Hauptprotokoll Abs 30 05Dokument8 SeitenHauptprotokoll Abs 30 05fatma_zehra_4Noch keine Bewertungen
- Versuch Nr. 5 Beugung-InterferenzDokument8 SeitenVersuch Nr. 5 Beugung-Interferenzfase18Noch keine Bewertungen
- Laser Lichtschnitt DDokument4 SeitenLaser Lichtschnitt DrblendNoch keine Bewertungen
- Week 4 Handout deDokument4 SeitenWeek 4 Handout degrabownilzNoch keine Bewertungen
- 4 - Ray-Tracing Und Globale Beleuchtung - 2015Dokument36 Seiten4 - Ray-Tracing Und Globale Beleuchtung - 2015psbshoghectoipjpqhNoch keine Bewertungen
- E 1144 NFDokument4 SeitenE 1144 NFkulin123456Noch keine Bewertungen
- PH LF 96 ADokument14 SeitenPH LF 96 Akulin123456Noch keine Bewertungen
- Capture D'écran . 2023-10-23 À 18.59.47Dokument6 SeitenCapture D'écran . 2023-10-23 À 18.59.47marwaarbaoui08Noch keine Bewertungen
- Phy131 hs2022 Blatt8Dokument2 SeitenPhy131 hs2022 Blatt8Jerry CohenNoch keine Bewertungen
- Phy131 hs2022 Blatt4Dokument2 SeitenPhy131 hs2022 Blatt4Jerry CohenNoch keine Bewertungen
- Protokoll Optisches-PumpenDokument23 SeitenProtokoll Optisches-PumpenDanielNoch keine Bewertungen
- 2012.10.16 Skript Vorlesung (1.farben) (LL)Dokument56 Seiten2012.10.16 Skript Vorlesung (1.farben) (LL)Philipp MackNoch keine Bewertungen
- Elektrodynamik Und RelativitätstheorieDokument78 SeitenElektrodynamik Und RelativitätstheorieTheodorNoch keine Bewertungen
- Leitz Interferenz-Einrichtung T 550-37b RDokument8 SeitenLeitz Interferenz-Einrichtung T 550-37b RMichNoch keine Bewertungen
- 30-531c-1 POLMI ADokument28 Seiten30-531c-1 POLMI APaolo Edoardo GagliardiNoch keine Bewertungen
- " Quantenanalogien": Versuchsprotokoll Zum F-PraktikumDokument19 Seiten" Quantenanalogien": Versuchsprotokoll Zum F-PraktikumПавел Лалочкин50% (2)
- Praktikumsversuch Zeitaufgelöste Photolumineszenz An GaAs Doppel-HeterostrukturenDokument12 SeitenPraktikumsversuch Zeitaufgelöste Photolumineszenz An GaAs Doppel-HeterostrukturenAndreas BarteltNoch keine Bewertungen
- Vorlesung 9 080722Dokument33 SeitenVorlesung 9 080722Olivia TagneNoch keine Bewertungen
- Folienserei 2Dokument19 SeitenFolienserei 2hotfrogeyNoch keine Bewertungen
- DezibelDokument22 SeitenDezibeltomNoch keine Bewertungen
- Konduktometrie Yeromin-1Dokument13 SeitenKonduktometrie Yeromin-1Медоежий ХвостNoch keine Bewertungen
- Protokoll Stefan-BoltzmannDokument23 SeitenProtokoll Stefan-BoltzmannDanielNoch keine Bewertungen
- Angewandte Chemie 2018 - From Open Shell Singlet DiradicaloidDokument6 SeitenAngewandte Chemie 2018 - From Open Shell Singlet DiradicaloidHoa PhanNoch keine Bewertungen
- Versuchsprotokoll B8Dokument9 SeitenVersuchsprotokoll B8pullermannNoch keine Bewertungen
- DR990-9S RadioaktivitätDokument58 SeitenDR990-9S RadioaktivitätAndy SherwinNoch keine Bewertungen
- Mikroaktorik GrundlageDokument12 SeitenMikroaktorik GrundlagejamilNoch keine Bewertungen
- Schwache Form Der DGL PDFDokument22 SeitenSchwache Form Der DGL PDFaprendiendoCNoch keine Bewertungen
- Präsentation: Die Beleuchtung Mit Künstlichem LichtDokument28 SeitenPräsentation: Die Beleuchtung Mit Künstlichem Lichtlicht.deNoch keine Bewertungen
- Optische NachrichtentechnikDokument4 SeitenOptische NachrichtentechnikRoNoch keine Bewertungen
- Oberflächen Und Grenzflächen: 8.1 EinführungDokument14 SeitenOberflächen Und Grenzflächen: 8.1 EinführungLazat M HesnbakriNoch keine Bewertungen
- Interferenz An Dünnen SchichtenDokument3 SeitenInterferenz An Dünnen Schichtenrandriamasy.fitiaNoch keine Bewertungen
- HandoutDokument2 SeitenHandoutDaniel B.Noch keine Bewertungen
- Phy131 hs2022 Blatt7Dokument2 SeitenPhy131 hs2022 Blatt7Jerry CohenNoch keine Bewertungen
- Leitz Kippkompensator K Tilting Compensator K Anleitung Instructions 550-004bDokument21 SeitenLeitz Kippkompensator K Tilting Compensator K Anleitung Instructions 550-004bMichNoch keine Bewertungen
- Praktikum Dispersionskurve PrismaDokument3 SeitenPraktikum Dispersionskurve PrismaPrandra Romes SitanggangNoch keine Bewertungen
- Protokoll ZeemannDokument23 SeitenProtokoll ZeemannDanielNoch keine Bewertungen
- Brummsignal OszilloskopDokument11 SeitenBrummsignal OszilloskopThomas AmselNoch keine Bewertungen
- Untersuchungen Zur Lichtkraft-AtomlithographieDokument54 SeitenUntersuchungen Zur Lichtkraft-AtomlithographieDirk KrogmannNoch keine Bewertungen
- Physik4 PDFDokument149 SeitenPhysik4 PDFlosttigerNoch keine Bewertungen
- Die Beiden Bucher Des Jeu CB 1 Und 2Dokument6 SeitenDie Beiden Bucher Des Jeu CB 1 Und 2Sabine KrollertNoch keine Bewertungen
- Moderne Magische Praxis. Modelle TechnikDokument27 SeitenModerne Magische Praxis. Modelle TechnikSabine KrollertNoch keine Bewertungen
- Vollenweider Reinkarnation Ein AbendlandDokument20 SeitenVollenweider Reinkarnation Ein AbendlandSabine KrollertNoch keine Bewertungen
- Der Stier Mit Der Weltsaule. Ein ArchaisDokument23 SeitenDer Stier Mit Der Weltsaule. Ein ArchaisSabine KrollertNoch keine Bewertungen
- Das Ophitendiagramm Nach Origenes ContraDokument177 SeitenDas Ophitendiagramm Nach Origenes ContraSabine KrollertNoch keine Bewertungen
- Gesund Werden Im SchlafDokument30 SeitenGesund Werden Im SchlafSabine KrollertNoch keine Bewertungen
- MassanalyseDokument32 SeitenMassanalyseSabine KrollertNoch keine Bewertungen
- The Serpent Symbol and The WorshipDokument296 SeitenThe Serpent Symbol and The WorshipSabine KrollertNoch keine Bewertungen
- Die Große SchmerzlügeDokument71 SeitenDie Große SchmerzlügeSabine KrollertNoch keine Bewertungen
- Libro 2Dokument40 SeitenLibro 2Jorge Luis Florez BlancoNoch keine Bewertungen
- Almanca ŞarkılarDokument6 SeitenAlmanca Şarkılarİrem NurNoch keine Bewertungen
- (Elsev.) BASICS Allgemeine Pharmakologie (2009)Dokument127 Seiten(Elsev.) BASICS Allgemeine Pharmakologie (2009)nalappaNoch keine Bewertungen
- UntitledDokument433 SeitenUntitledMuhammad ZanaNoch keine Bewertungen
- Stok Angio Update 23 Juni 2023Dokument906 SeitenStok Angio Update 23 Juni 2023Farah AlfarisiNoch keine Bewertungen
- Basisprotokoll ImpfnebenwirkungenDokument5 SeitenBasisprotokoll ImpfnebenwirkungenfeichthNoch keine Bewertungen
- Artikel Yuyun Saputri NingsiDokument11 SeitenArtikel Yuyun Saputri NingsiYuyun Saputri NingsihNoch keine Bewertungen
- 100 Antworten Auf Praktische Aufgaben Zur DosierungsberechnungDokument13 Seiten100 Antworten Auf Praktische Aufgaben Zur DosierungsberechnungScribdTranslationsNoch keine Bewertungen
- 13 ArzneimittelnDokument52 Seiten13 ArzneimittelnAmina DjugNoch keine Bewertungen