Beruflich Dokumente
Kultur Dokumente
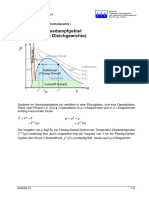
AB 31 - Die Hauptsätze Der Thermodynamik
Hochgeladen von
c0181511Originaltitel
Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
AB 31 - Die Hauptsätze Der Thermodynamik
Hochgeladen von
c0181511Copyright:
Verfügbare Formate
Die beiden Hauptsätze der Thermodynamik (update vom 23.11.
2023)
Die „Thermodynamik“ (von altgriechisch thermós, = ‚warm‘ und dýnamis, = Kra!‘) oder „Wärmelehre“ hat ihren Ursprung
im Studium der Dampfmaschinen und geht der Frage nach, wie man Wärme in mechanische Arbeit umwandeln kann.
Eine zentrale Bedeutung haben die Hauptsätze der Thermodynamik:
Der erste Hauptsatz („Energieerhaltungssatz“) und seine Konsequenzen
Er besagt, dass Energie lediglich von einer in eine andere Energieform umgewandelt, aber weder erzeugt noch vernichtet
werden kann – die Summe aller Energien in einem abgeschlossenen System ist also immer konstant.
Die innere Energie U eines geschlossenen Systems kann nicht gemessen und daher nicht als absolute Größe angegeben
werden. Was sich jedoch messen lässt, ist die Änderung der inneren Energie ∆U, die zum Beispiel im Verlauf einer
exothermen Reak:on abnimmt, da Wärme abgegeben wird.
Für ein geschlossenes System gilt: ∆U = Q + W, wobei: Q = innere Wärme und W = Volumenarbeit
Bei einer exothermen Reak:on kann also nicht nur Wärme freiwerden, ggf. kann durch die Energie auch Arbeit geleistet
werden, so kann z.B. durch den Elektronenfluss bei einer Redoxreak:on ein Motor betrieben werden. Ein anderes
Beispiel ist die Entstehung von Gasen bei einer chemischen Reak:on, die gegen den äußeren Lu!druck erfolgen muss
und daher eine Volumenarbeit darstellt:
Für die Volumenarbeit W gilt: W = - p ·∆V, wobei p = Druck und ∆V = Volumenänderung
Durch Einsetzen in ∆U = Q + W ergibt sich ∆U = Q - p ·∆V oder umgestellt: Q = ∆U + p ·∆V
Die innere Wärmemenge Q ist bei konstantem Druck p definiert als Qp = ∆H (mit ∆H = Reak:onsenthalpie, H = Heat)
Damit ergibt sich nun ∆H = ∆U + p ·∆V
Die Reak:onsenthalpie ∆H (auch ∆RH) kann experimentell bes:mmt werden, z.B. mithilfe eines Kalorimeters. Bei
Reak:onen, bei denen das Volumen konstant bleibt (∆V = 0), also ohne Beteiligung von Gasen, entspricht sie direkt der
Änderung der inneren Energie ∆U. Reak:onen, bei denen die innere Energie abnimmt (∆U = Unachher – Uvorher < 0)
bezeichnet man als exotherm, hier gilt entsprechend ∆H < 0. Nimmt dagegen die innere Energie zu (∆U = Unachher – Uvorher
> 0) bezeichnet man diese als endotherm, hier gilt entsprechend ∆H > 0.
Hinweis: Wenn hier von Qp die Rede ist, ist die „innere Wärme“ des Systems gemeint. Bei einer exothermen Reak:on ist
∆H < 0 und damit auch Qp < 0, die innere Wärme des Systems nimmt also ab. Die dabei freiwerdende Energie wird von
der Umgebung aufgenommen. Diese Wärmemenge ist „aus Sicht der Umgebung“ aber ein posi:ver Wert, da sie von ihr
als „Reak:onswärme“ aufgenommen wird und ihren Energieinhalt erhöht. Leider wird auch diese Wärmemenge als Q
bezeichnet, es ist also eine Frage der Betrachtung: Die Wärme Qp sinkt also im System um genau den Wert, um den die
Wärme Q der Umgebung steigt, es gilt also - Qp = Q. So gilt also für die von einem Kalorimeter gemessene
Reak:onswärme Q = - ∆H. Dies scheint ein Widerspruch zur obigen Defini:on Qp = ∆H zu sein, aber es wird eben dieselbe
Wärmemenge aus anderer Perspek:ve betrachtet (vgl. Angaben der Formelsammlung S.5/6)
Der zweite Hauptsatz der Thermodynamik
Er sagt aus, dass mechanische, elektrische oder chemische Energie fast vollständig in Wärmeenergie umgewandelt
werden können. In umgekehrter Richtung dagegen lässt sich vorhandene Wärmeenergie kaum und nur mit hohem
Aufwand in diese anderen Energien umwandeln. Eine andere Formulierung des zweiten Hauptsatzes lautet: „Ein
Perpetuum mobile zweiter Art ist unmöglich.“
Für die Chemie ist eine andere Betrachtungsweise hilfreicher, die die Entropie – vereinfacht gesagt ein Maß für die
Unordnung eines Systems – in den Blick nimmt. In dieser Formulierung heißt der zweite Hauptsatz der Thermodynamik:
„In einem isolierten System kann die Entropie nur zunehmen oder gleichbleiben.“
Das könnte Ihnen auch gefallen
- Klausurtraining BauphysikDokument325 SeitenKlausurtraining Bauphysikdominikdoblergmx.atNoch keine Bewertungen
- Physikalische Chemie - Formelsammlung (Gase - Thermodynamik - ThermochemieDokument14 SeitenPhysikalische Chemie - Formelsammlung (Gase - Thermodynamik - ThermochemieDvrm Mslm Gzr100% (1)
- Kritischer PunktDokument4 SeitenKritischer PunktModesto VaNoch keine Bewertungen
- Physikalische Grundlagen Der Vril-TechnologieDokument14 SeitenPhysikalische Grundlagen Der Vril-TechnologierainerNoch keine Bewertungen
- Thermo FormelsammlungDokument8 SeitenThermo FormelsammlungOliver HaslerNoch keine Bewertungen
- Simulation 1Dokument5 SeitenSimulation 1abasakNoch keine Bewertungen
- Heizen Ohne EnergiekostenDokument20 SeitenHeizen Ohne Energiekosten19simon85Noch keine Bewertungen
- Grundlagen Der Bauphysik-SKRIPTDokument246 SeitenGrundlagen Der Bauphysik-SKRIPTMaxMustermann228100% (1)
- Heiss Luft MotorDokument6 SeitenHeiss Luft MotorIvan IliashNoch keine Bewertungen
- PC1 FormelsammlungDokument6 SeitenPC1 FormelsammlungPhilipp HerbertNoch keine Bewertungen
- Vorlesung 2Dokument25 SeitenVorlesung 2Andrada Ana ChiruţăNoch keine Bewertungen
- 2 Hauptsätze Der Thermodynamik - FIVDokument2 Seiten2 Hauptsätze Der Thermodynamik - FIVleonidakrasniqi7Noch keine Bewertungen
- Folien Kapitel 1Dokument91 SeitenFolien Kapitel 1Lynn PolyxenaNoch keine Bewertungen
- Web WaermepumpeDokument8 SeitenWeb WaermepumpeSalma LaaroussiNoch keine Bewertungen
- Chemie 11. Klasse EnergetikDokument10 SeitenChemie 11. Klasse EnergetikJürgenNoch keine Bewertungen
- Vorlesung 3GDokument40 SeitenVorlesung 3GAndrada Ana ChiruţăNoch keine Bewertungen
- Annalen Der Physik - Volume 309 Issue 3 1901. Albert Einstein - Folgerungen Aus Den Capillaritätserscheinungen PDFDokument11 SeitenAnnalen Der Physik - Volume 309 Issue 3 1901. Albert Einstein - Folgerungen Aus Den Capillaritätserscheinungen PDFAlf SegNoch keine Bewertungen
- Arbeit (Physik)Dokument4 SeitenArbeit (Physik)yogolainNoch keine Bewertungen
- Thermodynamik II Labor Vorbereitungsskript Heimversuch 2021Dokument15 SeitenThermodynamik II Labor Vorbereitungsskript Heimversuch 2021a AshrafNoch keine Bewertungen
- Arbeit Energie LeistungDokument4 SeitenArbeit Energie LeistungAntonia XDNoch keine Bewertungen
- Thess EntropieDokument10 SeitenThess EntropiehungerburgNoch keine Bewertungen
- Das Chemische GleichgewichtDokument4 SeitenDas Chemische GleichgewichtEslem DridiiNoch keine Bewertungen
- Thermo Musterlösung 1-9Dokument74 SeitenThermo Musterlösung 1-9heydar.ma95Noch keine Bewertungen
- Wärmelehre Einige Vollständige LösungenDokument45 SeitenWärmelehre Einige Vollständige LösungenGion MurdochNoch keine Bewertungen
- Wirkungsgrad GluehlampeDokument4 SeitenWirkungsgrad Gluehlampegulb99999Noch keine Bewertungen
- Idealen GasesDokument20 SeitenIdealen GasesAndrada Ana ChiruţăNoch keine Bewertungen
- Folien Vorlesung WS11 PC IDokument61 SeitenFolien Vorlesung WS11 PC IPascal-Sourya HavemannNoch keine Bewertungen
- Neues TextdokumentDokument34 SeitenNeues Textdokumentabc xyzNoch keine Bewertungen
- Adiabatenexponent 2Dokument15 SeitenAdiabatenexponent 2UrgalNoch keine Bewertungen
- Zettel WS 2023 05Dokument2 SeitenZettel WS 2023 05影 ShadowZZZNoch keine Bewertungen
- Waermebilanz 2002Dokument20 SeitenWaermebilanz 2002Anonymous T02GVGzBNoch keine Bewertungen
- Forster MischdampfverfahrenDokument6 SeitenForster MischdampfverfahrenFrederic MuenchNoch keine Bewertungen
- 09 SRÜ AS KreisprozesseDokument6 Seiten09 SRÜ AS KreisprozessePhilippNoch keine Bewertungen
- Dokumen PDFDokument8 SeitenDokumen PDFffitrirrfNoch keine Bewertungen
- Physik PhysikDokument23 SeitenPhysik PhysikPhilipp FinkNoch keine Bewertungen
- Kap 35Dokument14 SeitenKap 35Mephistopheles1Noch keine Bewertungen
- V5 NeutralisationsenthalpieDokument14 SeitenV5 NeutralisationsenthalpieМедоежий ХвостNoch keine Bewertungen
- c1Dokument37 Seitenc1daggfdhsNoch keine Bewertungen
- 11 DdkmlkmoijoDokument36 Seiten11 Ddkmlkmoijofatjonmusli2016Noch keine Bewertungen
- 01 ET Isobar IsochorDokument1 Seite01 ET Isobar IsochorpenisNoch keine Bewertungen
- 08 Thermodynamik SoSeDokument21 Seiten08 Thermodynamik SoSeEslem DridiiNoch keine Bewertungen
- SonnenkollektorDokument14 SeitenSonnenkollektorMaría Gómez OchoaNoch keine Bewertungen
- DynamikDokument38 SeitenDynamikNedim LičinaNoch keine Bewertungen
- Die Mechanik der Wärme in gesammelten Schriften.: [1867] SammelbandVon EverandDie Mechanik der Wärme in gesammelten Schriften.: [1867] SammelbandNoch keine Bewertungen
- WUE Skript Mit Übungsaufgaben - 20230101 - 103841Dokument26 SeitenWUE Skript Mit Übungsaufgaben - 20230101 - 103841Hop NguyenNoch keine Bewertungen
- 06 SRÃ AS ProzessanalyseDokument4 Seiten06 SRÃ AS ProzessanalysePhilippNoch keine Bewertungen
- Beiblatt12 NassdampfgebietDokument3 SeitenBeiblatt12 Nassdampfgebiets.spam2Noch keine Bewertungen
- Seminar Nr. 2 Gelöste Probleme Teil 3Dokument23 SeitenSeminar Nr. 2 Gelöste Probleme Teil 3ScribdTranslationsNoch keine Bewertungen
- 03 SRÜ AS Energie EnthalpieDokument3 Seiten03 SRÜ AS Energie EnthalpiePhilippNoch keine Bewertungen
- Arbeit, Energie Und LeistungDokument10 SeitenArbeit, Energie Und LeistungcowawojiNoch keine Bewertungen
- Labor Für GasgesetzeDokument5 SeitenLabor Für GasgesetzeScribdTranslationsNoch keine Bewertungen
- Neues TextdokumentDokument26 SeitenNeues Textdokumentabc xyzNoch keine Bewertungen
- 3 Schularbeit UEbungenDokument7 Seiten3 Schularbeit UEbungenRaphael MarseilerNoch keine Bewertungen
- Zettel WS 2023 06Dokument2 SeitenZettel WS 2023 06影 ShadowZZZNoch keine Bewertungen
- PC1 Übungsblatt1 Lösung KorrekturDokument3 SeitenPC1 Übungsblatt1 Lösung KorrekturSherrine Hartono100% (1)
- WaermeuebertragungDokument15 SeitenWaermeuebertragungKnechtruprechtNoch keine Bewertungen
- Lab1 2023 - 2Dokument9 SeitenLab1 2023 - 2nmaturanvNoch keine Bewertungen
- RE 2 Geothermie 2013Dokument93 SeitenRE 2 Geothermie 2013rogenheiro99Noch keine Bewertungen
- Die Leichtmetall-KohleDokument8 SeitenDie Leichtmetall-KohlewoyaoxiaxiaNoch keine Bewertungen
- Physik ArbeitsbuchDokument2 SeitenPhysik ArbeitsbuchКанал ДжекаNoch keine Bewertungen
- Fit Für Die SündeDokument1 SeiteFit Für Die SündeMinka TNoch keine Bewertungen
- Pavatex - Das Dach - Technische DokumentationDokument36 SeitenPavatex - Das Dach - Technische Dokumentationlancaashire@swift.ch100% (1)
- Frisch Luft KomfortDokument12 SeitenFrisch Luft KomfortLunosVentilationNoch keine Bewertungen
- Oregon BAR 292 Weather StationDokument2 SeitenOregon BAR 292 Weather Stationmanuel fernandezNoch keine Bewertungen
- GH - 04 - MB - Feuchteschutz Holzbau - FD - Technik - 1Dokument8 SeitenGH - 04 - MB - Feuchteschutz Holzbau - FD - Technik - 1Christian SahliNoch keine Bewertungen













































![Die Mechanik der Wärme in gesammelten Schriften.: [1867] Sammelband](https://imgv2-1-f.scribdassets.com/img/word_document/314000649/149x198/ef99e7e5a9/1617226918?v=1)