Beruflich Dokumente
Kultur Dokumente
Enzymatik Proteine
Hochgeladen von
ad1ad2Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Enzymatik Proteine
Hochgeladen von
ad1ad2Copyright:
Verfügbare Formate
Enzymatik
Enzyme
Enzyme wirken als Biokatalysatoren Enzyme sind Proteine Erniedrigen Aktivierungsenergie biochemische Reaktionen werden ermglicht oder beschleunigt Strke ist unverzichtbar fr unseren Krper, enthlt schwer lsliche Stoe, die erst aufgespalten mssen bevor sie genutzt werden knnen. (Strke zerfllt sehr langsam und wre ohne Spaltung (Enzyme) unbrauchbar) Das Enzym im Speichel heit Amylase Amylase kann Aktivierungsenergie herabsenken, dass Krperwrme fr eine Reaktion ausreicht Enzyme sind substratspezisch (Ein Enzym kann nur ein ganz bestimmtes Substrat chemisch umsetzen => Schlssel-Schloss-Prinzip (Schlssel = Substrat / Schloss = Aktives Zentrum) Enzyme sind wirkungsspezisch (Ein Enzym kann sein Substrat nur in einer ganz bestimmten Weise umsetzen, d.h. nach einem bestimmten Reaktionstyp) Wechselwirkung von Enzym und Substrat ( Sto )
Hemmung kompetetive Hemmung: Konkurrenz um das aktive Zentrum durch einen chemisch hnlichen Sto fhrt je nach der Konzentration des "falschen" Substrats zur teilweisen oder vlligen Hemmung des Enzyms. Hier konkurriert der Hemmsto mit dem Substratmolekl um das aktive Zentrum. Die Hemmung ist reversibel und lsst sich durch Erhhung der Substratkonzentration rckgngig machen. allosterische Hemmung: Hemmstoe ohne chemische hnlichkeit mit dem Substrat binden sich an ein so genanntes allosterisches Zentrum, das ist neben dem aktiven (katalytischen) Zentrum eine weitere Bindungsstelle. Durch Anlagerung des Hemmstos wird das aktive Zentrum indirekt so verndert, dass das Substrat schlechter umgesetzt wird. Durch Erhhung der Substratkonzentration kann diese Hemmung nicht aufgehoben werden.
Beeinussung der Enzymaktivitt
1)
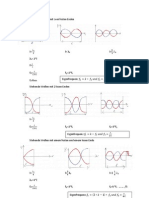
Substratkonzentration
Bei niedriger Subs.kon. ist die Geschwindigkeit der Umsetzung gering Jedes Enzym hat Maximalwert ( Max. Geschwindigkeit der Umsetzung) Je niedriger die Substratkonzentration desto unwahrscheinlicher ist es von einem Enzym getroen zu werden In lebenden Zellen wird der Maximalwert nie erreicht, da andere Stoe die Reaktion behindern
2)
Temperatur
Je hher die Temperatur desto grer ist die Reaktionsgeschwindigkeit Zwischen ca. 30 C und 50C Maximalwert Nach Maximalwert schnelle Abnahme der Reaktionsgeschwindigkeit, bis keine Wirkung des Enzyms erkennbar ist Hhere Temperaturen = strkere Teilchenbewegung hhere Wahrscheinlichkeit, dass sich Enzym und Substrat treen Bei Temperhhung um 10C erhht sich die Reaktionsgeschwindigkeit exponentiell ( Reaktionsgeschwindigkeits-Temperatur-Regel (RGT-Regel)) Temperatur verursacht Denaturierung Vernderung/Zerstrung der Tertirstruktur Hohe Temp. liefern so viel Energie, dass die Bindungskrfte der Struktur berwunden werden Das Enzym wird inaktiv!
3)
Der pH-Wert
Jedes Enzym besitzt ein spezisches pH-Optimum. Bei Abweichungen des Optimums sinkt die Aktivitt stark ab und erreicht den Nullwert Grund: Denaturierung Durch Suren / Basen Vernderung der Ladungsverteilung im Enzym Passform und Moleklfaltung geht verloren Einuss des Bindungspartners auf die Enzymaktivitt
Proteine 1. Proteinaufbau Bedeutung der Proteine 1. Transportproteine z.B. Hmoglobin 2. Hormone z.B. Insulin, Hypophysenhormone 3. Antikrper (Immunglobuline) 4. Strukturproteinez.B. Muskelprotein, Haut ,Sehnen 5. Membranproteine z.B. Tunnelprotein, Rezeptoren 6. Speicherproteine z.B. Milcheiwei 7. Enzyme z.B. Azetylcholinesterase 8. Toxinez.B. Bienengift, Schlangengifte Die Bausteine der Proteinmolekle: Aminosuren allgemeine Formel einer Aminosure:
Es gibt 20 verschiedene Aminosuren in biologischen Proteinen, d. h. 20 chemisch verschiedene R(este). 7 davon sind essentiell, d.h. sie knnen nicht vom Menschen hergestellt werden --> sie mssen in der Nahrung enthalten sein. Die Reste knnen polar (=hydrophil) sein oder unpolar (=lipophil). Dies ist wichtig fr die Funktion des Proteinmolekls in der Zelle z.B. die rumliche Form, die Verankerung in Biomembranen, die Anitt zu anderen chemischen Wirkstoen (Schlssel-Schloss-Prinzip) Die Peptidbindung Unter Abspaltung von Wasser knnen sich 2 Aminosuren verbinden. Dabei reagiert die Carboxylgruppe der einen Aminosure mit der Aminogruppe der anderen Aminosure zu einem Dipeptid. Der Bindungstyp heit Peptidbindung. Durch Reaktion mit weiteren Aminosuren entstehen immer lngere Ketten (Tripeptide, .....Polypeptide....ab 100: Proteine)
Aufbau der Proteinmolekle a) Primrstruktur Denition: Die Abfolge der Aminosuren in der Kette = Aminosuresequenz Bindungstyp : Peptidbindung b) Sekundrstruktur Die Polypeptidkette liegt nicht gestreckt vor, sondern entweder in Schraubenform = (a- Helix) oder als so genannte b- Faltblattstruktur. Bindungskrfte: Wasserstobrckenbindung = "HBrcken" c) Tertirstruktur Bindungskrfte:
H Brcken (Dipol-Anziehung/ polare Reste) Ionenbindungen (elektrisch geladene Reste durch zustzliche Suregruppe (-) oder Aminogruppe (+).) Van-der-Waals Krfte (unpolare Reste) Disuld Bindung "Schwefelbrcke" (echte Bindung d.h. strkste Bindungskraft, die die Raumstruktur stabilisiert.) --> hitzebestndige Proteine zeigen einen hohen Cystein-Gehalt!
d) Quartrstruktur Mehrere Polypeptidketten in Tertirstruktur knnen sich zusammenschlieen, um eine besondere biologische Funktion zu erfllen, z.B. Hmoglobin: vier Polypeptidketten bilden zusammen ein Transportmolekl fr Sauersto (roter Blutfarbsto in den Erythrozyten)
Das könnte Ihnen auch gefallen
- CytologieDokument14 SeitenCytologiekessy123100% (1)
- L Sung Ab Vom Einzeller Zum VielzellerDokument2 SeitenL Sung Ab Vom Einzeller Zum VielzellerKeine AhnungNoch keine Bewertungen
- Biologie-Abitur OekologieDokument42 SeitenBiologie-Abitur OekologieKings Knights100% (1)
- Biomembranen - VersucheDokument4 SeitenBiomembranen - VersucheChinakohl100% (1)
- Biologie Abitur BW 2023Dokument5 SeitenBiologie Abitur BW 2023linucsNoch keine Bewertungen
- FotosyntheseDokument6 SeitenFotosyntheseSamsonNoch keine Bewertungen
- Photosynthese:PflanzenDokument4 SeitenPhotosynthese:PflanzenAnni MalkemperNoch keine Bewertungen
- Biologie (Die Zelle)Dokument8 SeitenBiologie (Die Zelle)abendrealschuleNoch keine Bewertungen
- Grundlagen ZellbiologieDokument32 SeitenGrundlagen ZellbiologieJocelyne L. PhillipNoch keine Bewertungen
- Zusammenfassung PhysiologieDokument77 SeitenZusammenfassung PhysiologieRebecca ShaneNoch keine Bewertungen
- Lernzettel BioDokument5 SeitenLernzettel BioFabian Camilo Cruz BenitezNoch keine Bewertungen
- Isb Skript Biologie B 11 1Dokument30 SeitenIsb Skript Biologie B 11 1Aylin HeisenbergNoch keine Bewertungen
- Zellbiologie Und Biochemie - Zellmembran, Gesättigte Und Ungesättigte Fettsäuren, PhospholipideDokument6 SeitenZellbiologie Und Biochemie - Zellmembran, Gesättigte Und Ungesättigte Fettsäuren, PhospholipideПрофессор Иоанн Марк БрандетNoch keine Bewertungen
- EnzymeDokument14 SeitenEnzymechiller441Noch keine Bewertungen
- Zellbiologie 1Dokument25 SeitenZellbiologie 1EchaNoch keine Bewertungen
- Name Des ZellorganellsDokument2 SeitenName Des Zellorganellsfino_hlscherNoch keine Bewertungen
- Histologie Cytologie FaktenDokument67 SeitenHistologie Cytologie FaktenMichael BernartzNoch keine Bewertungen
- HistoDokument92 SeitenHistoalphaprimeNoch keine Bewertungen
- Zusammenfassung Proteine ChemieDokument13 SeitenZusammenfassung Proteine Chemiepinsel-borsteNoch keine Bewertungen
- Fotosynthese IDokument5 SeitenFotosynthese IFausto Cueva100% (1)
- Bio TestDokument14 SeitenBio TestMarcelo LiebmingerNoch keine Bewertungen
- Zellbio 1Dokument25 SeitenZellbio 1Michel BieleckiNoch keine Bewertungen
- Natura Kursstufe Baden WrttembergDokument109 SeitenNatura Kursstufe Baden WrttembergRadu CojusneanuNoch keine Bewertungen
- Scheffelgymnasium Skript Biologie6Dokument2 SeitenScheffelgymnasium Skript Biologie6Aylin Heisenberg0% (1)
- Enzymkinetik (3. Auflage)Dokument277 SeitenEnzymkinetik (3. Auflage)alimisaghian62Noch keine Bewertungen
- BIO Zusammenfassen GenetikDokument4 SeitenBIO Zusammenfassen GenetikJulia ErbeNoch keine Bewertungen
- Primärvorgänge Der FotosyntheseDokument1 SeitePrimärvorgänge Der FotosynthesePatr09Noch keine Bewertungen
- Biologie Klausur EFDokument5 SeitenBiologie Klausur EFBlxckRxseNoch keine Bewertungen
- Bio ZusammenfassungDokument6 SeitenBio ZusammenfassungAngela Amato100% (1)
- Biologie Abiturzusammenfassung - StoffabbauDokument12 SeitenBiologie Abiturzusammenfassung - Stoffabbaujxli.Noch keine Bewertungen
- Chemie ZusammenfassungDokument9 SeitenChemie ZusammenfassungMichael JohnsonNoch keine Bewertungen
- Themeninhalte Biologie GKDokument6 SeitenThemeninhalte Biologie GKBleon Mehmeti100% (1)
- Englisch PassivDokument8 SeitenEnglisch PassivLena KühleNoch keine Bewertungen
- Zusammenfassung ZellteilungDokument1 SeiteZusammenfassung Zellteilungj gNoch keine Bewertungen
- Lernzettel Bio Abi 2Dokument12 SeitenLernzettel Bio Abi 2besaNoch keine Bewertungen
- ABI Biologie GenetikDokument4 SeitenABI Biologie GenetikTigerlein50% (2)
- 00 - Vorlesung - Skript - ZusammenfassungDokument14 Seiten00 - Vorlesung - Skript - Zusammenfassungbernd5313Noch keine Bewertungen
- StoffwechselDokument2 SeitenStoffwechselTamaraLebitschnigNoch keine Bewertungen
- Bio SkriptDokument96 SeitenBio SkriptterminxNoch keine Bewertungen
- Organische Chemie Fuer SchuelerDokument415 SeitenOrganische Chemie Fuer SchuelerИосиф Виссарионович СталинNoch keine Bewertungen
- Europa PDFDokument526 SeitenEuropa PDFZsombor NagyNoch keine Bewertungen
- Biohefter Klasse 11Dokument10 SeitenBiohefter Klasse 11181610Noch keine Bewertungen
- GFS Biologie: Prokaryoten Und EukaryotenDokument16 SeitenGFS Biologie: Prokaryoten Und EukaryotenSophia RaabNoch keine Bewertungen
- Biologie Lernzettel Stoff Und EnergiebereitstellungDokument12 SeitenBiologie Lernzettel Stoff Und EnergiebereitstellungjuliastmsNoch keine Bewertungen
- Mitose MeioseDokument2 SeitenMitose MeioseMaureen SchapflNoch keine Bewertungen
- Scheffelgymnasium Skript Biologie14Dokument3 SeitenScheffelgymnasium Skript Biologie14Aylin Heisenberg100% (1)
- Kritischer PunktDokument4 SeitenKritischer PunktModesto VaNoch keine Bewertungen
- 6 - Zelluläre Organelle, Strukturen Und TransportvorgängeDokument43 Seiten6 - Zelluläre Organelle, Strukturen Und Transportvorgängeleechors_master100% (2)
- Biochemie AltfragenDokument29 SeitenBiochemie AltfragenKatarina Kaca GacevicNoch keine Bewertungen
- Bio-Abi K12Dokument30 SeitenBio-Abi K12ralfunzel100% (2)
- Zusammenfassung Genetik - 2Dokument65 SeitenZusammenfassung Genetik - 2luizawuaden100% (1)
- Photosynthese - Transport deDokument21 SeitenPhotosynthese - Transport deIsidora MirkovicNoch keine Bewertungen
- JG 12 - Klausur 1Dokument6 SeitenJG 12 - Klausur 1Aylisha FauerbachNoch keine Bewertungen
- 33 - LeberDokument20 Seiten33 - Leberleechors_masterNoch keine Bewertungen
- Gruppenarbeit Stereochemie PDFDokument12 SeitenGruppenarbeit Stereochemie PDFConsuelo StarkNoch keine Bewertungen
- 7 - Replikation Und GentechnikDokument35 Seiten7 - Replikation Und Gentechnikleechors_masterNoch keine Bewertungen
- Biochemie Schröder KomplettDokument25 SeitenBiochemie Schröder KomplettKatarina Kaca GacevicNoch keine Bewertungen
- 06 043111Dokument5 Seiten06 043111xd_toertchen4494Noch keine Bewertungen
- Diagnostik und Therapie von Schilddrüsenerkrankungen: Ein Leitfaden für Klinik und PraxisVon EverandDiagnostik und Therapie von Schilddrüsenerkrankungen: Ein Leitfaden für Klinik und PraxisNoch keine Bewertungen
- PNW Z25 PDFDokument5 SeitenPNW Z25 PDFad1ad2Noch keine Bewertungen
- Potentialtopfreferat1 PDFDokument17 SeitenPotentialtopfreferat1 PDFad1ad2Noch keine Bewertungen
- Wichtiger Als Stringente Abfolge: Sprachlich, Gestisch, Akustisch Und Optisch Dichte SituationenDokument2 SeitenWichtiger Als Stringente Abfolge: Sprachlich, Gestisch, Akustisch Und Optisch Dichte Situationenad1ad2Noch keine Bewertungen
- 180 Einfuehrung Struktur FunktionDokument3 Seiten180 Einfuehrung Struktur Funktionad1ad2Noch keine Bewertungen
- Musterloesung Optik TestDokument5 SeitenMusterloesung Optik Testad1ad2Noch keine Bewertungen
- Stehende Welle2Dokument1 SeiteStehende Welle2ad1ad2Noch keine Bewertungen
- Sport Zusammenfassung 2Dokument5 SeitenSport Zusammenfassung 2ad1ad2Noch keine Bewertungen
- Schwingungen - Eine Einführung PDFDokument22 SeitenSchwingungen - Eine Einführung PDFAryan DehganNoch keine Bewertungen
- 11 Lektuerevorbereitung Hinweise Fuer Den LehrerDokument4 Seiten11 Lektuerevorbereitung Hinweise Fuer Den Lehrerad1ad2Noch keine Bewertungen
- Ösungen: UfgabeDokument3 SeitenÖsungen: Ufgabead1ad2Noch keine Bewertungen
- BioegenetikDokument2 SeitenBioegenetikad1ad2100% (1)