Beruflich Dokumente
Kultur Dokumente
Grundwissen Chemie 8
Hochgeladen von
Eule100Copyright
Verfügbare Formate
Dieses Dokument teilen
Dokument teilen oder einbetten
Stufen Sie dieses Dokument als nützlich ein?
Sind diese Inhalte unangemessen?
Dieses Dokument meldenCopyright:
Verfügbare Formate
Grundwissen Chemie 8
Hochgeladen von
Eule100Copyright:
Verfügbare Formate
Grundwissen Chemie 8.
Jahrgangsstufe
G8
1. Stoffeigenschaften und Teilchenmodell
- Teilchenmodell: Alle Stoffe bestehen aus kleinsten Teilchen, am einfachsten aus Kugeln (Kugelteilchenmodell). Die Teilchen eines Stoffes sind untereinander gleich. Die Teilchen verschiedener Stoffe unterscheiden sich in ihrer Gre, ihrer Masse und ihren Anziehungskrften. - Aggregatszustand und Teilchenmodell: Aggregatszustand Ordnung der Teilchen Abstand zwischen den Teilchen Teilchenbewegung Anziehungskrfte zwischen den Teilchen fest regelmige Anordnung Teilchen berhren sich Teilchen schwingen auf ihren Pltzen wirken sehr stark flssig unregelmige Anordnung Teilchen berhren sich Teilchen wechseln ihre Pltze wirken stark gasfrmig vllig ungeordnet Abstand sehr gro sehr schnell, frei beweglich sind nicht wirksam
2. Elemente und Verbindungen
- Einteilung der Stoffe: Ein Reinstoff hat charakteristische Eigenschaften und ist einheitlich aufgebaut. Stoffgemische bestehen aus mehreren Reinstoffen. Ihre Eigenschaften hngen von Ihrem Mischungsverhltnis ab.
Stoffe
Heterogene Stoffe (stets Gemische) Homogene Gemische Homogene Stoffe
Reinstoffe
Chemische Verbindungen
Chemische Elemente
- Atome: Atome sind die Grundbausteine, aus denen die kleinsten Teile aufgebaut sind. Sie sind unzerstrbar, d.h. sie knnen durch chemische Vorgnge weder erzeugt noch vernichtet werden. Es gibt genauso viele Atomarten, wie es Elemente gibt. Die Atome eines Elements sind untereinander gleich. Atome unterschiedlicher Elemente unterscheiden sich in Ihrer Masse und Gre. - Element: Atome einer Art werden als Element bezeichnet. Sie sind im Periodensystem der Elmente zusammengefasst. - Molekle: Molekle sind elektrisch neutrale Teilchen, die aus mehreren Atomen zusammengesetzt sind. - Chemische Verbindung: Werden aus Atomen unterschiedlicher Art Molekle oder Ionen gebildet, so liegt eine Verbindung vor. - Ionen: Ionen sind elektrisch geladene Teilchen. Man unterscheidet Kationen (positiv geladene Teilchen) und Anionen (negativ geladene Teilchen). Auerdem unterscheidet man zwischen Atom- und Moleklionen.
Reinstoffe
Elementare Stoffe Chemische Verbindungen
Atome,
z.B. Eisen, Helium
Molekle
Bestehend aus gleichen Atomen z.B.. Stickstoff Sauerstoff
Ionen,
Kationen (z.B. Na+), Anionen (z.B. Cl-)
Molekle
Bestehend aus verschiedenen Atomen z.B.. Wasser, Ammoniak
3. Chemische Reaktionen und Energie
- Chemische Reaktion: Eine chemische Reaktion ist eine Umgruppierung von Atomen. Dabei werden Edukte (Ausgangsstoffe) verbraucht und Produkte (Endstoffe) gebildet. Chemische Reaktionen sind stets von einem Energieumsatz begleitet. - Reaktionsenergie: Bei jeder chemischen Reaktion ndert sich die innere Energie der beteiligten Stoffe. Diese nderung der inneren Energie heit Reaktionsenergie. Bei exothermen Reaktionen ist die inneren Energie der Produkte niedriger als die der Edukte. Bei endothermen Reaktionen besitzen die Produkte eine hhere Energie als die Edukte. - Energiediagramm:
Energie
Aktivierungsenergie
Edukte
freiwerdende Energie
Produkte
Reaktionsverlauf
Energieschema fr eine exotherme Reaktion
Energie
Aktivierungsenergie
Produkte
chemisch gespeicherte Energie
Edukte
Reaktionsverlauf
Energieschema fr eine endotherme Reaktion
- Aktivierungsenergie: Die zum Auslsen einer chemischen Reaktion bentigte Energie bezeichnet man als Aktivierungsenergie.
- Katalysator: Ein Katalysator ist ein Stoff, der die Geschwindigkeit einer Reaktion erhht, indem er die Aktivierungsenergie verringert. Er geht unverndert aus der Reaktion hervor. - Elementsymbole: Elementsymbole stehen fr die Atomart der betreffenden Elemente. Beispiel: Cu (Kupfer) oder Fe (Eisen) - Chemische Formel: Moleklformeln (z.B. H2O) geben an, wie viele Atome welcher Art das Molekl bilden. Verhltnisformeln (z.B. NaCl) geben das Atomanzahlverhltnis der beteiligten Elemente an. Indizes gelten nur fr das vorangestellte Element. - Reaktionsgleichung: Ein Reaktionsschema beschreibt eine chemische Reaktion durch den Namen der Edukte und Produkte. z.B. Kupfer + Jod Kupferiodid Eine Reaktionsgleichung ist eine Kurzbeschreibung einer chemischen Reaktion mit Elementsymbolen und Formeln. Die vor den Formel stehenden Faktoren (= Koeffizienten) beschreiben das Anzahlverhltnis, in dem die Teilchen miteinander reagieren. z.B. 2 Cu (s) + I2 (g) 2 CuI (s); exotherm - Wertigkeit: Unter der Wertigkeit eines Atoms versteht man die Anzahl der Wasserstoff-Atome, die dieses Atom, in einer Verbindung bindet oder ersetzt. Wasserstoffatome sind einwertig. Mithilfe der Wertigkeit lsst sich das Atomanzahlverhltnis und damit die Verhltnisformel einer chemischen Verbindung vorhersagen. Beispiel: Im Aluminiumoxid sind dreiwertige Aluminium-Atome mit zweiwertigen Sauerstoff-Atomen verbunden. Demnach ergibt sich die Verhltnisformel von Aluminiumoxid als Al2O3
4. Atombau und Periodensystem
- Atombau: Ein Atom ist aus Atomkern und Atomhlle aufgebaut. Der Atomkern ist positiv geladen und enthlt fast die gesamte Masse des Atoms. Die Atomhlle enthlt die negativ geladenen Elektronen. - Bau des Atomkerns: Der Atomkern besteht aus Nukleonen: Protonen und Neutronen. Unterscheiden sich die Atome eines Elementes in der Neutronenzahl, handelt es sich um Isotope.
- Aufbau der Atomhlle: Die Atomhlle ist in Energiestufen gegliedert, die als Schalen veranschaulicht werden knnen. Die Elektronenschalen werden von innen nach auen mit K, L, M, N, O und Q bezeichnet. Fr die maximale Anzahl z an Elektronen pro Schale gilt die Gleichung: z = 2n (n = Energiestufe) Die Anordnung der Elektronen eines Atoms auf den verschiedenen Energiestufen bezeichnet man als Elektronenkonfiguration. Die Elektronen der ueren Schale bezeichnet man als Auen- oder Valenzelektronen; sie bestimmen das chemische Verhalten der Elemente. - Periodensystem (PSE): Im PSE sind die Elemente nach steigender Kernladungszahl ( = Ordnungszahl) angeordnet. Die waagrechten Zeilen im PSE sind die Perioden. Periodennummer: Zahl der Energiestufen (Elektronenschalen) Die senkrechten Spalten im PSE sind die Gruppen. Gruppennummer: Zahl der Auenelektronen (Valenzelektronen) Ordnungszahl: Zahl der Protonen = Zahl der Elektronen
- Elementfamilien: Alkalimetalle (I. Hauptgruppe) sind reaktionsfreudige Leichtmetalle mit niedrigen Schmelztemperaturen und geringer Hrte. Die Halogene (VII. Hauptgruppe) sind reaktionsfreudige Nichtmetalle, die aus zweiatomigen Molekle bestehen. Edelgase (VIII. Hauptgruppe) kommen als einzelne, unverbundene Atome vor und gehen praktisch keine Verbindungen ein. Die Atome der Edelgase Neon, Argon und Xenon besitzen 8 Elektronen in der Auenschale, man spricht vom Elektronenoktett. - Oktettregel: In den meisten Verbindungen nehmen die Atome die Elektronenkonfiguration der Edelgasatome an, so dass sie auf der ueren Schale die Edelgaskonfiguration von 8 Elektronen erreichen. - Elektronendonatoren: Metallatome geben bei Reaktionen mit Nichtmetallatomen Elektronen ab und werden zu Kationen. Metallatome sind Elektronendonatoren. - Elektronenakzeptoren: Nichtmetallatome nehmen bei chemischen Reaktionen mit Metallatomen Elektronen auf und werden so zu Anionen. Nichtmetallatome sind Elektronenakzeptoren. - Valenzstrichformel (Lewis-Formel): Atome und ihre Bindungen in Moleklen werden durch Valenzstrichformeln dargestellt. Regeln zum Erstellen von Valenzstrichformeln 1. Die Elementsymbole werden entsprechend der Verknpfung der Atome im Molekl angeordnet.
2. Man zeichnet an jedem Elementsymbol die Auenelektronen als Punkte ein. Die Elektronen der inneren Schalen bleiben unbercksichtigt. 3. Die Punkte fr die Elektronen stehen ber unter, sowie rechts und links neben dem Elementsymbol. Der 5. bis 8. Punkt bildet mit einem schon vorhandenen Punkt ein Punktepaar. 4. Zwischen den Atomen werden nun so viele bindende Elektronenpaare gebildet, dass fr alle Atome die Oktettregel erfllt ist. Dabei sind Einfachbindungen und Mehrfachbindungen mglich. HAtome gehen nur Einfachbindungen ein. 5. In der endgltigen Valenzstrichformel werden bindende und nichtbindende Elektronenpaare schlielich durch einen Strich dargestellt.
5. Chemische Bindungsarten
- Vergleich der Bindungstypen: Bindungstyp Bindungspartner Art der Teilchen Ionenbindung (IB) Metall + Nichtmetall Atombindung (AB) = Elektronenpaarbindung Nichtmetall + Nichtmetall Metallbindung (MB) viele Metalle
+ + +
Molekle gemeinsame(s) Elektronenpaar(e) Gerichtet auf Partner Molekl gasfrmig, flssig, fest meist niedrig meist unlslich in Wasser, aber gut lslich in organischen Lsungsmittel unterschiedlich Nichtleiter
+ + +
+ + +
+ + +
+ + +
Kationen + Anionen Bindung durch: elektrostatische Anziehungskrfte zwischen den positiv und negativ geladenen Ionen allseits Ionengitter fest meist sehr hoch oft gut in Wasser lslich, aber unlslich in organischen Lsungsmitteln nicht verformbar, sondern hart und sprde leiten als Schmelze und wsserige Lsungen durch Ionen (Leiter 2. Klasse)
Metallionen und frei bewegliche Elektronen elektrostatische Anziehungskrfte zwischen Elekronengas und Atomrmpfen allseits Metallgitter fest, Ausnahme. Hg meist hoch unlslich in Wasser oder organischen Lsungsmittel meist gut verformbar gute elektrische Leiter (Leiter 1. Klasse)
Bindungsrichtung Name des Verbandes Aggregatszustand bei Normalbedingungen Schmelz- und Siedepunkte Lslichkeit Verformbarkeit elektrische Leitfhigkeit
Das könnte Ihnen auch gefallen
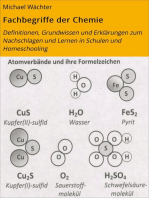
- Fachbegriffe der Chemie: Definitionen, Grundwissen und Erklärungen zum Nachschlagen und Lernen in Schulen und HomeschoolingVon EverandFachbegriffe der Chemie: Definitionen, Grundwissen und Erklärungen zum Nachschlagen und Lernen in Schulen und HomeschoolingNoch keine Bewertungen
- Merksätze und Formeln Chemie: Kleines Lern- und Nachschlagebuch zum Lernen für die Schule und im HomeschoolingVon EverandMerksätze und Formeln Chemie: Kleines Lern- und Nachschlagebuch zum Lernen für die Schule und im HomeschoolingNoch keine Bewertungen
- Grundwissen ChemieDokument11 SeitenGrundwissen Chemieasdfgh6Noch keine Bewertungen
- Allgemeine ChemieDokument31 SeitenAllgemeine ChemieTu Tzu100% (1)
- Wiederholung Chemische Bindung Klasse 10Dokument7 SeitenWiederholung Chemische Bindung Klasse 10Juliana AlterioNoch keine Bewertungen
- Chemie ZusammenfassungDokument9 SeitenChemie ZusammenfassungMichael JohnsonNoch keine Bewertungen
- Gesamte ZusammenfassungDokument58 SeitenGesamte ZusammenfassungPauli NeNoch keine Bewertungen
- Chemie 11. Klasse EnergetikDokument10 SeitenChemie 11. Klasse EnergetikJürgenNoch keine Bewertungen
- Formelnphysik08 PDF 17724Dokument2 SeitenFormelnphysik08 PDF 17724Gymnasium AlbertinumNoch keine Bewertungen
- ChemieDokument21 SeitenChemieaustroschrottyNoch keine Bewertungen
- Lernzettel Organische Chemie 1.0 PDFDokument20 SeitenLernzettel Organische Chemie 1.0 PDFHajer Al-KoofeeNoch keine Bewertungen
- Chemie LernzettelDokument30 SeitenChemie LernzettelMerlin Spielmann100% (1)
- Chemie UebungDokument5 SeitenChemie Uebungnobody_pbNoch keine Bewertungen
- Energetische BetrachtungDokument1 SeiteEnergetische BetrachtungMaxlNoch keine Bewertungen
- Skript Zur Vorlesung Anorganische ChemieDokument194 SeitenSkript Zur Vorlesung Anorganische ChemiemaraboschiNoch keine Bewertungen
- Allgemeine Organische Chemie 2Dokument95 SeitenAllgemeine Organische Chemie 2florin aniteiNoch keine Bewertungen
- Uni Halle FSP M ChemieDokument2 SeitenUni Halle FSP M ChemieION IONNoch keine Bewertungen
- Zusammenfassung - Chemie - 11 - 2Dokument13 SeitenZusammenfassung - Chemie - 11 - 2Hans BittingerNoch keine Bewertungen
- Chemie LernzusammenfassungDokument60 SeitenChemie LernzusammenfassungTuennes100% (3)
- Physik Lehr - Und Übungsbuch - (Frühe Quantentheorie Und Atommodelle)Dokument38 SeitenPhysik Lehr - Und Übungsbuch - (Frühe Quantentheorie Und Atommodelle)Fadi DandanNoch keine Bewertungen
- Grundwissen10 PDF 76957Dokument3 SeitenGrundwissen10 PDF 76957Gymnasium AlbertinumNoch keine Bewertungen
- Analytische ChemieDokument166 SeitenAnalytische ChemieyogolainNoch keine Bewertungen
- Chemie Basics eDokument74 SeitenChemie Basics eFranke SchifflerNoch keine Bewertungen
- Chemie 4 + 5Dokument3 SeitenChemie 4 + 5Angela AmatoNoch keine Bewertungen
- 13 Chemische ThermodynamikDokument38 Seiten13 Chemische ThermodynamikLukas M.Noch keine Bewertungen
- Deutsch Komplex - Biologie 2Dokument16 SeitenDeutsch Komplex - Biologie 2Lisa KirillovaNoch keine Bewertungen
- ChiralitätDokument11 SeitenChiralitätMichael DreifkeNoch keine Bewertungen
- Abi Lernzettel MATHE LKDokument61 SeitenAbi Lernzettel MATHE LKRojinNoch keine Bewertungen
- Deutsch Komplex - Chemie 1Dokument179 SeitenDeutsch Komplex - Chemie 1Polina100% (2)
- Organische Chemie Uniskript 3Dokument29 SeitenOrganische Chemie Uniskript 3UDGARD100% (1)
- Formelsammlung ChemieDokument9 SeitenFormelsammlung ChemieTim ScullyNoch keine Bewertungen
- Chemie LernzettelDokument5 SeitenChemie LernzettelAsiye KayaNoch keine Bewertungen
- Grundwissen m5 33401Dokument2 SeitenGrundwissen m5 33401Gymnasium AlbertinumNoch keine Bewertungen
- Rechentrainer "Schlag Auf Schlag - Rechnen Bis Ichs Mag" ProbekapitelDokument10 SeitenRechentrainer "Schlag Auf Schlag - Rechnen Bis Ichs Mag" ProbekapitelSilvio Gerlach100% (1)
- Mathe GK Zusammenfassung PDFDokument20 SeitenMathe GK Zusammenfassung PDFCelina S.Noch keine Bewertungen
- 1 15-Ungleichungen-2 0 0Dokument52 Seiten1 15-Ungleichungen-2 0 0Günter ZimmelNoch keine Bewertungen
- Formelsammlung Thermodynamik IDokument14 SeitenFormelsammlung Thermodynamik IiittzzeellNoch keine Bewertungen
- Organische Chemie Fuer SchuelerDokument415 SeitenOrganische Chemie Fuer SchuelerИосиф Виссарионович СталинNoch keine Bewertungen
- 12/1 Chemie GKDokument48 Seiten12/1 Chemie GKjames.fox.pkg100% (3)
- Vorkurse 201920Dokument12 SeitenVorkurse 201920Lina OlmosNoch keine Bewertungen
- Formelsammlung ThermodynamikDokument2 SeitenFormelsammlung ThermodynamikAiglecity OukassouNoch keine Bewertungen
- FSP - Physik M KursDokument4 SeitenFSP - Physik M Kursshayeste.khodadadNoch keine Bewertungen
- Einführung in Die Vektorgeometrie Und Lineare AlgebraDokument104 SeitenEinführung in Die Vektorgeometrie Und Lineare AlgebraNoshaba CheemaNoch keine Bewertungen
- Das Bohrsche AtommodellDokument3 SeitenDas Bohrsche AtommodellMax MuellerNoch keine Bewertungen
- Fachsemester 2, Anorganische Chemie 1Dokument102 SeitenFachsemester 2, Anorganische Chemie 1fur den kriegNoch keine Bewertungen
- Bio Abitur VorbereitungDokument6 SeitenBio Abitur VorbereitungJulia ErbeNoch keine Bewertungen
- Aufgabensammlung ElektrotechnikDokument188 SeitenAufgabensammlung Elektrotechnikhafida hafoudaNoch keine Bewertungen
- Physikalische Chemie - Formelsammlung (Gase - Thermodynamik - ThermochemieDokument14 SeitenPhysikalische Chemie - Formelsammlung (Gase - Thermodynamik - ThermochemieDvrm Mslm Gzr100% (1)
- Deutsch - Komplex - Biologie - 2 MDokument16 SeitenDeutsch - Komplex - Biologie - 2 MAnonymous mICQQZHJkNoch keine Bewertungen
- Mathematik Abitur 2014Dokument2 SeitenMathematik Abitur 2014STARK VerlagNoch keine Bewertungen
- Englisch PassivDokument8 SeitenEnglisch PassivLena KühleNoch keine Bewertungen
- Skript OCIIDokument116 SeitenSkript OCIIKevin Coëmginus EquesNoch keine Bewertungen
- Handbuch Chemie GDokument190 SeitenHandbuch Chemie GAlejandro SandovalNoch keine Bewertungen
- Jürgen Schatz, Robert Tammer - Erste Hilfe - Chemie Und Physik - Für Mediziner (Springer-Lehrbuch) - Springer, Berlin (2007)Dokument543 SeitenJürgen Schatz, Robert Tammer - Erste Hilfe - Chemie Und Physik - Für Mediziner (Springer-Lehrbuch) - Springer, Berlin (2007)CorinaNoch keine Bewertungen
- PC1 FormelsammlungDokument6 SeitenPC1 FormelsammlungPhilipp HerbertNoch keine Bewertungen
- Grundlagen ZellbiologieDokument32 SeitenGrundlagen ZellbiologieJocelyne L. PhillipNoch keine Bewertungen
- 12/1 Mathe LK (Analytische Geometrie)Dokument28 Seiten12/1 Mathe LK (Analytische Geometrie)james.fox.pkg100% (2)
- Alte Chemie Klausuren Uni HamburgDokument20 SeitenAlte Chemie Klausuren Uni HamburgpanakosNoch keine Bewertungen
- Logico Erde EntstehtDokument2 SeitenLogico Erde EntstehtEule100Noch keine Bewertungen
- Physio Vital Voltaren App Taschentrainer A6 160208Dokument23 SeitenPhysio Vital Voltaren App Taschentrainer A6 160208Eule100100% (2)
- Karate TakaDokument14 SeitenKarate TakaEule100Noch keine Bewertungen
- Erde KlimazonenDokument5 SeitenErde KlimazonenEule100Noch keine Bewertungen
- Erde LueckentextDokument2 SeitenErde LueckentextEule100Noch keine Bewertungen
- Ameisen HeftDokument4 SeitenAmeisen HeftEule100Noch keine Bewertungen
- Der Wolf InfoDokument4 SeitenDer Wolf InfoEule100Noch keine Bewertungen
- Loewen ZahnDokument9 SeitenLoewen ZahnEule100Noch keine Bewertungen
- BaerlauchDokument8 SeitenBaerlauchEule100Noch keine Bewertungen
- Herz Und BlutkreislaufDokument9 SeitenHerz Und BlutkreislaufEule100100% (2)
- Talkingfood Vitaminen Auf Der SpurDokument27 SeitenTalkingfood Vitaminen Auf Der SpurEule100Noch keine Bewertungen
- Skelett BeweglichkeitDokument1 SeiteSkelett BeweglichkeitEule100Noch keine Bewertungen
- NadelbaeumeDokument31 SeitenNadelbaeumeEule100100% (1)
- Atmungs SystemDokument9 SeitenAtmungs SystemEule100Noch keine Bewertungen
- Erkundung WaldtiereDokument5 SeitenErkundung WaldtiereEule100Noch keine Bewertungen
- Steuer Der Handel Zwischen Nord Und WesteuropaDokument86 SeitenSteuer Der Handel Zwischen Nord Und WesteuropaEule100Noch keine Bewertungen
- WoelfeDokument40 SeitenWoelfeEule100Noch keine Bewertungen
- Ionenbindung, - Strukturtypen, - Metalle - SkriptDokument45 SeitenIonenbindung, - Strukturtypen, - Metalle - SkriptRafael R.Noch keine Bewertungen
- DMPS GermanDokument48 SeitenDMPS Germangert80Noch keine Bewertungen
- Einführung in Die Allgemeine Chemie Lehrbuch Für DaF-Lerner Ab A2 by Selma SagmanDokument310 SeitenEinführung in Die Allgemeine Chemie Lehrbuch Für DaF-Lerner Ab A2 by Selma SagmanDaria Mykhailova67% (3)
- SkripsiDokument70 SeitenSkripsiIrfan Satria PermanaNoch keine Bewertungen
- ALUDokument56 SeitenALUGustav NattererNoch keine Bewertungen